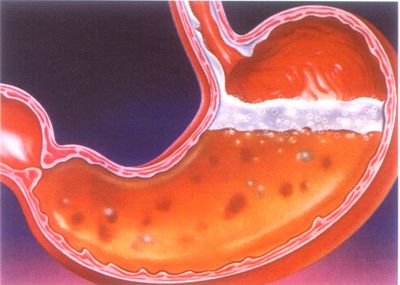
Суха солна киселина. Соли на солна киселина
Водня. Техническата киселина има матов зеленикав цвят поради съдържанието на хлор и соли. Максимална концентрация солна киселинаблизо 36%; такава разлика е възможна 1.18 g / cm3, poіtrya vín "dim", т.к. Виждам H Правя малки капчици с водна пара.
солна киселина bula vídoma алхимици в kíntsi 16 st, yakí otrimuvali я нейната й ії ї ї ї ї ї ї sі sі глина аbо іz vіznim витриол. Под името "алкохол за осоляване" я в средата на 17 век. описващ i. Р. Глаубер , какво като подготвих солна киселинавзаимозаменяемо с H 2 4 . Методът на Глаубер се използва в даден час.
солна киселина- Една от най-силните киселини. Vaughn rozchinyaє (с видения на H 2 и соли - хлориди ) всички хвърлени, scho да стоят в ред на напрежение до деня. Хлоридите се утаяват и за взаимодействие солна киселинас метални оксиди и хидроксиди. Със силни окислители солна киселинасе държи като разрушител, например: O 2 + 4H = Mn 2 + 2 + 2H2O.
Производство солна киселинаВ промишлеността включва два етапа: елиминиране на H и абсорбцията му от водата. Основният метод за получаване на Н-синтез е от 2 и Н2. Големи количества Н се разтварят като страничен продукт в хлорирани органични съединения: RH + 2 = RCI + H de R - органичен радикал.
Технически, какво се освобождава солна киселинасъдържанието е не по-малко от 31% H (синтетичен) и 27,5% H (s Na). Търговската киселина се нарича разредена, например 12,2% Н; със съдържание от 24% и повече H я се нарича концентрирана. В лабораторни упражнения 2н. H (7% - добре, сила 1.035) солна киселина
солна киселина- Най-важният продукт на химическата промишленост. Won ide на otrimannya хлориди на различни метали и синтез на органични продукти, shcho хлор. солна киселинаЗастосовува за ецване на метали, за почистване на малки съдове, обсадни тръби на сондажни отвори на сондажни видове карбонати, оксиди и др. падащ и объркан. В металургията с него се топи руда, в шкирянската промишленост - шкир преди дъбене. солна киселина- важен реактив в лабораторната практика. транспорт солна киселинапри проклетата сулия или гумиране (покрити с топче гуми) метални съдове.
Газоподобният Н е токсичен. Тривала на робота в атмосферата на H извиква катар на дихалните пътища, въртене на зъбите, лигавицата на носа, лигавично-чревно разстройство. Допустимият капацитет H за три работни приложения е не повече от 0,005 mg/l.Захист: противогаз, окуляри, гумени ръкавици, взутя, престилка.
аз К. Малина.
солна киселиначетка срещу сок от черупки (около 0,3%); ецване със спрей и вкарване на болестотворни бактерии.
При медицинска практикаразделени солна киселина zastosovuyt в капки и отвари в комбинация с пепсин в случай на заболявания, които са придружени от недостатъчна киселинност на черупковия сок (например гастрит), както и хипохромна анемия(Напълно със солеви препарати за полипшения и накисване).
Статия за словото солна киселинаГолямата радианска енциклопедия е прочетена 12940 пъти
Урок #
Предмет: Солна киселина
Qile:
Осветление - в процеса на увеличаване на химическата сила на солната киселина и изучаване на киселинната реакция към хлоридния йон.
Razvivayucha - за по-нататъшно развитие в бъдеще за съхраняване на равни химични реакции; четете porіvnyuvati, zagalnyuvati, анализирайте и robiti visnovki.
Виховна - да развива познавателна дейност чрез експеримент.
Собственост: Презентация
Скрит урок
Организационен етап
Добър ден мили момчета!
21 век с право се нарича „Векът на химията“, „Векове на новите технологии“. И един с ориз, който ободрява ежедневно осветените хора и химически компетентно създава за себе си, собственото си здраве, здрава среда. Химически грамотен, можете да станете по-малко жизнени, познавайки необходимия свят и сами по ефективен начинзнания и последващи действия. И тази година, в урока, вие отново ще станете учени - зрелостници, специалисти в научната лаборатория и кожата ви няма да нарасне малко, но самочувствието ще ви позволи да напуснете великата наука химия по-дълбоко .
2. Мотивационни знания
В днешния урок ще говорим за речта, която не само е неизменна в богатите кръгове на занаятите, но също така играе голяма роля в човешкото тяло. Жалко, mayzhe не знам нищо, тъй като значението на virishal може да е нормално вместо реч при slunk. Ако тялото не е в състояние да вибрира необходимото количество сок от черупки, причината е ниската киселинност, наречена хипокиселинност. Намалената киселинност дава неизбежен разрушителен ефект върху ецването и унищожава накисването на жизненоважни речи, необходими за здравето.
Tsya речта е единствената киселина, която вибрира от тялото ни. Всички останали киселини са странични продукти на метаболизма и могат да бъдат отделени от тялото естествено. За киселината на яка. Vіdpovіdі деца (Учителят веднага от началните форми на темата на урока)
3.Цилепология
Чудете се на темата на урока, помислете и веднага формулирайте целта на нашия урок, тъй като храната за нас днес е необходима да научим. Отже,
Вивчитиистория, начини за отнемане на физическата сила на солната киселина
продължихимическа сила на солната киселина
Vídpratsyuvatiнаучаване как да сгъвате rіvnyan khіmіchnih reaktsіy
4. Актуализиране на знанията
Как уважавате хлорната вода и солна киселинаедна реч? Ако е така, тогава защо? (Vіdpovidі uchnіv). Защо имаш две имена? По някаква причина. Правилното мнение е взето от нас, удивлявайки се на завършването на хлорна вода"(видеоклип)
Поглеждайки назад към доказателствата Правилно Солна киселина - розчин хлорна вода.
Кажете ми какво е киселина.
Yakі zagalnі khіmіchnі мощност vіvnostі acid mаut (Vіdpovіdі uchnіv)
5 .Vivchennya нов материал
1. История на солната киселина
T важно е да кажете кой и дали първо е премахнал солната киселина. Уведомете ни, че вече например XV чл. алхимик Васил Валентин от XVI в. Андреас Лиебавий, при усърдните трикове на чудотворния жизнен еликсир, прониза кухненската сила с галони и витриол, които те описаха под името "кисел алкохол". Tse bula вече е известна на нас солна киселина, очевидно вече нечиста.
За първите doslednikіv ze bula zovsі нова реч, scho малко мощност, yakí силно враждебно їhnyu vyavu. Подушвайки йога, вонята се задави и кашля, "киселият алкохол" се замъгли във въздуха. Когато kushtuvanni на вкус, vypіkav език и pídnebіnnya, хвърли вин рози, ruinuvav тъкани.
1658 p. Немският химик И. Р. Глаубер (1604–1670) знае нов начин otrimannya солна киселина, yaku вино, наричащо "сол алкохол" Методът е широко zastosovuєtsya dosí в лаборатории. Vín отопление на кухнята с концентрирана сярна киселина и "dim", както се вижда, напоена с вода.
През 1772 p. английският химик J. Priestley (1733–1804) установява, че газ без барове може да се види от сярната киселина в кухнята, че той може да бъде избран пред живака и че този газ може да бъде изключително голям в присъствието на питейна вода. Дестилация на воден газ, заличаване на името "солна киселина" (acidum muriaticum), А Приестли нарече самия газ „чиста газоподобна солна киселина“.
2. Отстраняване на солна киселина
Видео:притежаване на солна киселина.
Този начин на отнемане на предложенията от 17-ти век от немския химик Йохан Глаубер, а в Русия победи майже до средата на 20-ти век. Инфекцията е в състояние да zastosovuetsya за лабораторно притежание на хлорна вода.
Един от учениците отива до дъската и записва еднаквата реакция.
NaCl(твърд)+H2SO4(конц.)=HCl+NaHSO4
3. Физическа сила на солната киселина
Солната киселина е миризма без варел, която пуши силно на пода, със силна миризма след като види хлоридна вода. Максималната концентрация на HCl е 37%, такъв диапазон от 1, 18 gcm3 киселина се нарича разредена, така че трябва да бъде 12% и по-малко от HCl. При силна киселина, когато работите с киселини, е необходимо да отрежете туберкулозата силно концентрирана солна киселинастипчива реч , когато попадне върху кожата, извиква силни химикали . Киселината във вич е особено опасна. За неутрализиране на opikiv zastosovuyut rozchin слаби ливади, звук .
Когато vodkritti sudin от концентрирана солна киселина пара , привличайки отново вологера, успокоява мъглата диви пътищахората. Солна киселина - bezbarvna, їdka rіdina, scho "дим" на повърхността. Vaughn със силен електролит и при водна дисоциация, той се дисоциира на хлорни йони и вода:
НС1⇄ H(+)+Cl(-).
Да напишем смислено линка.
Познайте видовете обаждания.
Химическата връзка между хлорните атоми и водата в молекулите на HCl е ковалентна полярна връзка.
4. Химическа сила на киселината
Първо, нека преминем към елиминирането на химичните сили на солната киселина, нека повторим правилата на T.B.
Повторение с начален, TB pid час работа с киселини.
Киселините, ако попаднат върху кожата, могат да причинят опиат. Ниво на гравитация химически опикда се отложи в силата и концентрацията на киселина. Когато колбата с киселина беше обелена, имаше следи от шевове, така че колбата с кожа имаше ясно име киселина. Изсипете киселината по такъв начин, че когато колбата се носи, етикетът, така че да потъне във водата, се появява на планините. Киселината трябва да се излива внимателно, за да не се допуска киселината да се консумира върху кожата, речта и езика.
Първа помощ. Изплакнете палубата със силно кована струя студена водапротягане 10 - 15 мин. след измиване върху обгореното място се налага марля или памучен тампон, напоен с 2% азотна сода. След 10 мин. познавайте превръзката, измийте кожата, внимателно вижте водата с филтърна хартия или мека кърпа и намажете с глицерин, за да промените усещането за болка.
Нека познаем силата на киселините (в началото)
Изследването на химическата сила на солната киселина и изследванията трябва да се извършват в групи. Групата кожа има карта с инструкции.
Имате карти с инструкции на вашите маси, трябва да имате това реактивно. Четейки с уважение инструкциите, vikonati последвани, dotrimuyuuchis правилата за безопасност технология.
Химическа сила на киселината
Какви химични сили е майката отговорна за солната киселина според вас? Научете се да формулирате хипотеза.
Добър съвет:
Якщо НС l - киселина, тя е майката на силата на всички киселини.
Доминирането на HCl е подобно на преобладаващото доминиране на киселините. Как да използвате солна киселина и други киселини. (Наличието на H + йон, който влияе върху силата на киселината)
Dosvіd 1. Промяна на farbuvannya на индикатора.
Налейте 2-3 капки солна киселина в 3 епруветки.
Добавете към нивото на солна киселина и 1 капка метилоранж, фенолфталеин и лакмус.
Какви промени виждате?
Висновки:
Досвид 2 . Взаимодействие на солна киселина и метали.
Какви промени виждате?
Съхранявайте еднакви реакции.
Висновок: HCl взаимодействия с метали, които стоят в редица дейности до (Воня на вода от киселини)
Mg+2HCl=MgCl2+H2,
Досвид №3. Взаимодействия с оксиди.
В епруветката поставете малко количество калциев оксид.
Добавете капки солна киселина към готовия разтвор.Съхранявайте еднаква реакция.
Висновок:
Досвид3. Взаимодействие на солна киселина с основи.
4.1. Взаимодействие на солна киселина с бази на дребно.
Какви промени виждате?
Добавете капка солна киселина към готовия разтвор, докато концентрацията намалее. Как се нарича киселинната реакция
Съхранявайте еднакви реакции.
Висновок:Киселините с основите влизат в реакция на неутрализация
HCl+NaOH=NaCl+H2O
Напишете еднаква реакция
Как да използвате солна киселина и други киселини. (Наличието на H + йон, който влияе върху силата на киселината)
Чи има Hcl сила, характерна само за нея и нейните соли.
Такава сила. Tse yakіsna реакция на хлорид-йон.
Взаимодействие със соли
Досвид5. Якисна реакцияза хлориден йон.
В средата на плаката за пунктиран анализ се поставят по 2-3 капки за солна киселина и калиев хлорид.
Добавете 2-3 капки себум нитрат към кожната комисура.
Какви промени виждате?
Съхранявайте молекулярни и къси йонни равни реакции.
Висновок:Взаимодействието със сребрист нитрат е специфичната мощност на солната киселина и солите.
Yakіsnі реакции позволяват да се разкрие, че chi іnshіy іon, химическа речили функционална група
5. Систематизиране на знанията
А - 2,44 и 1,258, хлор
B - 3.44 и 2.258, хлор
G - 4 и 2, хлорен ден
6. Рефлексия
Метод на петте пръста.
М
б
З (Среден) - лагер на духа.
При
б
7.D/Z
Е.І________________________________________________________________________________
Солна киселина ________________________________________________________________________________________________________________________________________________
История
Васил Валентин и Андреас Либавий_________________________________________________________________________________________________________________________________________________________________________________
Йохан Рудолф Глаубер ________________________________________________________________________________________________________________________________________________________________________________________________________________________________
J.Priestl_________________________________________________________________________________________________________________________________________________________________________________________________Притежание на солна киселина
__________________________________________________________________________________________________________________________________
Физическа сила на киселината
_____________________________________________________________________________________________________________________________________________
Химическа сила на киселината
Dia on индикатори
1. Налейте 2-3 капки солна киселина в 3 епруветки.
Добавете 1 капка метилоранж в първата епруветка, 1 капка фенолфталеин в другата епруветка и 1 капка лакмус в третата епруветка. Какви промени виждате?
индикатор
Цветът на киселинността
Метил оранжево
Фенолфталеин
Лакмус
Висновки:
2. Взаимодействие на солна киселина с метали.
В епруветка № 1 поставете цинкова гранула, а в епруветка № 2 - миди стружки.
Изсипете 1-2 ml солна киселина в епруветката за тестване на кожата.
От какви промени се нуждаете?____________________________________________________
Съхранявайте еднакви реакции
______________________________________________________________________________________________________________________________________________________________________________________________________
Висновки:
Взаимодействия с оксиди
В епруветката виси лъжица калциев оксид.
Добавете 1 ml солна киселина в епруветката
Посочете обсадата.
Напишете еднаква реакция
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновки:
4. Взаимодействие на солна киселина с основи.
Взаимодействие на солна киселина с бази на дребно.
Поставете 2-3 капки натриев хидроксид в епруветката.
Добавете до 1 капка фенолфталеин
От какви промени се нуждаете?_______________________________________
Добавете капка солна киселина към готовия разтвор, докато концентрацията намалее. Как се нарича реакцията на киселина и ливада __________________________
Съхранявайте еднакви реакции.
____________________________________________________________________________________________________________________________________________________________________
Висновок:
Взаимодействия на солна киселина с неясни основи
Взаимодействия между солна киселина и соли.
1. Лъжица натриев карбонат визипат в епруветка.
2. Добавете 1 ml солна киселина в епруветката
3. От какви промени се нуждаете?_______________________________________
4. Напишете равни реакции
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновки:
Подобна реакция на хлорид-йон.
Вземете две епруветки. Изсипете 1 ml солна киселина в една. След това добавете 1 ml разтвор на бариев хлорид.
Добавете 2-3 капки себум нитрат в епруветката за тестване на кожата.
Какви промени виждате?
Съхранявайте еднакви реакции.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Висновок:
Якисна реакция ________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Правилна твърдост є
Солна киселина:
Променете цвета на индикатора
Взаимодействие със
Rozchinnymi основи
Неясни основи
Киселинни оксиди
Основни оксиди
Соли на слаби киселини
Соли на силни киселини
Металите шо се изправят
Метали, какво следва
Изследвайте водното съдържание на хлор и отново хлорната вода. Кой газ е важен?
А - 2,44 и 1,258, хлор
B - 3.44 и 2.258, хлор
B - 1.258 и 2.44, хлоридна вода
G - 4 и 2, хлорен ден
Отражение
Метод на петте пръста.
М (малък пръст) - rozumovy процес. Какви знания имам днес?
б (bezimenny) - близост до точката. Какво направих днес и какво постигнах?
З (Среден) - лагер на духа. Yakim buv днес най-важното ми настроение?
При (вказивный) - слуга, помощник. Какво добавих днес, какво зарадвах, какво направих?
б (Велик) - badyorist, физическа форма. Yakim buv моя физически лагер днес? Какво правя за здравето?
Соли на солна киселина или хлорид– добавяне на хлор с обичайните елементи, които могат да имат по-ниска стойност на електроотрицателност.
Метален хлорид- Солидни речи. Основно добрите неща се отличават с водата, ейла AgCl, CuCl, HgCl2, TlCl и PbCl2- Малък мащаб. Хлоридите на локва и земни метали могат да реагират неутрално. Увеличаването на броя на атомите на хлора в молекулите на хлоридите води до промяна в полярността на химичната връзка и термичната стабилност на хлоридите, увеличаване на тяхната летливост и устойчивост на хидролиза. Разликата между хлоридите на други метали може да доведе до киселинна реакция след хидролиза:
Неметалните хлориди са реч, която може да се използва във всяка агрегатна инсталация: газоподобни (HCl), редки (PCl3) и твърди (PCl5). Въведете и реакцията на хидролиза:
Deyakі хлорид и неметали е сложни сполуками, например PC15 се състои от йони [PCl4] + и [PCl6] -. Бромният хлорид и йодът се довеждат до междухалогенни нива. Редица хлориди се характеризират с асоцииране и полимеризация в редки и газообразни фази с разтворени хлоридни места между атомите.
Отриманя.Елиминирайте реакцията на метали с хлор или взаимодействия на солна киселина с метали, техните оксиди и хидроксиди, както и обмен с активни соли:
Те означават йона на хлора като киселинен и калциев за допълнителния нитрат на среброто. Вследствие на това се установява бяла обсада при вида на пластиките.
Хлоридиучастник във виробизма и в органичния синтез. Основата на разтвора на летните хлориди е богатството и богатството на цвета и редки метали. натриев хлорид- за притежание на натриев хидроксид, солна киселина, натриев карбонат, хлор. Vykoristovuetsya също в хранително-вкусовата промишленост и сладост. калиев хлорид- Як поташ добрива. бариев хлорид- Zasíb за борба с komakhs-skidniks. Цинков хлорид- за просмукване на дървото, като zabízhny zasíb víd гнило, при запояване на метал. калциев хлоридбезводният використ се използва за изсушаване на речи (газове) в медицинската практика, а кристалодидратът на його е като охлаждаща реч. Sribl хлоридза спечелване на подготовката на снимки. Живачен хлорид- напукана половина, която се използва като proruyuvach nasinnya, дъбене shkir, farbuvannya тъкан. Умре като катализатор в органичния синтез. Като реч за дезинфекция. амониев хлорид vikoristovuetsya в farbuvalny virobnitstvі, galvanіtsі, запояване и ludzhennі.
Kínets roboti -
Тази тема трябва да бъде разделена:
Cheat sheet с неорганична химия
мамят лист от неорганична химия... Олга Володимировна Макарова...
Ако имате нужда от допълнителен материал по тази тема, в противен случай не сте познавали онези, които се шегуват, препоръчително е да търсите в нашата база чрез robot:
Какво е robitimemo с отнетия материал:
Ако този материал изглежда ви е познат, можете да го запазите на ваша страна в социални мерки:
| Tweet |
Всички теми, от които разделих:
Има значение, че нейният Рух
Материята е обективна реалност, която може да има силата да се движи. Всичко е чисто виж различнисухо вещество. Въпросът е независим от доказателствата
Речта на тази промяна. Предмет неорганична химия
Реч - виж материята, отделни частици от тези, които правят края на света спокоен (сирка, кисен, вапно и др.). Три речи са съставени от физически тела. кожата
Периодична система от елементи D.I. Менделев
Периодичен законтой е обявен през 1869 г. до годината на D.I. Менделевим. Създадена е класификацията на химичните елементи, изразена под формата на периодична система. Направи ме
Стойността на периодичната система на Менделиев.
p align="justify"> Периодичната система от елементи се превърна в първата естествена класификация на химичните елементи, която показа, че миризмите са взаимно свързани един с един, и също така послужи за допълнителни постижения.
Теория на химическия живот
Теорията за химическия живот е разработена от A.M. Бутлеров Може да има такива разпоредби: 1) атоми в молекули
Глобална характеристика на P-, S-, D-елементи
Елементите в периодичната система на Менделиев се подразделят на s-, p-, d-елементи. Tsej podrozdil zdijsnyuetsya на базата на колко равни може да бъде електронната обвивка на елемента атом
Ковалентна връзка. Метод на валентната връзка
Химическа връзка, която се създава от светещи електронни пари, която е обвинена в черупките на свързващи атоми, които могат да вълнуват антипаралелни завъртания, се нарича атомна или ковалентна
Неполярни и полярни ковалентни връзки
За помощта на химическа връзка, атомите на елементите в склада на речите се редуцират един бял. Типът химическа връзка е под формата на субмолекула с електронна сила.
Многоцентрични връзки
При разработването на метода на валентната връзка беше установено, че реалните мощности на молекулата се показват от междинните, както описва формулата. Такова мляко
Ionny call
Връзка между атоми с рязко изразени противоположни мощности (типичен метал и типичен неметал), между които се обвиняват силите на електростатичната гравитация
Водно обаждане
През 80-те години на XIX век. М.А. Илински Н.М. Бекетов е установен, че атомът е вода, задачата на атома е флуор, кисел или азот, изграждане
Преобразуване на енергия по време на химични реакции
Химическа реакция - превръщането на един или повече ваденки на други речи в други химически складчи ежедневна реч. Има връзка с ядрените реакции
Ланси реакции
Isnuyut khіmіchnі reaktії, yak vzaimodiya mízh компоненти иdbuvaєtsya лесно. Вече има голяма група реакции, които протичат гладко. При тези реакции
Силата на неметалите
Излизайки от лагера на неметалите в периодичната система на Менделиев, е възможно да се покаже авторитет за тях. Можете да посочите броя на електрониката на текущия en
Воден
Воден (H) - 1-ви елемент от периодичната система на Менделиев - I и VII група, основна подгрупа, 1 период. На външното s1-задвижване има 1 валентен електрон и 1 s2
воден прекис
Пероксид или пероксидна вода - kisneve zadnannya вода (пероксид). Формула: H2O2 Физическа сила: воден пероксид - сироп без бар
Обща характеристика на подгрупата на халогените
Халогенирани елементи от VII група - флуор, хлор, бром, йод, астат (астатът има малко несъвместимости поради своята радиоактивност). Халогените са ярко изразени. Имате по-малко йод
хлор. Хлорид и солна киселина
Хлор (Cl) - количество в 3-ти период, в VII група на главната подгрупа на периодичната система, пореден номер 17, атомно тегло 35.453; до халогени.
Кратки бележки за флуор, бром и йод
Флуор (F); бром (Br); йод (I) принадлежи към групата на халогените. Застанете в 7-ма група от основната подгрупа на периодичната система. Загална формула: ns2np6.
Загална характеристика на подгрупа Kisnyu
Подгрупата на kisnyu, chi халкогени е 6-та група на периодичната система D.I. Mendell, който включва следните елементи: 1) kissen - Pro; 2) Сирка
Кисен та йога на силата
Кисен (О) е в 1-ви период, VI група, в началната подгрупа. p-елемент. Електронна конфигурация 1s22s22p4. Броят на електроните на старото ниво
Озон и йога на силата
Три модификации са фиксирани в твърдата стомана, в kisnya: ?-, ?- и ?- модификации. Озонът (O3) е една от алотропните модификации на киселината
Сирка и нейният авторитет
Сирка (S) сред природата към правилния поглед. Разширен и полуцветен, като оловен блясък PbS, цинкова бленда ZnS, меден блясък Cu
Околосветско плаване и сулфид
Circumnavigation (H2S) е безцевен газ с остра миризма на гниещ протеин. В природата въвеждането на минерални извори във вулканични газове, гниещи листа, а също и в.
Доминирането на сярната киселина и нейното практическо значение
Структурата на формулата на сярната киселина: Otrimannya: основният метод за извличане на сярна киселина от SO3 е контактният метод.
Химическа сила.
1. Концентрираната сярна киселина е силен окислител. Реакциите оксид-вода са доминирани от нагряване, а основният продукт на реакцията е SO2.
Отриманя.
1. В промишлеността азотът се получава чрез попълване отново с отдалечен випар и добавяне на азот от други газови фракции на бъдещето. Отнеме азота, за да отмъстиш на къщите на благородните газове (аргон).
Основната характеристика на азотната подгрупа
Подгрупата на азота е петата група, основната подгрупа на периодичната система D.I. Менделев. Преди да влезе в елементите: азот (N); фосфор (P); миш'як (
Амоняк (хлорид към азот).
Otrimannya: в индустрията до края на 19-ти век амонякът се отстранява като страничен продукт при коксуването на каменни въглища, които могат да съдържат до 1-2% азот. На кочана
Амониева сол
Амониевите соли са гънки на речта, които включват амониеви катиони NH4+ и киселинни излишъци. Физическа сила: амониева сол - t
Азотен оксид
С кисел N-оксид: N2O, NO, N2O3 NO2, N2O5 и NO3. Азотен оксид I - N2O - двуазотен оксид, "смеещ се газ". Физически сили:
Азотна киселина
Азотна киселина - безбарвна, "дим" на повърхността на околността с остра миризма. Химична формула HNO3. Физическа сила. При температура
Алотропни модификации на фосфора
Phosphorus установява цаца от алотропни видове - модификации. Проявата на алотропни модификации във фосфора е свързана с приемането на различни кристални форми. Били фосфо
Фосфорни оксиди и фосфорна киселина
Елементът фосфор отговаря на редица оксиди, най-важните от които са фосфорен (III) оксид P2O3 и фосфорен (V) оксид P2O5. Фос оксид
фосфорна киселина.
Фосфорният анхидрид съдържа много киселини. Главата им е ортофосфорната киселина H3PO4. Фосфорната киселина е неводна, представена е в привидно видими прозрачни кристали.
Минерал Добрава
Минерал добрива- неорганични речи, главно сол, която включва жизненоважните елементи, необходими за roslin и vicarious за насърчаване на плодовитостта
Vuglets, че йога на властта
Vuglets (C) - типичен неметал; в периодичната система се намира във 2-ри период на IV група, главната подгрупа. Пореден номер 6, Ar = 12011 amu, ядрен заряд +6.
Алотропни модификации на въглен
Въглищата правят 5 алотропни модификации: кубичен диамант, шестоъгълен диамант, графит и две форми на карабин. Шестоъгълният диамант се намира в метеорити (минерал
Оксидирайте ъгъла. карбонова киселина
Въглищата от киселина разтварят оксиди: CO, CO2, C3O2, C5O2, C6O9 и в. Въглероден оксид (II) - CO. Физическа мощност: chadny газ, b
Силикон и йога на силата
Силиций (Si) - koshtuє в 3 периода, IV група от основната подгрупа на периодичната система. Физическа сила: силиций в две модификации: амо
Установете три типа вътрешна структура на първите частици.
1. Суспензии (или необратими колони) - хетерогенни системи, чиято мощност може да се определи от разширената междуфазна повърхност. Por_vnyannі с окачвания имат по-висока дисперсия
Соли на силициева киселина
Общата формула на силициевите киселини е n SiO2?m H2O. В природата се среща главно в присъствието на соли, в свободна форма на вида, например HSiO
Отриманя цимент и керамика
Циментът е най-важният материал в ежедневието. Циментът се притежава от випална сума от глина и вапняк. С варени суми от CaCO3 (калцирана сода)
Физическа сила на металите
Мустаците хвърлят ниско нахални, характерни за властите. Над висшите власти vvazhayutsya: висока електропроводимост и топлопроводимост, пластичност. Параметрите на Rozkid са изпълнени
Химическа сила на металите
Металите могат да имат нисък йонизационен потенциал и споридност към електрон, което в химична реакцияда действа като vodnovniki, да се установи
Метали и сплави в техниката
В периодичната система от 110 елемента 88 са метални. През XX век с помощта на ядрени реакции са били отстранени радиоактивни метали, които не са налични
Основните начини за притежание на метали
Голям брой метали се срещат в природата в полетата. Самородни метали се наричат тези, които се смилат в мелница (злато, платина, r
Корозия на метали
Корозия на метали (corrosio - роза) - физични и химични реакции на метали и сплави довкилам, след което хабят силата си. Базиран на
Защитен метал срещу корозия
Защитата на метали и сплави под формата на корозия в агресивни среди се основава на: 1) повишена устойчивост на корозия на самия материал; 2) намалена агресивност
Основната характеристика на подгрупата на лития
Литиева подгрупа - 1-ва група, основната подгрупа - включва метални басейни: Li - литий, Na - натрий, K - калий, Cs - цезий, Rb - рубидий, Fr - франций. Загална електрон
Натрий и калий
Натрият и калият са локви от метал, които са в 1-ва група на основната подгрупа. Физическа сила: подобна на физически авторитети: лесен сърблис
Добри ливади
Meadows utvoryuyut хидроксид на калаени метали от 1-ва група на основната подгрупа с различни във водата. Физическа сила: открити ливади край водните мили на езерото
Натриева и калиева сол
Натрият и калият се разтварят от соли с усимови киселини. Солите на натрия и калия са сходни по химически органи. характеристика на ориза tsikh соли - добра rozchinnіst vіdі, до
Основната характеристика на подгрупата на берилий
Преди подгрупата на берилий може да се види: берилий и ливадноземни метали: магнезий, стронций, барий, калций и радий. Най-широкото в природата е в гледането на склоновете,
калций
Калцият (Ca) е химичен елемент от 2-ра група на периодичната система, ливадноземен елемент. Естественият калций се състои от шест стабилни изотопа. конф
Калциев оксид и хидроксид
Калциев оксид (CaO) - негасена вар или прегоряла вапно - бяла възпалена реч, обсипана с кристали. Кристализирайте в кубичен лицево-центриран кристал
Zhorstkіst шофиране и начини нейното usunennya
Така че, тъй като калцият е широко разпространен в природата, йога солите се намират в големи количества в близост до естествени води. Водата, която има собствен склад от сол, магнезий и калций, се нарича
Основната характеристика на подгрупата на бор
Оригиналната електронна конфигурация на всички елементи от подгрупата е s2p1. Характеристиката на силата на подгрупа IIIA е общото присъствие на метални сили в гората
Алуминий. Използване на алуминиеви и його сплави
Алуминиево гниене в 3-та група на основната подгрупа, в 3-ти период. Пореден номер 13. Атомна маса ~27. R-елемент. Електронна конфигурация: 1s22s22p63s23p1.
Алуминиев оксид и хидроксид
Алуминиев оксид - Al2O3. Физическа мощност: алуминиев оксид - бял аморфен прах или твърди бели кристали. Молекулно тегло = 101,96, молекулно тегло - 3,97
Основната характеристика на подгрупата на хрома
Елементите подгрупи на хром заемат междинна позиция в редица преходни метали. трудя се високи температуритопене и кипене, свободно място на електронен
Хромен оксид и хидроксид
Хромът разтваря три оксида: CrO, Cr2O3 и CrO3. Хром II оксид (CrO) - основен оксид - черен прах. Силен водач. CrО се различава в производството на соли
Хромати и дихромати
Хромат - соли на хромната киселина H2Cr04, което е по-малко водни сделкис концентрация не по-висока от 75%. Валентност на хрома в хромати - 6. Хроматизъм
Загална характеристика на халовото семейство
Семейството на залата е включено в склада на вторичната подгрупа на осма група и в първата триада, която включва залата, кобалтов никел
Z'ednannya zaliza
Солен оксид (II) FeO - черен кристален говор, неясен в близост до вода и ливади. FeO формира основата на Fe(OH)2.
процес на домейн
Доменен процес - топене на чавун в доменна пещ. Доменната пещ е изградена с цяла горивна камера с височина 30 м и вътрешен диаметър 12 м. Горната половина е w
Чавун и стомана
Splavi zaliza метални системиосновният компонент на тях е зализо. Класификация на сплавите на залата: 1) сплави на залата с въглища (n
тежка вода
Тяжка вода - деутериев оксид D2O с киселинно естествено изотопно съхранение, безплодна родина, без мирис и вкус. Tyazhka вода bula vіdkrita
Химическа и физическа сила.
В тежката вода точката на кипене е 101,44 °C, точката на топене е 3,823 °C. Кристалите D2O създават същата структура, като кристалите на големия лед, яснотата на кристалите
