Силно копие от неметален киселинен оксид. Генетична връзка между основните класове неорганични речи
>> Химия: Генетична връзка между класовете по реч
Генетичен
се нарича връзката между речите на различни класове, основите на техните взаимни трансформации и появата на единството на тяхното сходство, към генезиса на речите.
Обобщение на нашата информация за класификацията на речите може да бъде представено чрез разглеждане на схемата.
Познавайки класа на простите речи, можем да сглобим два генетични реда: генетичният ред от метали.
Генетичната серия от метали влияе върху взаимовръзките на речите от различни класове, чиято основа е един и същ метал.
Отделно две различни генетични серии от метали
1. Генетична серия от метали, като хидроксид в поляна. Един дивак изглеждащ може да има такава поредица от идеи с драстична промяна:

2. Генетична серия от метали, като вид неясна основа. Тази серия е по-богата на генетични връзки, за това е по-добре да се покаже идеята за взаимни трансформации (директни и обратни). Един дивак изглеждащ може да има такава поредица от идеи с драстична промяна:
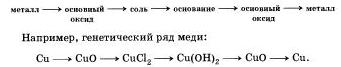
Генетичната серия от неметали влияе върху взаимовръзките на речите от различни класове, чиято основа е положена от този неметал.
Тук също можете да видите две различни неща.
1. Генетичната серия от неметали, като хидроксид на розова киселина, може да се види в такъв lansy:
неметални -> киселинен оксид-> киселина -> силна
Например, генетичната серия за фосфор:
2. Генетичната серия от неметали, като вид нездрава киселина, може да бъде представена с помощта на такава ланцетна трансформация:
неметал - киселинен оксид - силен - киселина - киселинен оксид - неметал
Oskílki z vyvchennyh нас киселини nerazchinnoy е по-малко силициева киселина, като пример за останалата част от генетичната серия, можем да разгледаме генетичната серия от силиций:
1. Генетична връзка.
2. Генетични серии от метали и разновидности.
3. Генетични серии от неметали и разновидности.
Запишете равните реакции, с помощта на които можете да създадете трансформация, която е в основата на индукцията на генетичната серия от метали и неметали. Дайте имена на речи, равни реакции за участието на електролити, напишете същото в йонна форма.
Запишете равните реакции, с помощта на които можете да създадете такива трансформации (умения за стрели, стрели за равни реакции):
а) Li - Li2O - LiOH - LiNO3
б) S - SO2 - H2SO3 - Na2SO3 - SO2 - CaSO3
Равните реакции за участието на електролитите също трябва да бъдат записани в йонна форма.
Като ръководство за по-ниски речи, те ще бъдат интермодифицирани със солна киселина: магнезий, миди оксид (II), миди хидроксид (II), миди, магнезиев нитрат, хидроксидна сол (III), силициев оксид (IV), нитратен оксид, сулфид сол (II)? Запишете броя на възможните реакции в молекулни и йонни форми.
Ако реакцията не може да се разбере, обяснете защо.
Yaki z насочване на долните речи ще бъде интермодален с натриев хидроксид: въглероден оксид (IV). калциев хидроксид, миди (II) оксид, миди (II) нитрат, амониев хлорид, силициева киселина, калиев сулфат? Запишете броя на възможните реакции в молекулни и йонни форми. Ако реакциите не продължат, обяснете защо.
Дайте име на всички класове речи, посочени в таблицата. На яки групи правите речи на кожен клас?
Между класовете неорганични полета има генетична връзка. От прости речи можете да вземете сгъване и navpak. Редът на един клас може да бъде отнет от реда на друг клас.
Опростена генетична връзка между класове неорганични полета може да бъде представена чрез следната схема:
Последователността на такива трансформации за неметали може да бъде представена чрез обидна схема: CaHPO 4
R → R 2 Pro 5 → H 3 RO 4 → Ca 3 (RO 4) 2
(SaOH) 3 RO 4
За типичните метали е възможно да се създаде нова смяна на ремъка:
Ba → BaO → Ba(OH) 2 → BaSO 4
За метали, окислени и хидроксидни амфотерни съединения (метали) е възможно да се промени началото на превръщането:
Al → Al 2 O 3 → Al(OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al(OH) 3 → Al 2 O 3.
Връзки между класове:
1. Хвърляне, не-хвърляне→ сол.
При непрекъснато взаимодействие на метали и неметали се разтварят соли на безкиселинни киселини (халогенид, сулфид):
2Na + C1 2 = 2NaCl
Половините Qi са стабилни и при нагряване по правило не се разширяват.
2. Основни оксиди, киселинни оксиди→сол.
CaO + CO 2 \u003d CaCO 3;
Na 2 O + SO 3 \u003d Na 2 SO 4.
3. Основи, киселини→сол.
Проследете за допълнителна реакция на неутрализация:
2NaOH + H 2 SO 4 \u003d Na 2 SO 4 + 2H 2 O,
ВІН - + Н + Н 2 O;
Mg (OH) 2 + 2HC1 \u003d MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H2O.
4. Метали→Основни оксиди.
Повечето метали взаимодействат с кисели, охлаждащи оксиди:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A12O3.
Златото, среброто, платината и други благородни метали не взаимодействат с киселото, оксидите на такива метали имат индиректен път.
5. Неметали→ киселинни оксиди.
Неметалите (с намек за халогени и благородни газове) взаимодействат с кисели, охлаждащи оксиди:
4P + 5O 2 \u003d 2P 2 O 5;
S + O2 = SO2.
6. Основни оксиди→ основи.
Без междинно взаимодействие с водата могат да бъдат отведени само хидроксиди и ливадно-земни метали (ливади):
Na 2 O + H 2 O \u003d 2NaOH;
CaO + H 2 O \u003d Ca (OH) 2.
Други предлагат използването на индиректен път.
7. Киселинни оксиди→киселини.
Киселинните оксиди взаимодействат с водата, улеснявайки киселинните киселини:
SO 3 + H 2 O \u003d H 2 SO 4;
P 2 O 5 + 3H2O \u003d 2H3PO4.
Vignatok SiO 2, който не реагира с вода.
8. Основи, киселинни оксиди→ сол.
Ливадите взаимодействат с киселинни оксиди, солени соли:
2NaOH + SO 3 \u003d Na 2 SO 4 + H 2 O,
2OH - + SO 3 = SO 4 2- + H 2 O;
Ca (OH) 2 + CO 2 \u003d CaCO 3 ↓ + H 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Киселини, основни оксиди→сол.
Металните оксиди се разтварят в киселини, образувайки соли:
CuO + H 2 SO 4 \u003d CuSO 4 + H 2 O,
CuO + 2Н + = Cu 2+ + Н 2 O;
Na 2 O + 2HC1 \u003d 2NaCl + H 2 O,
Na 2 O + 2H + = 2Na + + H 2 O.
10. Изпратете→Основни оксиди.
Неразделимите основи и LiOH по време на нагряване са изложени:
2LiOH \u003d Li 2 O + H 2 O;
Cu (OH) 2 \u003d CuO + H 2 O.
11. Киселини→киселинни оксиди.
Нестабилните целувки са в състояние да устоят на киселини и да се разпространяват при нагряване (H 2 SiO 3) и да се нагряват без нагряване (H 2 C 3, HClO). В същото време редица киселини са устойчиви на нагряване (H 2 SO 4 H 3 PO 4).
H 2 SiO 3 \u003d H 2 O + SiO 2;
H 2 CO 3 \u003d H 2 O + CO 2.
12. Метален оксид→ метал.
Важни метални оксиди могат да се отлагат върху метал и кислород:
2HgO = 2Hg + O2.
Освен това металите се печелят от най-важните оксиди с помощта на водачи:
3MnO 2 + 4Al = 3Mn + 2Al 2 O 3;
Fe2O3+3H2=2Fe+3H2O.
13. Киселинни оксиди→ нехвърлян.
Повечето неметални оксиди не се разширяват при нагряване. Неметалните оксиди (халогенни оксиди) са разположени върху неметални и кисен.
Deyakí nemetal otrimuyut при vídnovlennі z vіdpovіdnyh oksіv:
SiO 2 + 2Mg \u003d 2MgO + Si.
14. Соли, основи → основи.
Непоследователните основи имат разлика по отношение на разликите в киселинните киселини:
CuSO 4 + 2NaOH \u003d Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu(OH) 2 ↓;
FeCl 2 + 2KOH \u003d Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - \u003d Fe (OH) 2 ↓.
15. Соли, киселини → киселини.
Солите на розмарина взаимодействат с киселини (в зависимост от серията витилиго), в резултат на което се разтваря слаба или летлива киселина:
Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (твърд) + H2SO4 (c) = NaHSO4 + HCl.
16. Соли→ основни оксиди; киселинни оксиди.
Солите на безкисели киселини (нитрати, карбонати) се разлагат при нагряване:
CaCO 3 \u003d CaO + CO 2;
2Cu(NO 3) 2 \u003d 2CuO + 4NO 2 + O 2.
ПРАВО НА САМОСТОЯТЕЛНА РАБОТА ПО ТЕМА "ГЕНЕТИЧНА ВРЪЗКА ПО КЛАСОВЕТЕ ПО НЕОРГАНИЧНИ ИЗСЛЕДВАНИЯ"
1. Наименувайте повторното покритие под речта, разделете ги според класовете неорганични отлагания: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5 HF, MnO 2 .
2. За всяко възстановяване на повърхността на долните части е възможно да се отстрани хидроксидът (киселина или основа) на един етап: мед, физиологичен оксид (P), бариев оксид, азотен оксид (P), азотен оксид (V), силиций оксид, мидисулфат, калиев хлорид, калий, магнезиев карбонат.
3. От предложението запишете формулите на речите, които се свеждат до: 1) оксиди; 2) заместител; 3) киселини; 4) соли:
H2, NaOH, HCl, SO3, CuSO4, NaNO3, KCl, H2SO4, Ca(OH)2, P2O5, HNO3, Al(OH)3.
4. Наименование: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlON) 3 (PO 4) 2, Ba (MnO 4 ) 2, CO, HI. Кажете ми към какъв клас трябва да лежи речта на кожата.
5. Напишете молекулните формули на началните речи и посочете към кой клас принадлежи кожната реч:
1) хидроксокарбонат миди (II);
2) азотен оксид (V);
3) никелов (II) хидроксид;
4) бариев хидрофосфат;
5) перхлорна киселина;
6) хром (III) хидроксид;
7) калиев хлорат;
8) сърководна киселина;
9) натриев цинкат.
6. Дайте примери за реакциите на деня между:
1) проста реч-неметали;
2) проста реч и оксид;
3) оксиди;
4) сгъваема реч, но не и оксиди;
5) метални и неметални;
6) триома от речи.
7. Кое от следните изказвания може да влезе в реакция:
1) въглероден оксид (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) магнезиев оксид: (OH) 2 , HCl, CO 2 , O 2 , HNO 3 ;
3) физиологичен разтвор на хидроксид (II): KCl, HC1, KOH, O2, H2O, HNO3;
4) хлоридна вода: Zn, MgO, ZnCl2, HNO3, Ca(OH)2, Cu, (ZnOH)Cl.
8. Възможно е да се взаимодейства с такива речи:
1) въглероден оксид (IV) и калиев хидроксид;
2) калиев хидросулфат и калциев хидроксид;
3) калциев фосфат и сярна киселина;
4) калциев хидроксид и серен оксид (IV);
5) сярна киселина и калиев хидроксид;
6) калциев бикарбонат и фосфорна киселина;
7) силициев оксид и сярна киселина;
8) цинков оксид и фосфорен (V) оксид.
Напишете равни възможни реакции, кажете ум, за които текат смрад. Ако реакциите могат да доведат до различни речи, тогава ни кажете защо има разлика в умовете на тяхното поведение.
9. Индуцирайте изравняването на реакциите на контрола на обидните речи: натриев ортофосфат (4 метода), калиев сулфат (7 метода), цинков хидроксид.
10. Един от методите за отстраняване на сода (натриев карбонат) се използва за редуциране на въглероден диоксид (IV) оксид върху натриев алуминат. Съхранявайте еднакви реакции.
11. Без да променяте коефициентите, напишете продуктите на реакцията:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Аl(OH) 3 →
4) Р 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Съхранявайте равни реакции за различни видове соли:
1) SO 2 + (OH) 2 → (средна и кисела сол),
2) A1 2 O 3 + H 2 O + HNO 3 → (средна сила, основни соли),
3) Na 2 O + H 2 S → (средна киселинна сол),
4) SO 3 + Ca (OH) 2 → (средни и основни соли),
5) CaO + H 2 O + P 2 O 5 → (основна сила, киселинни соли).
13. Завършете изравняването на реакциите:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca(HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn(OH) 2 + NaOH → (ZnOH)Cl + HCl →
Zn(OH) 2 + HNO 3 → Bi(OH) 3 + H 2 SO 4 (дефицит) →
AlCl 3 + NaOH (дефицит) → (FeOH)Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (твърде много) →
AlC1 3 + NaOH (твърде много) → Ca(AlO 2) 2 + HC1 (твърде много) →
14. Запишете равните реакции, с помощта на които можете да създадете такава трансформация:
1) Cu → CuO → CuSO 4 → Cu(OH) 2 → CuC1 2 → Cu(NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) R → R 2 O 5 → H 3 R 4 → K 3 R 4 → Ca 3 (PO 4) 2 → H 3 RO 4
4) Mg → MgO → MgCl 2 → Mg(OH) 2 → Mg(HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca(OH) 2 → CaCO 3 → Ca(HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr(OH) 3 → NaCrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu(OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al(HSO 4) 3 → Al(OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn(OH) 2 → Na 2 → Zn(NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca(HCO 3) 2 → Ca(NO 3) 2
14) Ca → Ca(OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca(NO 3) 2
15) CuO → CuCl 2 → Cu(NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca(OH) 2 → Ca(NO 3) 2 → Ca(NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg(NO 3) 2 → Mg(OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca(H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca(H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaCl 2 → Ca(NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2 → Zn(OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al(OH) 3 → NaAlO 2 → Al(OH) 3 → K
24) ZnSO 4 → Zn(OH) 2 → ZnCl 2 → Zn → ZnO → Zn(NO 3) 2
25) AlCl 3 → Al(NO 3) 3 → Al(OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe(OH) 3 → FeOH(NO 3) 2 → Fe(NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu(OH) 2 → CuOHNO 3 → Cu(NO 3) 2 → CuSO 4 → CuCl 2 → Cu(NO 3) 2
30) CaCl 2 → Ca → Ca(OH) 2 → CaCl 2 → Ca(NO 3) 2 → CaSO 4
31) Su → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg(OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn(OH) 2 → Na 2 ZnO 2 → Zn(OH) 2
34) Hg(NO 3) 2 → Al(NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al(OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn(OH) 2 → ZnCl 2 → AlCl 3 → Al(OH) 3 → A1 2 O 3
36) CuCl 2 → Cu(OH) 2 → CuSO 4 → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2
37) Fe(NO 3) 3 → FeOH(NO 3) 2 → Fe(OH) 3 → FeCl 3 → Fe(NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al(OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg(OH) 2 → MgSO 4 → MgCl 2 → Mg(NO 3) 2 → Mg(OH) 2 → MgO
40) алуминиев сулфат → алуминиев хлорид → алуминиев нитрат → алуминиев оксид → калиев алуминий → алуминиев хидроксид → алуминиев хидроксохлорид → алуминиев хлорид.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba(HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu(OH) 2 → Cu(HSO 4) 2 → CuSO 4
44) барий → бариев хидроксид → бариев хидроксид → бариев хлорид → бариев карбонат → бариев хлорид → бариев хидроксид
45) P → P 2 O 5 → H 3 PO 4 → Ca(H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr(OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr(OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn(OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaCl 2
51) Z → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Сu → Сu(OH) 2 → Cu(NO 3) 2 → CuO → Сu
54) R 2 O 5 → H 3 R 4 → CaHP 4 → Ca (H 2 R 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu(NO 3) 2
59) KHSO 3 → CaSO 3 → Ca(HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al(OH) 3 → A1 2 O 3 → Al(OH) 3
65) CuO → Su → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe(OH) 2 → Fe → Fe(OH) 3
67) Fe → Fe(OH) 2 → FeCl 2 → Fe(NO 3) 2 → Fe
68) Fe(NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe(NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu(OH) 2 → CuO → Su
70) MgCO 3 → MgO → MgCl 2 → Mg(OH) 2 → Mg(NO 3) 2
71) Mg → Mg(OH) 2 → MgSO 4 → MgCO 3 → Mg(HCO 3) 2
72) CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca(HCO 3) 2 → CaCl 2 → Ca(NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe(OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KC1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu(OH) 2 → CuSO 4 → Cu
77) Fe → Fe(OH) 3 → Fe(NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu(NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al(OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al(OH) 3
81) CaCl 2 → CaCO 3 → Ca(HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca(HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca(NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) Z → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca(H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al(OH) 3 → A1C1 3 → A1(NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu(OH) 2
92) NH 3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca(HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu(OH) 2 → CuSO 4 → Cu(OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe(OH) 3 → Fe(NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1(NO 3) 3 → A1 2 O 3 → Al(OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca(NO 3) 2 → O 2
102) Cu → Cu(OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe(OH) 3 → Fe(NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca(H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn(NO 3) 2
108) ZnO → ZnSO 4 → Zn(NO 3) 2 → ZnO → Zn(OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca(OH) 2 → CaCl 2 → Ca(NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu(NO 3) 2 → NO 2 → HNO 3
117) Ca(NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca(H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al(OH) 3 → A1C1 3 → A1(NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu(NO 3) 2 → CuO → Cu(OH) 2
123) Al → A1 2 O 3 → Al(OH) 3 → A1 2 (SO 4) 3 → A1(NO 3) 3
124) Ca → Ca(OH) 2 → Ca(HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca(HSO 3) 2 → CaCl 2 → Ca(OH) 2 → Ca(HCO 3) 2
128) NH 3 ∙H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu(OH) 2 → Cu
130) Fe(OH) 3 → Fe → FeCl 3 → Fe(NO 3) 3 → Fe
131) Zn → Zn(OH) 2 → Na 2 → Zn(OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn(OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn(NO 3) 2 → ZnO
134) ZnO → Zn(OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn(NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al(OH) 3 → Na 3 → A1C1 3 → Al(OH) 3
137) Al 2 O 3 → KAlO 2 → Al(OH) 3 → Al 2 Pro 3 → Na 3 → Al 2 O 3
138) Al(OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1(NO 3) 3
139) A1C1 3 → K 3 → Al(NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be(OH) 2 → Na 2 BeO 2 → BaBeO 2
ЕКСПЕРИМЕНТАЛНИ ЗАКЛЮЧЕНИЯ ПО ТЕМАТА "ОСНОВНИ КЛАСОВЕ ПО НЕОРГАНИЧНИ ИЗСЛЕДВАНИЯ"
ДОСВИД 1.Реакция на неутрализация.
а) Взаимодействието на силна киселина и силна основа.
Изсипете 5 ml 2 N солна киселина в порцеланова чаша и добавете 2 N натриев хидроксид на капки. Смесете розите със стъклена пръчка и опитайте йога върху лакмус, като прехвърлите капките от розите върху лакмусовата хартия. Необходимо е да се постигне неутрална реакция (синият и червеният лакмус не променят замърсяването). Otrimany rozchin viparuvati сух. Какво се е объркало? Напишете молекулярни и йонни равни реакции.
б) Взаимодействие на слаба киселина и силна основа.
Изсипете 2 ml от 2 n разтвор в епруветка и добавете оптична киселина към неутрален разтвор. Напишете молекулярни и йонни равни реакции. Обяснете защо равнойонната реакция, която поема съдбата на слаб електролит (октоева киселина), е свързана със създаването на водни молекули.
ДОСВИД 2.Амфотерност на хидроксидите.
Три от най-новите лабораторни реактиви утаяват цинков хидроксид. Да спре обсадата и да покаже малко количество йога в 2 епруветки. В една от епруветките добавете солна киселина, в друга - натриев хидроксид (твърде много). За какво да внимавате? Напишете съотношението на най-често срещаните реакции в молекулярната и йонната форма.
ДОСВИД 3.Химично преобладаване на солите.
а) Взаимодействието на разликите в солите с възприемането на важна разновидност на речта.
Изсипете 2 ml разтвор на натриев карбонат в епруветка и добавете разтвор на бариев хлорид до бяла утайка. Напишете уравнението на химична реакция в йонни и молекулни термини. Премахването на обсадата разделено на две части. Изсипете сярна киселина в една от епруветките, натриев хидроксид в другата. Zrobiti visnovok за rozchinnist обсада в киселини и ливади.
б) Взаимодействие между соли и киселини и разтвори на летливо растение.
Изсипете 2 ml натриев карбонат в епруветка и добавете малко количество солна киселина. За какво да внимавате? Напишете уравнението на химична реакция в йонни и молекулни термини.
в) Взаимодействие между разпространението на солите от ливадите и селищата на летящото растение.
В епруветка се налива амониева сол, добавят се 1-2 ml натриев хидроксид и се загрява до кипене. В епруветката, с реакционна сума, добавете vology на червена лакмусова хартия. За какво да внимавате? Дайте обяснение. Напишете еднакви реакции.
Ж ) Взаимодействия между разпределението на соли с по-активни метали, по-нисък метал, който трябва да влезе в склада за сол.
Zalizny (стоманени) цветя трябва да се почистват с тънка шкурка. Нека пропуснем йога сулфат миди. В слаб час внимавайте за гледката на midi върху повърхността на цветята. Запишете сходството на реакцията в йонно и молекулярно отношение.
ДОСВИД 4.Притежаване на основни и киселинни соли.
а) Притежание на оловен хидроксокарбонат.
Добавете малко оловен (II) оксид към оловния (II) ацетат и сварете сума с декилкох хвилин. Охололий Розчин разгневи обсадата и я пропусна през новия удар въглероден двуокис. За какво да внимавате? Обсадата на филтриране и сушене между листата на филтърната хартия. Посочете цвета и характера на отстранената утайка от оловен хидроксокарбонат. Напишете еднакви реакции. Сгънете графичната формула на взетата сол.
б) Мания по магнезиевия бикарбонат.
Към дъгата на силно rozvedenoy rozvedeny roznachka като магнезиева сол добавете trohi rozka натриев карбонат. Как речта попада в обсада? Розчин с обсадата на селището с въглероден диоксид. Posterіgat поетапно razchinennya обсада. Защо те интересува? Напишете еднакви реакции.
ДОСВИД 5.Притежание на комплексни соли.
а) Осъждане със сложен кат.
В епруветка от 2-3 ml добавете количеството миди (II) хлорид капка по капка амоняк, докато утайката от миди (II) хидроксид се утаи, и след това добавете излишък от амоняк, докато утайката изчезне. Разделете приема на Cu 2+ йони от приема на избраното количество. Наличието на такива йони звучи ли объркващо? Напишете равната реакция на сложната част.
б) Отсъждане със сложен анион.
До 1-2 ml разтвор на живачен (II) нитрат, добавете калиев йодид капка по капка, докато утаяването на HgI 2 се утаи. След това добавете твърде много калиев йодид, докато обсадата бъде прекъсната. Напишете уравнението за реакцията на комплексната сол.
ДОСВИД 6.Притежаване на нисши соли (алуминиево-калиеви галони).
Вземете 7,5 g Al 2 (SO 4) 3 18H 2 O и разбъркайте в 50 ml вода, като за целта вземете голяма порцеланова чаша. Razrahuvat за равни реакции и името е необходимо за реакцията с калиев сулфат. Пригответе гореща смес от калиев сулфат и изсипете йога, докато смесвате в порцеланова чаша с алуминиев сулфат. Внимавайте през деня да не паднат кристалите от алуминиево-калиеви галони. След охлаждане и приключване на кристализацията разгневите маточните рози, окачете кристалите на галуните между листовете филтърна хартия и извикайте кристалите. Изчислете броя на изходите.
ЗАДАЧИ ЗА РАЗВИТИЕ
1. В случай на преминаване на твърде много вода, 1,92 g утайка се отстранява след 16 g миди (II) сулфат. За да разберете масовата част на миди сулфат в заместващ сорт и obsyag стъклопис вода.
2. За пълно утаяване на midi в присъствието на сулфид от 291 cm 3, разликата на сулфат на midi (II) с масова фракция от 10% використален газ, като се отделят 17,6 g сулфид на сол (II) с излишък от солна киселина киселина. Разберете дебелината на външния слой от мидисулфат.
3. Газ, наблюдения в случай на взаимно разширение на K 2 S с разредена сярна киселина, преминаване на оловен (II) нитрат през излишно разширение. Otrimaniy обсада maє masu 71,7 г. Разберете обема на сярната киселина, която, след като реагира, е 1,176 g / cm 3, а масовата част е 25%.
4. До границата, за да отмъстят 8 g миди (II) сулфат, те добавиха розвин, за да отмъстят 4,68 g натриев сулфид. Обсадата се филтрува, филтратът се изпарява. Vyznachte маса речи при филтрат след изпаряване и масово утаяване на миди сулфид.
5. Сулфидната сол на Deyaku masu (II) се третира с излишък от солна киселина. Изтеглянето на реакционния газ от 12,5 cm 3 разликата на NaOH с масова част от 25% и дебелина 1,28 g / cm 3, като загаси киселинната сила. Намерете масата на свободната сулфидна сол.
6. Сулфидна сол (II) с маса 176 g беше обработена с твърде много солна киселина и газът беше изгорен твърде много. Какъв обем KOH с масова част от 40% и дебелина 1,4 g / cm 3 е необходим за пълното неутрализиране на плюещия газ?
7. Когато 100 g промишлен пирит се изпаряват, газът се отстранява и се неутрализират 400 cm 3 NaOH с масова част от 25% и дебелина 1,28 g / cm 3. Обозначете масова част от къщите в близост до пирит.
8. До 2 g от сумата на физиологичния разтвор, оксида на слюнката (II) и оксида на слюнката (III) се добавят 16 cm 3 с разлика от НС1 с масова част от 20% и дебелина от 1,09 g/cm 3 . За неутрализиране на излишната киселина са необходими 10,8 cm3 NaOH с масова част от 10% алкали от 1,05 g/cm3. За да знаете масите на речите от сумиши, сякаш са запознати с водата, това, което са видели, са достигнали 224 cm 3 (n.s.).
9. Сумата от Ca (OH) 2 CaCO 3 и BaSO 4 с маса 10,5 g. Когато се вземе проба от сумата от излишната солна киселина, се наблюдават 672 cm 3 (n.o.) газ и 71,2 g киселина с масова част, въведена в реакцията 10%. Оценявайте масите от речи в сумиши.
10. Сумиш бариев хлорид, калциев карбонат и натриев бикарбонат. Когато 10 g от сумата се смесят във вода, неясният излишък е 3,5 g.
11. Є розчин, що да отмъсти за един час огън и азотна киселина. За пълна неутрализация, 10 g от всеки размер се оцветяват 12,5 cm 3 размера на KOH с чести 19% и дебелина 1,18 g / cm 3. При добавяне до 20 g количеството киселина, добавено към излишък от бариев хлорид, е 4,66 g утайка. Намерете масовите дялове на киселините в сумиш.
12. Целият хлорен ден, отнемайки 100 g сумиш KS1 и KNO 3 се редуцира до 71,8 cm 3 вода. При печене на 100 g от сумата от соли остават 93,6 g твърд излишък. Намерете масовата част на хлорната вода в близост до водата.
13. При преминаване на 2 m 3 отново (n.o.) през процепа Ca(OH) 2 се отстраняват 3 g утаена сол на въглеродната киселина. Разберете масовата част на CO 2 в полето.
14. Газът въглероден диоксид се пропуска през суспензията, която съдържа 50 g CaCO 3 . Реакцията е 8,96 dm3 газ (N.O.). Колко CaCO 3 е загубено от твърдата фаза?
15. С добавянето на CaO вода масата се увеличава с 30%. Каква част от CaO (в % на маса) е изплатена?
16. Оксидът на олово (II) с тегло 18,47 g се нагрява при струя вода. След реакцията теглото на отстраненото олово, което не реагира с оксида, добави 18,07 g. С какво тегло не реагира оловният оксид?
17. Chadny газ преминава през оксид (III) по време на нагряване. Масата на твърдия излишък след реакцията до 2 g е по-малка от излишната маса на оксида на солта. Какъв вид CO участва в реакцията (оксидът ще се обнови)?
18. Є 8.96 dm 3 (n.o.) сума N 2 , CO 2 и SO 2 с носеща способност на водата 25. След преминаване през твърде много KOH, сумата се променя 4 пъти. Разберете за доставките на газ от външни суми.
19. Две колби съдържат по 100 g НС1 с честа доза от 2,5%. 10 g СаСОз се добавят към една колба и 8,4 g MgCO3 се добавят към другата. Как събуждате масата от колби след реакцията?
20. Какъв обем (n.o.) киселинен газ е необходим, за да премине през 200 cm 3 разлика с масова част от NaOH 0,1% и 1 g / cm 3, за да се премахне силата на киселината?
21. Какъв е максималният обем (n.o.) газ въглероден диоксид, който може да избледнее 25 cm 3 с масова част от NaOH 25% и 1,1 g / cm 3?
22. С каква минимална разлика в обема с масова част от КОН 20% и дебелина 1,19 g / cm 3 може да се изгаси целият въглероден диоксид, като се отнемат 23,2 g магнетит с черен газ?
23. Каква е минималната маса КОН, която може да реагира с 24,5 g фосфорна киселина, така че продуктът да бъде повече калиев дихидроген фосфат?
24. Каква е минималната маса на Ca (OH) 2, необходима за добавяне на до 16 g калциев бикарбонат с масова част на солта 5% за средно съдържание на сол?
25. Колко калиев хидрогенфосфат трябва да се добави към диапазона, какво трябва да бъде 12,25 g H 3 PO 4, след което разликата трябва да се добави към калиев дихидрофосфат?
26. В подобна суспензия са взети 56,1 g общи калциеви и магнезиеви карбонати. За превръщането им в хидрокарбонати целият въглероден диоксид беше изваден, отделяйки 7 dm 3 (n.o.) етан. Разберете масата на калциевия карбонат в vihdniy sumishi.
27. За да се превърнат 9,5 g от сумата от водород в натриев дихидрофосфат в средна сила, е необходимо да има 10 cm 3 разлика с масова част от NaOH 27,7% и 1,3 g / cm 3. Намерете масата на хидрофосфата в сумиш.
28. Когато въглеродният диоксид беше прекаран през празнината, за да замени 6 g NaOH, бяха отнети 9,5 g обща киселина и средни соли. Научете за оцветения въглероден диоксид.
29. След преминаване на 11,2 dm 3 (n.o.) 2, 57,6 g обща киселина и средни соли бяха взети през междината КОН. Намерете теглото на средната сол.
30. Каква маса фосфорна киселина трябва да се неутрализира, за да се вземат 1,2 g дихидроген 4,26 g натриев хидрогенфосфат?
31. NaOH се добавя до нивото на сярна киселина и се отделят 3,6 g хидросулфат и 2,84 g натриев сулфат. Vyznachte khіmіchní kіlkostі киселина и ливада, scho влезе в реакцията.
32. След преминаване на хлорна вода през 200 cm 3 NaOH разлика с масова част от 10% и дебелина 1,1 g / cm 3, масовата част на NaOH в същата фракция намалява два пъти. Използвайте масовата част на NaCl в разликата, която сте установили.
33. За разпределението на 14,4 g сумиш миди и нейния оксид (II), 48,5 g дребно с масова част от HNO 3 80% беше витрифицирано. Намерете масовите части на midi и оксида във външната сума.
34. Натриев оксид с маса 6,2 g се разтваря в 100 cm 3 вода и се отнема клас № 1. Добавяме солна киселина с масова част от 10% към крайния клас, средата не става неутрална, и оценка No2 е отнета.
1) масови части от речи в разновидности № 1, 2;
2) масата на обозначението HC1, която е изпратена за неутрализиране на обозначение № 1.
35. Разменете 3 g цинк с 18,69 cm3 НС1 с масова част от 14,6% и съдържание 1,07 g / cm3. Отриманият газ по време на нагряване се пропуска върху изпечения CuO с маса 4 g.
36. Газът, който се наблюдава след превръщането на калциев хидрид в излишък от вода, е прекаран през FeO. В резултат на това масата на оксида се промени с 8 g.
37. При печене масата на CaCO 3 Yogo се променя с 35,2%. Твърдите продукти на реакцията създават излишък от солна киселина и отстраняват 0,112 dm 3 (n.o.) газ. Оценете тежестта на външния знак на калциевия карбонат.
38. Миди нитратът е дешифриран и манията по миди оксид (II) е заменена предимно с вода. В същото време продуктите бяха прекарани през епруветка с P 2 O 5, а теглото на епруветката беше 3,6 g. dosvid midi и каква маса сол, какво каза?
39. При използване на азотен оксид (IV) твърде много KOH на студено без кисело, 40,4 g KNO 3 бяха отстранени. Какъв вид реч все още е утвърдена и каква маса?
40. За неутрализиране на 400 g от разликата, за отмъщение на солна киселина и сярна киселина, се оцветяват 287 cm 3 натриев хидроксид с масова част от 10% и 1,115 g / cm 3. Ако до 100 g от общото количество, добавете твърде много от количеството бариев хлорид, vipad 5,825 g от обсадата. Определете масовите дялове на киселините в конкретния диапазон.
41. След преминаването на въглеродния диоксид през натриевия хидроксид бяха отнети 13,7 g от сумата на средните киселинни соли. За превръщането им в натриев хлорид са необходими 75 g солна киселина с масова част от HCl 10%. Намерете обема на глинестия въглероден диоксид.
42. Сумиш солна и сярна киселини гореща масаДиапазон от 600 g със същите масови фракции на киселини се третира с излишък от натриев бикарбонат и се отделят 32,1 dm 3 газ (n.a.). Намерете масовите дялове на киселините в общата сума.
43. За неутрализация на 1 dm 3 съдържанието на NaOH се оцветява 66,66 cm 3 стойността на HNO 3 с масова част 63% и съдържание 1,5 g/cm 3 . Какъв обем сярна киселина с масова част от 24,5% и дебелина 1,2 g / cm 3 е необходим за неутрализиране на същото количество ливада?
44. За някакво обемно съотношение вземете диапазоните на сярна киселина с масова част от 5% и 1,03 g / cm 3 и диапазона на бариев хидроксид с масова фракция от 5% и 1,1 g / cm 3 за обща неутрална izatsii? Vіdpovіd файл като частен vіd rozpodіl rozdіl rozchiny ливада на rozchin киселина.
45. Изчислете минималния обем амоняк със съдържание 0,9 g / cm 3 и масова част от 25%, което е необходимо за пълното третиране на въглеродния диоксид, който е отстранен при полагане на 0,5 kg естествен вап с масова фракция калциев карбонат, което е добро 92%.
46. За пълно превръщане на 2,92 g общ натриев хидроксид и натриев карбонат в хлорид са необходими 1,344 dm 3 хлорна вода (n.o.). Намерете масата на натриевия карбонат в сумиш.
47. До 25 g сулфат миди (II) с масова част от 16%. Обсадата, която се беше утаила, беше филтрирана, след което филтратът предизвика локва от реакция. За пълна неутрализация филтратът се нуждае от 25 cm3 сярна киселина с моларна концентрация 0,1 mol/dm3. Изчислете масата на даденото количество натриев хидроксид.
48. Реховинът, който беше отрязан с общото добавяне на CuO с маса 15,8 g с воден обем 11,2 dm 3 (n.s.), беше ремонтиран чрез нагряване в концентрирана сярна киселина. Какъв вид газ (n.s.) видяхте след реакцията?
49. За пълна неутрализация на 50 cm 3 солна киселина с масова част от HCl 20% и чистота от 1,10 g / cm 3 от калиева стомана от калиев хидроксид с масова част от КОН 20%. Каква е химията на kіlkіst vіd mіstsya в otrimanomu razchinі?
50. Газ, получен при преминаване на излишък от CO 2 над 0,84 g изпечен вогул, указания за реакцията от 14,0 g нагрят миди (II) оксид. Какъв е обемът на азотната киселина с масова част от 63% и съдържание от 1,4 g / cm 3, необходима за пълното отделяне на азотна киселина в останалата реакция на речта?
51. При изпичане до чиста маса на мидинитрат (II), масата на солта се променя с 6,5 g.
52. Когато имаше излишък от солна киселина върху сумата от алуминий с неизвестния едновалентен метал, 6,72 dm 3 (n.o.) се наблюдаваше в газ, масата на сумата се промени два пъти. При изпитване с излишък на разредена азотна киселина се наблюдава 0,373 dm3 (N.O.) NO. Изберете недомичен метал.
53. Теглото на заквасената сметана е 105 g, а химичното количество на киселия елемент в склада е 1 mol. Използвайте масовата част на CaCO 3 на ръба на люлката (kisen е по-малко вероятно да влезе в склада на калциев карбонат).
54. При взаимодействието на серен оксид (VI) с вода се получава разлика от масовата част на сярната киселина 25%. При добавяне към количеството излишък (OH) 2, като се утаи обсада с маса 29,13 g.
55. Когато SO 2 премина през 200 g разлика с масова част от NaOH 16%, се разтваря сума от соли, включително 41,6 g кисела сол. Yaka masa s_rki, scho да отмъсти за 4,5% от къщата с masa, победи за премахването на SO 2? Каква е масата на средната сол?
56. В замяна на 80 g Ca(NO 3) 2 са необходими 50 g Na 2 CO 3. Обсадата, която беше унищожена, беше премахната и по време на обработката на твърде много солна киселина се наблюдаваха 2,24 dm 3 (n.o.) в газ. Какви са масовите дялове на солите в различните региони? Каква е масовата част на натриевия нитрат по отношение на следването на обсадата?
57. Когато цинкът взаимодейства със сярна киселина, 10 dm 3 (n.o.) се разтварят в общ SO 2 и H 2 S с аргонов капацитет 1,51. Yaku khіmіchnu kіlkіst цинк ремонтиран? Каква е масовата част на SO 2 в общите газове?
58. Зразок сумиши цинк и алуминиев тирсий с 11 г маса ремонтиран над ливадата. Vznachte obsyag (n.o.) газ, както се вижда, като масова част от цинка в сумата от 30%.
59. Натриев хидроксид 4,0 g беше слят с алуминиев хидроксид 9,8 g.
60. При обработката на 10 g сумиш миди и алуминий с концентрирана азотна киселина се наблюдава 2,24 dm 3 газ (n.o.) при стайна температура. Какъв вид obsyag (n.s.) газ се вижда при обработка на такава маса sumish твърде много KOH?
61. Сплав от миди и алуминий с тегло 20 g е обработена над поляна, излишъкът, без да се отделя, е ремонтиран в концентрирана азотна киселина. Отриману беше видян със същата сила, изпържен до постна маса и 8 g твърд излишък бяха отстранени. Определете обема на оцветения NaOH с масова част от 40% и дебелина 1,4 g / cm 3).
62. Сумата от алуминиев и метален оксид (II) (оксидът не е амфотерен) с маса 39 g произвежда прекомерно количество КОН, газът, който се вижда, изгаря и отнема 27 g вода. Неотстраненият излишък беше частично ремонтиран 25,2 cm 3 с масова част от НС1 36,5% и дебелина 1,19 g / cm 3). Vyznachte оксид.
63. Сумата от стружки от цинк и миди произвежда твърде много KOH, при което се наблюдава газ с обем 2,24 dm 3 (n.o.). За пълно хлориране на такъв метал е необходим хлор с обем 8,96 dm 3 (n.u.). Razrahuyte масова част от цинк при zrazku.
64. Сумиш тиризий, алуминий и магнезий с маса 49 g бяха обработени с прекалено разредена H 2 SO 4, отделяне при 1,95 mol газ. Втората част от tієї и sumíshi с маса 4,9 g се култивират с прекомерно количество ливада, те вземат 1,68 dm 3 (n.o.) газ. Намерете масите на металите от сумата.
65. Как може да се утаи обсада при изливане, какво трябва да се направи с 10 g NaOH и 13,6 g ZnCl 2?
66. Две еднакви порции по моларна складова сума на Al, Mg, Fe, Zn, тегло на кожата 7,4 g. солна киселинаса взели 3.584 dm 3 газ (н.о.), а в другата - до отделна поляна са взели 2.016 dm 3 газ (н.о.). Очевидно 3 атома Zn се добавят към двете суми с един атом А1. Намерете масите на металите от сумата.
67. Sumish midi, магнезий и алуминий с тегло 1 g бяха обработени с твърде много солна киселина. Разтворът се филтрира и към филтрата се добавя твърде много NaOH. Отримани обсада беше кремиран и изпържен до постна маса, която струваше 0,2 g. Намерете масовата част на алуминия от сумата.
68. При нагряване в спрей от киселина до сплав от цинк, магнезий и миди теглото на сумата нараства с 9,6 g. 3 . За реакцията със същата част от метала са необходими 0,7 mol НС1. Разберете химическото количество метали в сплавта.
69. Сплав от миди с цинк, маса 5 g е предозирана с NaOH. След това твърдият излишък беше кремиран и обработен с концентриран HNO3 отримане със същата сила, както се виждаше, изпържен до постна маса и 2,5 g от твърдия излишък бяха отстранени. Помислете за масата на металите в сплавта.
70. Сплав от миди и алуминий с тегло 12,8 g беше обработена с излишък от солна киселина. Излишъкът, който не беше отделен, се консервира в концентрирана азотна киселина, отстраняването на изплакването се изпарява, сухият излишък се пържи до постна маса и се отстраняват 4 g твърда реч. Обозначете масовата част midi в сплавта.
71. За кой spіvvіdnіnіnі maslіd вземете две порции от A1, schobіnіnіnі vіdnіnі іїї до rozschin ливада, а іnshої - до солна киселина видях равни обеми вода?
72. При обработката на сумата от алуминиев и миди (II) оксид се наблюдава излишък на KOH, който е 6,72 dm 3 (n.o.) газ, а когато същата част от сумата от концентрирана HNO 3 е взета проба при стайна температура, 75,2 g сол се отстранява. Да познаваш масата от външни резюмирани речи.
73. Колко маса от миди (II) оксид може да бъде заменена с вода, можем да премахнем, когато се комбинира с излишък от алуминий, 139,87 cm 3 разликата с масова част от NaOH 40% и дебелина 1,43 g / cm 3?
74. При пълно окисление на 7,83 g метал от два метала се разтварят 14,23 g оксиди, при отглеждането на такава излишна ливада остават неразтворени 4,03 g обсада. Изберете металния склад, който прави сплавта, тъй като техните катиони могат да имат ниво на окисление от +2 и +3, а моларното съотношение на оксидите е 1: 1 (моля, имайте предвид, че металният оксид има ниво на окисление +3, амфотерно ниво на мощност).
75. Две порции алуминий, които може да имат еднаква маса, бяха ремонтирани: едната за калиев хидроксид, другата за солна киселина. Как виждате газовете около вас, какво видяхте (н.с.)?
76. Сплав от миди с алуминиево тегло 1000 g преработи ливадата; Теглото на новия излишък е 0,398 г. Какво е теглото на металите в сплавта?
77. Цинкова и миди сплав с тегло 20 g е свръхдозирана с NaOH с масова част 30% и дебелина 1,33 g/cm 3 . Виждаше се солиден излишък и се претоварваше концентриран HNO3. Силата, която се беше скрила с tsoma, беше видяна и изпържена до постна маса. Масата на твърдия излишък е сгъната 10,016 рубли. Изчислете масовите фракции на металите в сплавите и обемите на оцветяване на ливадата.
78. Сплав от миди и алуминий с тегло 2 g преработи ливадата. Излишъкът се филтрира, измива, нарязва на HNO, 3 разфасовки се сваряват и пържат до постна маса. Наднорменото тегло след изпичане е 0,736 g.
79. За хлорно къпане със солен разтвор, миди и алуминий са необходими 8,96 dm 3 хлор (н.о.), а за такава комбинация с хлорна вода - 5,6 dm 3 (н.о.). При взаимодействието на такава маса на сумата от метали, 1,68 dm 3 (n.o.) газ се вижда на поляната. Намерете химичното количество метали в сумата.
80. Калиев хидрид с маса 5,0 g се диспергира във вода с обем 80 cm 3 и алуминий с маса 0,81 g се добавя към изваждането на прекъсванията.
ПРЕПРАТКИ
1. Баранник, В.П. Съвременна руска номенклатура на неорганичните полета / V.P. Баранник // Вестник на Всесъюзното химическо партньорство на името на. D.I. Менделев. - 1983. - Т. XXVIII. – С. 9–16.
2. Врублевски, А.И. Химия/О.И. Врубловски. - 2-ри изглед., Рев. че дод. - Минск: Krasiko-Print, 2007. - 624 с.
3. Глинка, Н.Л. Ръководителят на кабинета е прав в областта на химията: Навч. ръководство за ВУЗ / За ред. В.А. Рабинович и Х.М. Рубина. - М.: Интеграл-Прес, 2004. - 240 с.
4. Лидин, Р.А. Ръководител на длъжностното лице неорганична химия: навч. ръководство за студенти от висшето училище. навч. ипотека/Р.А. Лидин, В.А. Милк, Л.Л. Андреева; за червено. Р.А. Лидина. - М.: ВЛАДОС, 2004. - 383 с.
5. Лидин, Р.А. Основи на номенклатурата на неорганичната реч / R.A. Лидин [това в]; за червено. Б.Д. Влез. - М.: Химия, 1983. - 112 с.
6. Степин, Б.Д. Zastosuvannya IUPAK правила за номенклатурата на неорганичните сполуки Руски / B.D. Степин, Р.А. Лидин // Вестник на Всесъюзното химическо партньорство на името на. D.I. Менделев. - 1983. - Т. XXVIII. – С. 17–20.
| Влизане …………………………………………………………………… Глобални правиланоменклатура на неорганичните речи………….. Оксиди ……………………………………………………………… Основни оксиди ………………………………… …… …………………... Киселинни оксиди …………………………………………………………. Амфотерни оксиди ………………………………………………….. Съдържание на оксиди ………………………………………………… Правилно за самостоятелна работапо темата „Оксиди“ …………………………………………………………. Киселини……………………………………………………………………. Право на самостоятелна работа по темата „Киселина“ …………………………………………………………………………………………………………… ……… ……….. Право на самостоятелна работа по темата „Изпращане“ ……………………………………………………. Сол ………………………………………………………………………. Право на самостоятелна работа по темата „Сол“ …………………………………………………………………………………………………………… …………………………………………………… …………….. Право на самостоятелна работа по темата „Генетична връзка между класове неорганични видове“ ……………… …………………………………………… ……….. Задача на Росрахунковски ……………………………………………………………………… ……………………………………………………………………………………………………… |
Тема: ГЕНЕТИЧНА ВРЪЗКА НА МИЖ с метали и неметали и с тях. 9 клас
Tsіlі: ilіvіnі: zakrіpiti vypitetya "генетична серия", "генетичен zv'azok"; научете как да събирате генетичните серии от елементи (метали и неметали), да събирате равни реакции, които съответстват на генетичните серии; обърквам, как се придобиват знания за химическа силаоксиди, киселини, соли, основи; разработете: разработете vminnya analizevati, porіvnyuvati, zagalnyuvati и robiti visnovki, сгънете равни химична реакция; vikhovnі: приемете формоването на научния светоглед.
Безопасност на труда: таблици "Периодична система", "Таблица на rozchinnosti", "Поредица от дейности на метали", инструкции за учениците, задача за проверка на знанията.
Ръководител на работата: 1) Орг. момент
2) Повторна проверка на d / s
3) Въвеждане на нов материал
4) Фиксиран
5) D/Z
1) Орг. момент. Витания.
2) Повторна проверка на d / s.
Генетични връзки - всички връзки между различни класове, които се основават на техните взаимни трансформации.
Познавайки класа на неорганичните речи, е възможно да се събере генетична серия от метали и неметали. Тези редове се основават на един и същи елемент.
Сред металите можете да видите два различни реда:
1 . Генетичният ред, в който като основа се явява ливадата. Тази серия може да си представим с помощта на такива трансформации:
метал → основен оксид → ливада → силен
Например K→K 2 O→KOH→KCl
2 . Генетичната серия, която е в основата на неясната основа, същата серия може да бъде показана по бърз начин:
метал → основен оксид → силен → неразложена основа →
→основен оксид→метал
Например Cu→CuO→CuCl 2 →Cu(OH) 2 →CuO→Cu
1 . Генетичната серия от неметали, de yak lanka до редица изпъкнали киселини. Можете да си представите трансформация lanzyzhok по такъв начин:
неметал → киселинен оксид → розова киселина → силен
Например P→P 2 О 5 →З 3 PO 4 → На 3 PO 4
2 . Генетичната серия от неметали, de yak lanka до серия от неустойчиви киселини:
неметал → киселинен оксид → силен → киселина →
→киселинен оксид → неметал
Например,Si→ SiO 2 → Na 2 SiO 3 → з 2 SiO 3 → SiO 2 → Si
Фронтален разговор с храна:
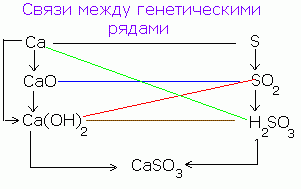
Какво е генетична връзка? Генетични връзки - всички връзки между различни класове, основани на техните взаимни трансформации. Какво е генетична серия?
Генетичен ред - поредица от речи - представители на различни класове, които са от един и същ химичен елемент, pov'yazanih vzaemopertvorennymi, че vіdobrazhayut прераждане на тези речи. Тези редове се основават на един и същи елемент.
Как можете да видите генетични серии? Сред металите можете да видите два различни реда:
а) Генетичният ред, в който ливадата е основа. Тази серия може да си представим с помощта на такива трансформации:
метал → основен оксид → ливада → сил
например генетичната серия на калий K → K 2 O → KOH → KCl
б) Генетичната серия, като основата е неясна основа, тогава серията може да бъде показана по бърз начин:
метал → основен оксид → силен → неразложима основа → основен оксид → метал
например: Cu → CuO → CuCl 2 → Cu(OH) 2 → CuO → Cu
Сред неметалите можете също да видите два различни реда:
а) Генетичната серия от неметали, де yak lanka редица изпъкнали киселини. Ланцетът може да бъде променен в офанзивен вид: неметал → киселинен оксид → розова киселина → силен.
Например: P → P 2 О 5 → З 3 PO 4 → На 3 PO 4
б) Генетичната серия от неметали, de yaklanka към серията от нездрава киселина: неметал → киселинен оксид → сил → киселина → киселинен оксид → неметал
Например: Si→ SiO 2 → На 2 SiO 3 → З 2 SiO 3 → SiO 2 → Си
Vikonanny zavdan за опции:
1. Изберете своя вариант на формулата на оксидите, обяснете избора си, разчитайки на познаването на знака на склада от класа на сполука. Назовете ги.
2. Във формулите по ваш избор намерете формулите на киселините и обяснете избора си въз основа на анализа на запасите от тези проби.
3. Значение на валентността на киселинните отлагания при съхранение на киселини.
4. Изберете формули на соли и ги назовете.
5. Съхранявайте формулите на солите, които могат да бъдат наситени с магнезий и киселини по ваш избор. Запишете ги, назовете ги.
6. В описанието на формулите на вашия вариант намерете формулите на подстанциите и обяснете избора си върху обосновката на анализа на склада на тези spoluks.
7. Във вашия вариант изберете формулите на речите, с които можете да реагирате с разликите в ортофосфорната киселина (солна, сярна). Съхранявайте жизнеспособните реакции.
9. Сред формулите на вашия вариант, увийте формулите на речите, изграждайки взаимно помежду си. Съхранявайте жизнеспособните реакции.
10. Сгънете фенерите на генетичните връзки на неорганичните гънки, в склада на вид реч, чиято формула е въведена във вашия вариант под номер едно.
Опция 1
Вариант 2
CaO
HNO 3
Fe(OH) 3
н 2 О
Zn(NO 3 ) 2
Cr(OH) 3
з 2 ТАКА 3
з 2 С
PbO
LiOH
Ag 3 PO 4
П 2 О 5
NaOH
ZnO
CO 2
BaCl 2
НС1
з 2 CO 3
з 2 ТАКА 4
CuSO 4
От набор от речи за съхраняване на генетична серия, използвайки всички формули. Напишете равни реакции, с помощта на които можете да създадете този ланцетен превод:
Вариант I: ZnSO 4, Zn, ZnO, Zn, Zn(OH) 2 : IIопция:Na 2 ТАКА 4, NaOH, Na, Na 2 О 2 , Na 2 О
4) Фиксиран1.Ал→ Ал 2 О 3 → AlCl 3 → Ал( о) 3 → Ал 2 О 3
2. П→ П 2 О 5 → з 3 PO 4 → Na 3 PO 4 → ок 3 ( PO 4 ) 2
3. Zn→ZnCl 2 →Zn(OH) 2 →ZnO→Zn(NO 3 ) 2
4.Cu→CuO→CuCl 2 →Cu(OH) 2 →CuO→Cu
5.N 2 О 5 →HNO 3 → Fe(NO) 3 ) 2 → Fe(OH) 2 →FeS→FeSO 4
5)Домашна работа: сгънете схемата на поетапния преход от калций към калциев карбонат и подгответе информация за виктория в медицината, било то сол (використка допълнителна литература).

Сред металите могат да се видят два различни реда: 1. Генетичен ред, в който ливадата е основа. Тази серия може да си представим в помощ на предстоящите трансформации: метал - основен оксид - ливада - сила, например генетичната серия на калий K - K 2 O - KOH - KCl.

2. Генетичната серия, като основата е неясна основа, същата серия може да се прояви по ленив начин: метал - основен оксид - якост - неясна основа - основен оксид - метал. Cu-- CuO-- CuCl 2 -- Cu(OH) 2 – CuO --> Cu генетична серия midi "> Cu генетична серия midi"> " title="2. Генетична серия, тъй като основата е изпъкнала неопределена основа, тогава серията може да бъде показана в бърза трансформация: метал - основен оксид - силен - неопределена основа-- основен метален оксид Cu-- CuO-- CuCl 2 -- Cu(OH) 2 – CuO -->"> title="2. Генетичната серия, като основата е неясна основа, същата серия може да се прояви по ленив начин: метал - основен оксид - якост - неясна основа - основен оксид - метал. Cu-- CuO-- CuCl 2 -- Cu(OH) 2 – CuO -->"> !}!}
Средните неметали също могат да се видят в два различни реда: 1. Генетичен ред от неметали, de yak lanka към реда, появява се гниеща киселина. Ланцетната трансформация може да бъде представена в обиден вид: неметал - киселинен оксид - розова киселина - силна. P-- P 2 O 5 -- H 3 PO 4 -- Na 3 PO 4. генетична серия за фосфор

