Физически и химически сили на света. Сирка це
Поставяне на електрони върху орбиталите на външната сфера
В атома има 6 валентни електрона, следователно SULPHUR може да образува до 6 валентни връзки. Атомът на сирка има по-голям радиус и следователно показва по-малка електроотрицателност в сравнение с киселия. Стъпки на окисление, които могат да се видят в окислително-окислителни реакции: S 0 , S -2 , S +4 , S +6 .
■ 68. Напишете равни реакции на сирка с прости речи, за това как да четете реда, Какви са реакциите на оксид-вода? Дай ми жокер.
69. Каква е степента на окисление на сярата в полетата с вода и метали?
70. Какъв тип z'ednannyah имат sirks с метали?
71. Защо цинкът и алуминият не могат да бъдат отнети от обменната реакция в диапазоните?
72. Колко сол (II) сулфид се използва, ако се вземат 30 g сол и 16 g сирка се вземат по-малко от 90%?
Възможност за други реакции, след което някои от тях повишават положителните степени на окисление. Sound tse bovaє за междинното взаимодействие на сирка с киселото - в планината на сирка:
S + O2 = SO2
Oskilki в киселото, стойността на електроотрицателността е по-голяма, по-ниска в sirka, в случая на SO2 sirka, показва ниво на окисление +4 и в тази реакция ние сме като ориентир. Повече кислородна вода до степен на окисление +6 е възможна с одобрен серен анхидрид. В присъствието на катализатор при температура 400-500 °, серният диоксид се окислява с киселина, охлаждайки анхидрида:
2SO2 + O2 = 2SO3
Независимо от високата химическа активност, сърката е широко уловена от търсещия минерал, който се нарича самородна сърка. Tse mayzhe е изключително ромбична сирка. Други алотропни видове сирка не са често срещани в природата.
Сирка звучи впръскана в различни планински скали, от които лесно може да се разтопи. най-често вулканични пътувания. Багати на Samorodnu sírka Кавказ, пустиня Кара-Кум, Керч Пивострив, Узбекистан.
Ивицата се наблюдава и при най-чистите метали g-сулфиди (FeS2, цинкова смес ZnS, оловен близък PbS), в присъствието на сулфати (силата на Глаубер Na2SO4 10H2O, CaSO4 2H2O). Sirka да влезе в склада на deyakyh bіlkіv. За да се извлече sirku от породата, тя се разтопява в автоклави. Diya прегрята водна пара при 150-160 °. Отриман разтопената сирка се рафинира (пречиства) чрез сублимация. Yakscho я разтопете и изсипете върху дървени форми, изглежда по-трудно на изглеждащите пръчки. Такава сирка се нарича дръжка.
мал. 52. Болест
Понякога те се клатят в страхотна форма и след това се втвърдяват на парчета. Такава сирка се нарича бучка. Нарешти, сирка си взимаш от вида на пилен прах - т. нар. сърчан цвят.
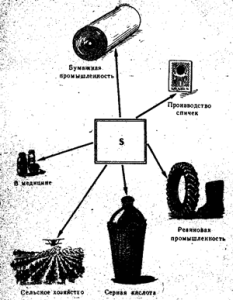
Vilna sirka zastosovuetsya водещ ранг в производството на сярна киселина, както и в хартиената промишленост, за вулканизация на каучук, в производството на barvniks, към селската държаваза рязане и опушване на грозде и бавовник, за бране на сирники (фиг. 52). В медицината сърката печели при гледане на мехлеми едновременно с други речи срещу скоростта и други кожни заболявания. Чистата сирка не е боклук.
■ 73. Отмяна Химическа силаЩе ви кажа защо е подобно и защо разликата е кисела и кисела.
Глава 57
Двувалентната сирка засища с вода (H2S) и метали (Na2S, FeS). Сулфидът може да се разглежда като добър ден, като солите на дневната киселина.
Околосветско плаване. Молекулата на циркулиращата вода е вдъхновена от полярния тип връзка:
Значителният електронен паритет е силно предубеден при втория атом, който е електроотрицателен.
Сирководен газ е важен за повторение, с остра, неприемлива миризма на развалени яйца. Tsey газ вече е взривен. Нашите органи на обонянието са по-чувствителни към sirkovodnyu. За наличието на 1/2000 част от sirkovodnyu в бъдеще може да се наложи да губите аромата си. Хроничните нарушения на кръвообращението в малки дози водят до загуба на тегло, главоболие. Имайте повече време силни трицислед определен час може да настъпи безпокойство и дори по-силна концентрация призовава за смърт поради парализа на дишането. В случай на нарушения на кръвообращението е необходимо да се обвини ролята на свежия вятър и да му се даде малко количество хлор, както и чист хлор. Максимално допустимата концентрация на оборотна вода в работна среда е 0,01 mg/l.
Околосветското плаване се превръща в рядък лагер при температура от -60°. Vіn good се различава във вода, utvoryuyuchi с tsіmu sіrkovodnuyu вода H2Saq или, както я все още наричат, іїї sіrkovіvu киселина.
Околосветският е един от най-хубавите извори. Vin лесно превръща бромната и хлорната вода в бромна вода или солна киселина:
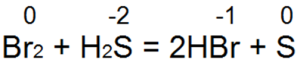
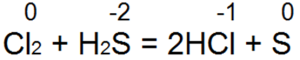
В тази реакция S(-2) се окислява до неутрален S(0).
Обстоятелствата са пламнали. При достатъчен достъп, повторенията (фиг. 53а) се виждат извън огъня за равни:
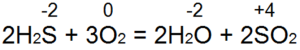
По този начин S(-2) се окислява до S(+4), отделят се 6 електрона и s O(0) до O(-2). Якщо
достъпът понякога е недостатъчен или в противен случай в полунощ, за да внесете студен предмет (фиг. 53.6), е необходимо да изгорите за равни:
2H2S + O2 = 2S + 2H2O
■ 74. Потърсете първа помощ при нарушения на кръвообращението.
75. Защо често се нарича sirkovodny киселина
дневна вода?
76. Когато йодната вода се измести от дневните часове, ще се появи тази мътност. Защо да обяснявам?
77. Какво е възможно S(-2) да покаже оксидна мощност?
В лабораторията денят на кръвообращението се измерва в апарата Kippa с взаимодействието на физиологичен разтвор на сулфид (или натриев сулфид) с разредена сярна киселина:
FeS + H2SO4 = FeSO4 + H2S

мал. 53. Планинска топла вода с многократен достъп отново (а) и с непълен достъп отново (б).
Околосветското плаване, издигайки се от водата, прави слаба циркулираща киселина, която се дисоциира на два етапа:
H2S ⇄ H + + HS - ⇄ 2H + + S 2-
Още една стъпка тече през незначителния свят.
Сярната киселина не може да се съхранява дълго време в лабораторията поради нейната нестабилност. Vaughn стъпка по стъпка kalamutnіє, след като видя vilnoї serka:
H2S=H2+S
При окислително-окислителни реакции сулфоновата киселина се използва като типично ръководство, например:
H2S + K2Cr2O7 + H2SO4 → (S 0; Cr +3)
Завършете изравняването на реакцията на окисление-окисление независимо.
Околосветското плаване е в застой в аналитичната химия.
sirkovodny киселина показва голяма мощкиселини. Истината е, че като цяло силата на киселините е задължителна за него. Например, як, не реагирайте с него, а аз, пиейки диуринова киселина, реагирам не с нея, а с водата, която е там, изпълвайки ливадата, така че тогава можем да влезем в реакция с диуринова киселина. Тъй като е двуосновна киселина, тя може да образува две серии соли - сулфид и хидросулфид, или бисулфид.
Средните соли на сярната киселина са сулфидни - неразтворими във вода, крими соли на натрий и калий и могат да бъдат различни: оловен сулфид и сол - черни, цинкови - бели, кадмиеви - жълти. Хидросулфидите се разделят добре с вода.
Реагент за двувалентен йон S 2 е кадмиев йон Cd 2+, който в присъствието на йона дава zhovty, неразличим от водата на обсадата, например:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd 2+ + S 2- = CdS
Сулфидите лесно се хидролизират до соли на слаби киселини, така че се отличават с директно взаимодействие на сяра с метал.
■ 78. Напишете уравнението на реакцията на диуриновата киселина със сода каустик и обяснете резултата от реакцията с оглед на хидролизата на сол в диапазона.
79. При санитарни и хигиенни условия за показване В света на циркулационната вода оловото вече е сбръчкано от чувствителна реакция от rozchinnimi соли. От какво може да се предпазим при тази реакция в съвременните йонни и къси йонни форми?
§ 58
Z'ednannya chotirivalent ї s_rka - s_rka диоксид (сирчист газ) SO2. Диоксидът на сирка е важен за повторение и може да има остра неприемлива миризма. Молекулата на сирка диоксид също се индуцира от ковалентен тип връзка, полярността й е слабо изразена. При -10° и атмосферно налягане диоксидът се обръща към родината, а при -73° по-трудно. Вон е добър с водата (за 1 обем вода 40 обема серен диоксид), в този ред връзката с водата е равна:
SO2 + H2O H2SO3
Сярната киселина, която излиза, вече е немска, така че реакцията е обратна.
Dvookis sírka може да бъде от голямо значение. Използвайте vipal със sirchan пирит FeS2 или sirki:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 S + O2 = SO2
В лабораторията вземете дозата силни киселини върху солта на сярната киселина, например дозата сярна киселина върху:
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2
Серният диоксид може да бъде отстранен от разпределението на соли на сярна киселина, например калциев сулфит CaSO3, при нагряване;
CaSO3 = CaO + SO2
Диоксид sirki otruyna. Когато се счупи, причинява пресипналост, дупе, а понякога и загуба на информация. Допустимата концентрация на SO2 във въздуха е 0,02 mg/l.
В случай на взаимодействие с органични раковини, серният диоксид може да доведе до синтероване, като причина за това е друга, по-ниска в случай на интоксикация с хлор: не настъпва окисляване, но поради липсата на включване на SO2 в плевнята, като с времето се разпада и безплодието на барвника се възстановява.
■ 80. Предложете столове с аксесоари, с помощта на които можете да извлечете серен диоксид: а) от натриев сулфит ди киселина: б) печене на калциев сулфит.
81. Диоксидът на сирка, взет от 40 g калциев сулфит, беше прекаран през 500 g баритна вода (OH) 2, в резултат на което всичко, което беше в rozní, buv данъци. Колко баритна вода, като 20% серен диоксид, отстранен по време на изпаряване, се използва?
82. До коя група оксиди трябва да се намери серен диоксид? Избройте доминирането, видовете групи оксиди. Потвърдете доказателствата с еднакви реакции.
83. Какво причинява мътност, когато CO2 преминава през вода за парене, както когато CO2 преминава?
84 Как наричате йога от дома си?
85. Какво количество въглероден диоксид може да се вземе от 20 мола FeS2 при 80% добив?
86. След 200 ml 20% разтвор на натриев хидроксид се пропуска серен диоксид до пълното превръщане на натриевия хидроксид в сулфит (хидролизата не трябва да се разрушава). Каква е концентрацията на натриев сулфит, какво поправихте?
При връзката обаче нивото на окисление на сярата в серния диоксид е повече от + 4, така че 4 електрона се дават мислено от същото ниво на атома на сирка, за новото има две възможности: или можете да добавите 2 електроника, които са останали на външната сфера, и така нататък
силата на лидера, или S(+4) може да поеме броя на електроните и ще покаже окислителна сила.
Например наличието на силен окислител S(+4) се държи като ориентир.
Br2 + H2O + SO2 → H2SO4 + HBr
KMnO4 + H2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
Да познава независимо коефициентите на тези реакции.
Наличието на катализатора V2O5 или Pt при температура 400-500 ° е особено важно за окисляването на серен диоксид, след което анхидридът се разтваря:
2SO2 + O2 = 2SO3
Този процес е широко разпространен при производството на сярна киселина и чрез контактния метод.
При наличие на силни ветрове, например топла вода, S (+4) трябва да се третира като окислител: H2SO3 + H2S → H2O + S
Разберете, като добавите електронния баланс, коефициентите за изравняване.
■ 87. Запишете физическата и химичната сила на серния диоксид, като посочите как протича реакцията без промяна на етапите на окисление, така че е оксид-вода.
88. Какъв е физиологичният ефект на сирка диоксид?
Както беше казано, когато серен диоксид се разтвори в питейната вода, сярната киселина се разтваря.
Сярната киселина е киселина със средна сила. Има дисоциация на два етапа:
H2SO3 ⇄ 2 H + + HSO 3 - ⇄ 2H + + SO 2 3 -
Сярната киселина не оцветява, бързо се разпространява в серен диоксид и вода:
H2SO3 ⇄ H2O + SO2
Следователно е невъзможно да се извърши например реакция с по-активни метали, по-ниски със сярна киселина.
Като двуосновна, сярната киселина може да образува две серии соли: средна - сулфит и кисела - хидросулфит. Всички сулфити са неразтворими соли, с малко сулфит от локви метали и амоний. Хидросулфитите имат по-малко. Солите на Qi могат да бъдат сгънати под въздействието на силни киселини:
Na2SOs + H2S04 = Na2SO4 + H2O + SO2
2NaHSO3 + H2SO = Na2SO4 + 2H2O + 2SO2
При разредени киселини върху сулфита се вижда серен диоксид, който може да има неприемлива миризма. Тази реакция е корозивна, за да ексфолира силата на сярната киселина в присъствието на карбонати, тъй като трябва да се направи по подобен начин, но въглеродният диоксид не мирише.
Сулфитите лесно се хидролизират.
§ 59
Както се предполага, при окисляването на серния диоксид анхидридът SO3 се разтваря - получава се шествалентната сяра. При осветяване на молекула на серен анхидрид в осветяването на валентни връзки участва ролята на валентните електрони на сирка, т.к. с- и аз Р-орбитали. Степен на окисление +6 за максимално положителна сирка. Tom S + 6 не може да се третира като пратеник.
Сирчаний анхидрид - бяла кристална реч. Точката на топене е 17°, точката на кипене е 45°. Сирчаният анхидрид е хигроскопичен, така че не е възможно да се спаси йога от страхотно ястие. Його се взема от запечатани стъклени ампули.
Сирчаният анхидрид е киселинен оксид, който може да има всички видове мощност в групата на речите. Zokrema, vin може да реагира с вода, охлаждайки сярна киселина:
SO3 + H2O = H2SO4
■ 89. Напишете независимо равни реакции на серен анхидрид с основи и основни оксиди.
Сирчаният анхидрид е силен окислител. Най-важната употреба на шествалентната сяра е H2SO4. Вон ляга на силни киселини. двойно базирани и дисоциативни двустъпкови често:
H2SO4 ⇄ H + + HSO 4 - ⇄ 2H + + SO 2 4 -

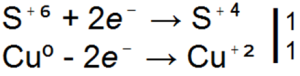
Концентрираната сярна киселина реагира с метали, активни вещества, по-ниска вода, в противен случай по-ниско разредена. например, с концентрирана сярна киселина, тя не вкисва водата, но прави сярна киселина до серен диоксид, свободна сяра или сярна вода:
H2SO4 + Zn → ZnSO4 + SO2
H2SO4 + Zn → ZnSO4 + S
H2SO4 + Zn → ZnSO4 + H2S
■ 91. И трите индукции на реакции на сярна киселина с цинк са окислително-окислителни. Разберете техните коефициенти за подобряване на електронния баланс.
Безводната сярна киселина се нарича монохидрат. Монохидратът не отмъщава на йони и следователно не провежда електрически поток. Монохидратът е добър за вологера. Части от богата реакция на сярна киселина с йонни метали, монохидратът не реагира с други метали, активен, ниска вода, например от наводнение, така че може да се транспортира в студени резервоари. , стабилен на сярна киселина при всякакви концентрации. Концентрирана сярна киселина окислител неметал, например.
■ 93. Защо сярната киселина е подобна на другите киселини?
94. Какви реакции могат да протекат, при които доминираща би била сирхановата киселина?
95. Как да създадете такава трансформация:

Запишете подобните реакции. За съхранение на оксид-вода, електронен баланс, изравняване на йонни реакции, напишете в йонна форма.
96. В един флакон има набор от сярна киселина, в друг - азотна киселина, в третия - солна киселина. Как да ги разделим? 21
Сирка
СЯРА-И; и.
1. химичен елемент (S); лесен за говорене жълт цвят (пребиваване в промишлеността, военното дело, земеделската държава, медицината).
2. Zhovta мазна реч, която се установява по стените на ушния канал. Почистете въздуха във въздуха.
◁ Сирни (разд.).
сяра(лат. Sulphur), химичен елемент VI група на периодичната система. Изживейте кристалите. St_yka в две модификации - ромбична (ширина 2,07 g / cm 3, T pl 112,8 ° C) и моноклинен (твърдост 1,96 g / cm 3, T pl 119°C). Водата не е бистра. На повърхността на стелажа; при изгаряне давам SO 2 с метали, разтварям сулфиди. В природата има самородна сяра, сулфид, сулфат. Сирка се топи от самородни руди; otrimuyut също окислени кисели след sirkovodnya, които могат да бъдат отстранени в естествени, нафта, коксови газове и други методи. Близо 50% от сярата се използва за съдържанието на сярна киселина, 25% - за съдържанието на сулфити (викори се използва в хартиените занаяти), reshta - за борба с болестите на roslin, вулканизация, синтез на barvniks, производство на сирници и др.
СИРАСЯРА (лат. Sulphur), S, химичен елемент с атомен номер 16, атомно тегло 32.066. Химическият символ на sirka S се променя на "eu". Естественият серум се състои от няколко стабилни нуклида. (див.НУКЛИД): 32 S (зададено 95,084% тегловни), 33 S (0,74%), 34 S (4,16%) и 36 S (0,016%). Радиусът на атома на сирка е 0,104 nm. Йонни радиуси: S 2 йон - 0,170 nm (координационен номер 6), S 4+ йон 0,051 nm (координационен номер 6) и S 6+ йон 0,026 nm (координационен номер 4). Енергията на последваща йонизация на неутралния атом около S 0 до S 6+ е равна, очевидно, на 10.36, 23.35, 34.8, 47.3, 72.5 и 88.0 eV. Сирката е скрита в групата VIA на периодичната система D.I. Менделиев, в 3-ти период, и лежат до халкогени. Конфигурация на външната топка 3 с 2
3стр 4
. Най-характерна е степента на окисление в колоните –2, +4, +6 (валентностите варират II, IV и VI). Стойността на електроотрицателността на сирка според Полинг е 2,6. Сирка легни на неметали.
При към правилния поглед sirka е zhovtí krikhkí кристали или zhovty прах.
Историческо доказателство
Сирка се втурва сред природата на свободен (роден) лагер, който е бил извън дома на хората още в стари времена. Сирка насочи вниманието си към характерните zabarvlennyami, черен цвятполусветло и специфична миризма, която се дължи на планината (миризма на серен газ). Важно беше да е сирка, да гори, прогонвайки злите духове. В Библията има дума за победоносни сирки за пречистване на грешниците. При човек на средна възраст миризмата на „сирка“ се свързва с ада. Zastosuvannya sіrks за дезинфекция zgaduetsya Омир. В Древен Рим, за помощта на серен газ, са дадени тъкани.
Дълго време сирка победи в медицината - в полумесеци те пушиха заболявания, включваха до различни мехлеми за лечение на кожни заболявания. В 11 ст. Авицена (Ибн Сина (див. IBN SINA)), а след това европейските алхимици оцениха, че хвърлиха, включително злато и сребро, се образуват от различни доказателства за сяра и живак. Следователно сирка играе важна роля в опитите на алхимиците да опознаят „философския камък“ и да превърнат евтините метали в скъпи. На 16 чл. Парацелз (див.Парацелз)като въведе реда на живака и "глупаво" едно от основните "уши" на природата, "душата" на всички тела.
Практическата стойност на сирката рязко нарасна след изпиването на черния прах (сирката влиза в склада на такава обувка). Византийците от 673 г., завладявайки Константинопол, изгориха флота на врага с помощта на така наречения гръцки огън - сумаш селитри, сирка, катран и други речи - полусветлината на която беше погасена от вода. През Средновековието в Европа черният барут е бил в застой, със склад близо до сумата от орехов огън. От този час голямо разнообразие от проповеди започнаха да се използват за военни цели.
Отдавна е известна и най-важната сирка - сярната киселина. Един от създателите на ятрохимията (див.ятрохимия), Ченец Васил Валентин, 15 век. съобщава се, че е описано третирането на сярна киселина чрез печене на физиологичен разтвор на витриол (старо наименование на сярната киселина е витриол олия).
Установил елементарността на сирка през 1789г. А. Лавоазие (див.Лавоазие Антоан Лоран). В имената на химически сполуки, които отмъщават на сирка, префиксът „тио“ често се пропуска (например реагентът Na 2 S 2 O 3, който се намира във фотографията, може да се нарече натриев тиосулфат). Префиксите на Pokhodzhennya tsієї са свързани с гръцкото име на sirka - theion.
Уелнес сред природата
Сирката е разширена от природата. В земната кора цената се оценява на 0,05% на маса. В природата значителни находища на местна сирка често попадат в капан (звук близо до вулкани); в Европа вонята е розташована на пивдни на Италия, в Сицилия. Големи находища на местна сирка има в САЩ (в щатите Луизиана и Тексас), както и в Централна Азия, Япония, Мексико. В природата сирката е набраздена като рози и при вида на кристални слоеве понякога е удивителна по красота, групи от наивни полупрозрачни кристали (заглавието на приятели).
Във вулканичните райони често е възможно да се види задушаване на земята с горещ воден газ H 2 S; в тези райони сърководаят се втурва в буен поглед в сърчаните води. Вулканичните газове често измиват SO 2 кисел газ.
На повърхността на нашата планета родовете на различни сулфидни полета са по-широки. Най-често сред тях са набраздени: зализен пирит (пирит (див.ПИРИТ)) FeS 2 , меден пирит (халкопирит) CuFeS 2 , оловен близък (див.ГАЛЕНИТ) PbS, цинобър (див.КИНОВАР) HgS, сфалерит (див.сфалерит) ZnS и йога кристална модификация вюрцит (див. WURTZIT), антимонит (див.АНТИМОНИТ) Sb 2 S 3 и други. Съществуват и множество видове различни сулфати, например калциев сулфат (гипс CaSO 4 · 2H 2 O и безводен CaSO 4), магнезиев сулфат MgSO 4 (girka sil), бариев сулфат BaSO 4 (барит), стронциев сулфат SrSO 4 (целестин). ), натриев сулфат Na 2 SO 4 10H 2 O (мирабилит) и в.
Kam'yane vugillya отмъщава средно 1,0-1,5% от сирка. Сирка може да влезе в петролната база. Цената е ниска за видовете природен газ (например Астрахан)
Сирката е доведена до елементите, необходими за живите организми, парчетата са извън същността на складовия протеин. Протеините могат да се използват 0,8-2,4% (тегловни) химически свързана сирка. Roslini otrimuyut sіrk іz sulfaіv, scho mіstya и ґruntі. Неприемливи миризми, което се обвинява за гниенето на труповете на същества, се обяснява с началния ранг на виждане на полусирка (сирководня и меркаптани) (див. TIOLI)), които се утаяват при снасянето на белите. При морска водае близо до 8,7 10 -2% от сирка.
Отриманя
Сирката се отнема по-важното, като се топи от гъските пори, за да отмъсти на родната (елементарна) сирка. Така че заглавието на геотехнологичния метод ви позволява да спечелите сирка, без да извеждате руда на повърхността. Този метод е предложен въз основа на 19 чл. Американският химик Г. Фраш, преди него, се изправи пред задачата да изложи земята на повърхността на земята от родните места на южната част на САЩ, където почвата беше рязко положена по традиционния минен метод.
Frash zaproponuvav vikoristovuvati за pіdёmu sirka на повърхността прегрята водна пара. Прегрейте парата през тръбите, за да служите на подземния бал, за да отмъстите на сирка. Sirka да се стопи (її точката на топене на troch е по-ниска от 120 ° С) и през тръбата, roztashovanіy ієїї, която водна пара се изпомпва под земята, се издига до планината. За да се осигури доставката на рядка сирка, вятърът се изстисква през по-тънка вътрешна тръба.
За различен (термичен) метод, като напълните специална ширина на кочана 20 с.л. в Сицилия миришеха сирка, или я миришеха, от издяланата планинска скала в специални глинени пещи.
Установете други методи за извличане на местна сирка от породата, например екстракция със серни въглища или флотационни методи.
Във връзка с това, тъй като необходимостта от майсторство в sirtsі вече е голяма, razroblení методи я otrimanna іz sirvodnju H 2 S и сулфати.
Методът на окисление на сярна вода до елементарна сирка е първият, който е разбит във Великобритания, а значителното количество сирка е научено за отстраняване на Na 2 CO 3 от сода след метода на френския химик Н. Льоблан, който е загубен след елиминиране. (див.Льоблан Никола)калциев сулфид CaS. Метод на Leblanc за установяване наличието на натриев сулфат в присъствието на CaCO3 във вейпа.
Na 2 SO 4 + 2C \u003d Na 2 S + 2CO 2;
Na 2 S + CaCO 3 \u003d Na 2 CO 3 + CaS.
Ние изпотяваме содата с вода, а водната суспензия на гадния калциев сулфид на дребно се третира с въглероден диоксид:
CaS + CO 2 + H 2 O \u003d CaCO 3 + H 2 S
Обиколката на H 2 S, която е потвърдена, се прекарва от печката върху топката на катализатора в сбор от повторения. В същото време за rahunok на несъвършено окисляване на кръвния поток се установява сирка:
2H 2 S + O 2 \u003d 2H 2 O + 2S
Подобен використичен метод се използва за извличане на елементарна сирка и от сирководня, свързана с природни газове.
Така че, тъй като съвременната технология ще изисква високо ниво на чистота, ефективни методирафиниране на сирка. В същото време, vicorist, zocrema, vіdmіnostі в khіmіchnіy поведение на sirka и domíshok. И така, медът и селенът се отстраняват чрез обработка на смес от азотна и сярна киселина.
Vykoristannya методи, zanovanakh на дестилация и ректификация, vdaetsya otrimat vysokochistu sіrku с vístomí domіshok 10 -5 -10 -6% на маса.
Физическа и химическа сила
Атомите на sirki може да имат уникалната способност да установяват стабилни хомовериги, като копия, които се образуват само от S атоми (енергията на S–S връзката става около 260 kJ / mol). Хомоверигите на сърката имат зигзагообразна форма, която в светлината им приема съдбата на електрони, разположени в съседни атоми на р-орбитали, перпендикулярни една на друга. Qi lanceugs могат да достигнат голяма дожина или, напротив, да установят затворени пръстени S 20, S 8, S 6, S 4.
Поради тази причина се създават десетки десетки както кристални, така и аморфни модификации, които се оформят както от склад от молекули и полимерни копия, така и от метода на тяхното опаковане в твърда стомана.
При нормално налягане и температури до 98,38 ° C, a-модификацията на сирка е стабилна (наричана още ромбична модификация), която охлажда лимоненожълтите кристали. нейната кристална решеткаорторомбична, параметри на елементарния център a = 1.04646, b = 1.28660, c = 2.4486 nm. Дебелина 2,07 kg/dm3. Повече от 95,39 ° C е стабилна b-модификация на сирка (така наречената моноклинна сирка). При стайна температура параметрите на елементарната среда на моноклинната b-S са a = 1.090, b = 1.096, c = 1.102 nm, t = 83.27 °C. Дебелина b-S 1,96 kg/dm3.
В структурите както a-, така и b-модификации на кръга, осемчленната циклична молекула S 8 не е добра. Тези troch молекули са подобни на coroni.
Две ц взаимна ориентация S 8 молекули в кристалния разтвор.
Още една модификация на сирка - така наречената ромбоедрична сирка - може да се разграничи от разликата между натриев тиосулфат Na 2 S 2 O 3 и концентрирана солна киселина при 0 ° C с допълнителна екстракция на сирка с толуен (див.толуен). След изпаряването на търговеца на дребно се обвиняват ромбоедрични кристали, които отмъщават на S 6 молекулите във формата на фотьойла.
Аморфна сяра (твърдост 1,92 g/cm студена вода). Модификациите Qi се образуват от неправилни навиващи се копия S n . С тривиална стъкловидност при температури от 20-95 ° C, модификациите на сирка се превръщат в а-сирка.
Температурата на топене на ромбичната а-окръжност е 112,8 °C, а тази на моноклинната b-окръжност е 119,3 °C. И в тази, и в другата есен се установява светлата жълтеникавост на родната земя, като при температура близо до 160 С тъмно; нейният вискозитет се увеличава и при температура по-висока от 200 ° С, сирката става тъмнокафява и вискозна, като смола. Оценяваме, че пръстенните молекули на S 8 преживяват в стопилката. Фрагменти, които са обвинени, ще бъдат комбинирани един по един с разделителните способности на старите улани S µ от dekilkoh стотици хиляди атоми. По-нататъшното нагряване на разтопената сирка (вино при температура 250 ° C) доведе до частично гниене на копията и родината ставаше все по-суха. На фиг. показано е задържането на температурата на вискозитета на рядка сирка. Близо до 190 °C нейният вискозитет е приблизително 9000 пъти по-висок, по-нисък от 160 °C.
При температура 444,6 °C сърката кипи. В зависимост от температурата в нейните пари могат да бъдат открити молекули S8, S6, S4 и S2. Промяната в склада от молекули изисква промяна в броя на залозите от оранжево-жълти към сламено-жълти цветове. При температури над 1500 °C S2 молекулите се дисоциират на атоми.
Молекулите S 2 са парамагнитни (див.ПАРАМАГНИТЕН)и се подсказва подобно на молекулата O2. Във всички останали страни сирка е диамагнитна (див.ДИАМАГНИТЕН).
Близо до водата сирката е почти неясна. Deyakі нейните модификации се разчиняват в органични родини (толуол, бензоли) и особено добри - във въглероден CS 2 и рядък амоняк NH 3 .
Сирка - завърши активния неметал. Когато се затопли, той ще окисли богато прости речи, но самият той лесно се окислява от кисело и халогени.
S + O 2 \u003d SO 2, S + 3F 2 \u003d SF 6
2S + Cl 2 \u003d S 2 Cl 2 (от къщата SCl 2)
С вода, когато се нагрява, правя ден от H 2 S i в малко количество сулфани (половината от склада H 2 S n):
H2+S H2S.
Приложете реакцията на сирка с метали:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
сулфидите, които се разтварят в тези реакции, се характеризират не с постоянен, а като правило с променлив склад. По този начин складът от калциев сулфид може да се променя без прекъсване на границата между CaS и CaS 5 . Полисулфиден тип CaS n или Na 2 S n при взаимодействие, например от солна киселина, разтваря сулфани H 2 S нОсвен това стойността на n може да стане от 1 до 10.
Сярната киселина се концентрира при нагряване до окисляване на сярата до SO2
S + 2H 2 SO 4 \u003d 2H 2 O + 3SO 2.
Royal Gorilka (смес от азотна и солна киселина) окислява сярата до сярна киселина.
разредена азотна киселина, солна киселинабез окислители и сярна киселина при студено време не взаимодействат помежду си. При нагряване във вряща вода или на открити поляни непропорционално:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Sirka може да се издигне до сулфиди
Na 2 S + (n-1) S \u003d Na 2 S n
и към сулфити:
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
В резултат на преминаването на тази реакция с натриев сулфит Na 2 SO 3, натриевият тиосулфат Na 2 S 2 O 3 се разтваря.
При нагряване въздухът реагира с обичайните елементи, крем, инертни газове, йод, азот, платина и злато.
Vídomo kílka oksív sirki. Крем, устойчив на серен диоксид SO 2 [други имена: серен газ, серен анхидрид, серен оксид (IV)] и серен триоксид SO 3 [други имена: серен газ, серен анхидрид, серен оксид (VI)], отстраняване на нестабилен оксид S 2 O (при преминаване на поток от SO 2 през нажежен разряд) і S 8 O (с взаимодействието на H 2 S с SOCl 2). Пероксидът SO 4 и S 2 O 7 се разтварят чрез преминаване на SO 2 заедно с киселия през летлив разряд или чрез окисляване на SO 2 от озон.
Киселият серен диоксид SO 2 е нестабилна киселина със средна сила H 2 SO 3 (сярна киселина):
H 2 Pro + SO 2 H 2 SO 3
и киселинният серен триоксид SO 3 е силна двуосновна сярна киселина (див.СИРХАНОВА КИСЕЛИНА) H2SO4:
SO 3 + H 2 O \u003d H 2 SO 4
І сярна киселина H 2 SO 3 и сярна киселина H 2 SO 4 са дадени в два реда соли: кисели [хидросулфит NaHSO 3, Ca (HSO 3) 2 и в. i хидросулфат КНSO 4 , NaНSO 4 и други] и среден [сулфит Na 2 SO 3 K 2 SO 3 и сулфат CaSO 4 Fe 2 (SO 4) 3].
Sirka да влезе в склада на богатите органични реколти (div. statti Thiofen (див.ТИОФЕН), Тиоли (див. TIOLI)и други).
Zastosuvannya
Почти половината от сирката, която се произвежда, използва се при производството на сярна киселина, близо 25% се пресява за отстраняване на сулфити, 10-15% - за борба с есетрите на силни кълнови култури (главният ранг на гроздето и бавовник) (по-важното тук е разликата между меден витриол CuSO 4 5H 2 O), близо 10% се използват от гумената промишленост за вулканизация на дъвка. Cirku zastosovuyt когато virobnitstvі barvnikіv і pígmentіv, vybuhovyh rechovina (спечелени dosі отидете в склада на барут), парче влакна, луминофори (див.луминофори). Serka vikoristovuyut по време на бране на sirnikiv, за да отидете в склада, от който се правят главите на sirnikiv. Sirku dosí místya deyakі мехлеми, с които се радват на болестта на shkіri. За да придадат на стоманите специална сила, те въвеждат малки добавки от сирка (като желаят, като правило, къщата на сирка е небажана).
Биологична роля
Сирката присъства постоянно във всички живи организми, като е важен биогенен елемент (див.БИОГЕННИ ЕЛЕМЕНТИ). Тя вместо рослини да стане 0,3-1,2%, за същества 0,5-2% ( морски организмиотмъсти си още сирка, Чим земен). Биологичното значение на сирка се определя от нас пред него, че тя трябва да бъде включена в склада на аминокиселините метионин (див.МЕТИОНИН)че цистеинът (див.цистеин)аз, по-късно, в склада за пептиди (див.ПЕПТИДИ)че bіlkіv. Дисулфидните връзки –S–S– в полипептидните копия участват в образуването на пространствената структура на протеините, а сулфхидрилните групи (–SH) играят важна роля в активните центрове на ензимите. В допълнение, сирката влиза в молекулите на хормоните, важни речи. Много сирка се намира в кератинова коса, четки, нервна тъкан. Неорганичните кълнове на сирка са необходими за минералния живот на Рослин. Вонята служат като субстрати за окислителни реакции, които zdíysnyuyutsya от най-широките серни бактерии в природата. (див.СЕРОБАКТЕРИИ).
В тялото на средностатистически човек (телесно тегло 70 kg) има около 1402 g сирка. Допълнителните нужди на възрастните хора в сърцето са близо до 4.
Въпреки това, зад негативното си въздействие върху по средатаче хората sirka (по-точно, нейната z'єdnannya) стоят на едно от първите места. Основното dzherelo zabrudnennya syroj - плюене на каменни вугили и други видове огън, които отмъщават за сирка. При това близо 96% от сирка, която е разпръсната в огъня, се консумира в атмосферата под формата на SO 2 кисел газ.
В атмосферата на сяра газът прогресивно се окислява до серен оксид (VI). Obidva оксид - i оксид на сяра (IV), i оксид на сяра (VI) - vzaєmod_yut іz водна пара z utvorennyam acid razin. Potim tsі rozchini падат като киселинни гори. Опирайки се на почвата, киселите води презират развитието на почвената фауна и розлините. В резултат на това се създават недружелюбни умове в растежа на растежа, особено в пивничните региони, където химическото объркване се добавя към суровия климат. В резултат на това лисиците загиват, тревната покривка се нарушава, водата се намокря. Киселинните плочи се разрушават от мрамор и други материали, паметници, освен това вонята причинява разрушаване, за да се изградят каменни пъпки и камъни от метали. За това е необходимо да свикнете с различни входове, за да избегнете навлизането в атмосферата. За целта е необходимо пречистване на нафтата и нефтопродуктите от суровините, пречистване на газовете, които се утаяват при изгарянето на огъня.
Сама по себе си, сърката при зрението видя лигавиците, органите на дихателната система също могат да викликат сериозно заболяване. GDK sirki повторете 0,07 mg / m 3.
Жени. един от простите (несвързани, несвързани) говори, топящи се и силно бледи викопни на вулканичните хора; като стока, звучи я: сирка палева. Барутен бой от селитра и сирка, от вугили. Сирката на Живцев, поднесена с клечки. | Сирка, Сирка... Тлумачен речникДалия
СИРА- СЯРА, сяра, хим. елемент VI гр. Менделова система, символ S, сериен номер 16, at. V. 32.07. Преглед на най-новите часове. В природата изглежда като вода (нептунични) и вулканични отлагания. поход. Zustrichaetsya също в ... Голяма медицинска енциклопедия
СИРА- Chem. елемент, символ S (лат. Sulphur), at. н. 16, при. м. 32.06. Існує при viglyadі kílkoh алотропни модификации; сред тях серия от моноклинни модификации (ширина 1960 kg/m3, tтопи = 119°С) и ромбична сирка (ширина 2070 kg/m3, ίπι = 112,8… Голяма политехническа енциклопедия
- (обозначен с S), химичен елемент от VI група на ПЕРИОДИЧНАТА СИСТЕМА, неметал, старомоден. Zustrichaetsya в природата като наблюдател елемент, така че при търсене на сулфидни минерали, като ГАЛЕНИТ и ПИРИТ, и сулфатни минерали, ... Научно-технически енциклопедичен речник
В митологията на ирландските келти Сирка е бащата на Парталон (раздел 6). Zgídno с deyakim dzherelami, самата Сирка, а не Парталон беше човек на Дилгнейд. (
