Диоксидът на сирка се съхранява в лабораторията. Сирки диоксид (сирк диоксид, серен анхидрид)
Емпирична формула. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .SO2
Молекулно тегло, kg/kmol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64.06
Агрегатна мелница. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . газоподобен
Zovnishhnіy поглед. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . безцевна газ
Миризма. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .характерна, остра миризма
Използване: производство на сярна киселина. Завдяки голяма топлина на изпарение, както и лека кондензация на рядък SO2 стагнират в хладилната технология. Като силен водач за водни сделки, SO2 прави много органични дворове, които се използват, когато добавите слама, лоза, шев, царевица борошнтова цукру. Редкият SO2 също стагнира в целулозната промишленост, в някои органични разновидности, като запазване на речта (например при прибиране на реколтата, която транспортира плодове и плодове).
ФИЗИЧЕСКА И ХИМИЧЕСКА МОЩНОСТ
Широчина при 20 ° С статистика 101,3 kPa, kg/m3. . . . . . . . . . . . . . . . . . . . 2,926
Температура на кипене на менгеме 101.3 kPa, °С. . . . . . . . . . . . минус 10.01
Точката на топене зад менгемето е 101,3 kPa, °C. . . . . . . . . . .минус 85,5
Температурата е критична, °C. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 157.2
Критично налягане, MPa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7,87
Топлина на светлината, kcal/mol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . минус 70,96
Топлинна мощност на газ, cal/(m). . . . . . . . . . . . . . . . . . . . . . . . . . . 0,145
Топлопроводимост при 0°С, cal/(cm?sgrad). . . . . . . . . . . . . . . . . . . . . . . . . 0,0195
:* t - твърда реч;
Разчиннист във водата за 25 °C. . . . . . . . . . . . . . . . . . . . . . .добра търговия на дребно
Реакция zdatnіst: rozchinny етилов алкохол, сярна киселина. С водни разновидности ливадите реагират с разтворени соли на сярна киселина - сулфити и бисулфити. Абсолютно сухият серен диоксид при нормални температури не реагира с кисела, вода, халогени и сярна вода. При високи температури на катализатора водата се използва до обяд, въглеродният оксид - до обяд. Vologii dioksid serki vzaєmodіє іz sіrkovodnym при zvichaynіy temperaturі z utvorennymi sirki. Различни окислители се окисляват до серен триоксид и сярна киселина. При газообразен амоняк присъствието на водна пара реагира с разтворен амониев сулфит, а в присъствието на вода - амидосулфонова киселина. С диоксид сярата реагира във водни разтвори на органични амини, които разтварят сулфитите под формата на органични основи и в безводни видове, нагънати естери на амидосулфонова киселина.
САНИТАРНО-ХИГИЕННА ХАРАКТЕРИСТИКА
Регистрационен номер за CAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7446-09-5
Клас Небезпеки в предната част на работната зона. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3
MPCm.r. във всички работни зони, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
Кодът на речта, който е объркващ атмосферен. . . . . . . . . . . . . . . . . 0330
Клас на безопасност в атмосферен ефект. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3
MPCm.r./d.s. в атмосферата, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . 0,5/0,05
Пръскане върху хората: викане диви пътища, бронхоспазъм, миризмата се влошава, вкусът намалява, клепачите могат да бъдат опиянени.
Елате първи, за да помогнете на пострадалите при вливането на речта: винете на чист въздух, извикайте дрехите, които изстисквате. Инхалациите вкисват. Топло в помещенията. При затруднено дишане чрез нис - ефедрин. Nadali - vіdharkuvalni; пие се топло мляко със сода, зехтин и мед.
Моля, заповядайте: не е разрешено да виждате серния диоксид в работната зона; извършване на посещения на wikis за почистване на вентилация за почистване на диоксида във въздуха.
Zabobi zakhistu: protigaz думи, какви филтри, с филтър. Zakhist очи, които shkiri.
ВЪЗМОЖНА НЕСИГУРНА ЗАХРАНВАНЕ
Група на горимост: . . . . . . . . . . . . . . . .незапалим, незапалим реч
Още по темите СЕРИЯ ДИОКСИД (СИРИ ДИОКСИД, СЯРЕН АНХИДРИД):
- СУЛВОДОРОД (ДИСУЛВОДОРОД, СЯРА ВОДОРОД, ДИХИДРОСУЛФИД)
- Mish'yak ta yogo spoluki (миш'яковист анхидрид, миш'яковиста киселина и нейните соли, миш'яковиста вода, осарсол)
4.док
Сирка. Околосветски, сулфиден, хидросулфиден. Оксид сирки (IV) и (VI). Сярна киселина и сярна киселина и техните соли. Етери на сярна киселина. Натриев тиосулфат
4.1. Сирка

Сирка е един от бедните химически елементи, като хиляда души вече. Вон е широко разпространен в природата и расте като свободен лагер (местна сирка), както и във ферми. Минералите, които отмъщават на сирката, могат да бъдат разделени на две групи - сулфиди (пирити, блажени, бленди) и сулфати. Родната сирка от голям брой хора расте в Италия (остров Сицилия) и САЩ. В SND местният произход на sirka е в района на Волга, правомощията на Централна Азия, Крим и други региони.
Оловен блясък PbS, меден блясък Cu 2 S, сребърен блясък - Ag 2 S, цинкова бленда - ZnS, кадмиева бленда - CdS, пирит или лят кил - FeS 2, халкопирит - CuFeS 2 - HgS.
Гипс CaSO 4 2H 2 O, мирабил (сила на Глаубер) - Na 2 SO 4 10H 2 O, ки-зерит - MgSO 4 H 2 O могат да се добавят към минерали от друга група.
Sirka се намира в организмите на същества и рослин, парчетата влизат в склада на протеиновите молекули. Органичните кълнове на сирка се отмиват от нафтата.
Отриманя
1. Когато otrimani sirki от естествен spoluk, например, от sirchan пирит, yogo се нагрява до високи температури. Серните пирити се разпределят с разтворите на сулфида на зала (II) и сирките:
2. Възможно е да се елиминира окисляването на циркулационния ден с кратко вкисване на реакцията:
2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Понастоящем използването на въглероден диоксид за серен диоксид SO 2, страничен продукт от топенето на метали от серни руди, е по-широко:
SO 2 + C \u003d CO 2 + S
4. Ветрове на газови и металургични и коксови пещи за отмъщение на сумата от серен диоксид и сърководня. Пропуснете Qiu sumish at висока температуранад катализатора:
H 2 S + SO 2 \u003d 2H 2 O + 3S
Сирка е твърд кракел с лимоненожълт цвят. Във вода, той е практически неразтворен, но е добре да се разграничи в sirkovogletsyu CS 2 анилин и някои други овес.
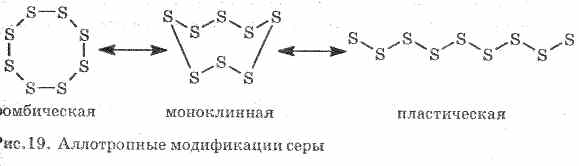
Лошо е да се провежда топлина и електричество. Sirka utvoruê цаца на алотропни модификации:
1 . ^ Ромбична Сирка (Naystіykіsha), кристалите изглеждат като октаедри.
Когато въздухът се нагрява, цветът и вискозитетът й се променят: на кочана става светложълт, а след това температурата се повишава в света, става по-тъмен и настилката е вискозна, която не изтича от епруветката, с леко натоварване Ivanní in'вискозитетът отново пада и при 444 , 6 °C кипи за известно време.
2. ^ Моноклинна Сирка - модификация на вид на тъмно-жълти голчасти кристали, излизат при пълно охлаждане на топеното сирене.
3. Пластмасова съркаутаява се, сякаш се нагрява до кипене студена вода. Лесно се разтяга като гуми (раздел. Фиг. 19).
Естествената сирка се образува от сбора на няколко стабилни изотопа: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
Атомът на света, осветявайки непълнотите на текущото енергийно ниво, може да прикачи два електрона и да покаже стъпките
Окисление -2. Тази степен на окисление на сярата се наблюдава в присъствието на метали и вода (Na 2 S, H 2 S). В случай на прехвърляне или прехвърляне на електрони към атом на електроотрицателен елемент, стъпките на окисление на цикъла могат да бъдат +2, +4, +6.
В студа времето е доста инертно, но с повишаването на температурата реакционната сграда се движи. 1. При металите сирка показва оксиди на силата. По време на тези реакции сулфидите се разтварят (от злато, платина и иридий не реагират): Fe + S \u003d FeS
2. С вода, при нормални условия, цикълът не взаимодейства, но при 150-200 ° C възниква обратната реакция:
3. При реакции с метали и вода той се държи като типичен окислител, а в случай на силни окислители проявява доминираща сила.
S + 3F 2 \u003d SF 6 (не реагира с йод)
4. Огнище сирка в кисело при 280°С, ейл в повторение при 360°С. При каква сума се установява сумата от SO 2 и SO 3:
S + O 2 \u003d SO 2 2S + 3O 2 \u003d 2SO 3
5. Когато се нагрява без достъп, въздухът веднага се смесва с фосфор, въглерод, показвайки оксидна сила:
2P + 3S \u003d P 2 S 3 2S + C \u003d CS 2
6. Когато взаимодействате със сгъваеми речи, важно е да се държите като лидер:
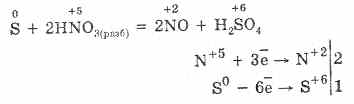
7. Сирка здатна преди реакции на диспропорционалност. И така, при варене на прах от сирка с ливади се утаяват сулфити и сулфиди:
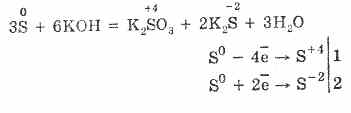
Zastosuvannya
Сирка е широко зает с индустрията и силната държава. Близо половината видобутка е оцветена за наличие на сярна киселина. Vykorivuyut sirka за вулканизация на каучук: с който каучукът се превръща в хума.
При вид на сърчан цвят (фин прах) трябва да се засади сърка за борба с болестите по лозето и бавовника. Тя живее за премахване на барут, сирники, складове, които блестят. Медицината приготвя сърчани мехлеми за лечение на кожни заболявания.
4.2. Околосветски, сулфиден, хидросулфиден
Околосветското плаване е аналог на водата. Його електронна формула
Покажете какво има в света зв'азкив H-S-Hвземете съдбата на два p-електрона от един и същ равен атом от ок. Молекулата H2S има форма на качулка, така че е полярна.
^ Уелнес сред природата
Околосветските набъбва в природата в близост до вулканични газове и в близост до водите на някои минерални отвори, например Пятигорск, Мацести. Vín utvoryuêtsya при гниене sirkovmіsnyh органични речи на различни същества и росни заливи. Cym се обяснява с характеристиката неприятна миризмаканализационни води, гъбни ями и гробища.
Отриманя
1. Околосветското плаване може да бъде отменено без посредник сирка с вода по време на нагряване:
2. Ale zvuchay yogo otrimuyut diyu розмарин солна или сярна киселина върху сулфидна сол (III):
2HCl+FeS=FeCl 2 +H 2 S 2H + +FeS=Fe 2+ +H 2 S Тази реакция често се провежда в апарат на Kippa.
^ Физическа сила
В типичните умове кръвообращението е газ без барел със силна характерна миризма на развалени яйца. Дори по-силно, при вдишване се свързва с хемоглобина, причинявайки парализа, която не е
Да доведе до смъртоносен резултат. При ниски концентрации, по-малко опасно. Працувайте с него се изисква в плетени гардероби или с аксесоари, които са херметически затворени. Допустимото количество H 2 S в пробите от приложението е 0,01 mg на 1 литър повторение.
Околосветското плаване е умерено балансирано от вода (при 20°C 2,5 обема циркулационна вода се разпределят в 1 обем вода).
Rozchin s_rvodnyu близо до водата се нарича sirkovodny вода или sirkovodny киселина (тя показва силата на слаба киселина).
^ Химическа сила
1, При силно затопляне на деня, денят може да бъде пренастроен за приемане на деня и водата.
2. Газоподобна лятна вода за изгаряне на повърхността на черните полусветлини с разтворен серен оксид (IV) и вода:
2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 Pro
В случай на киселинност, киселата вода се утаява: 2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Сирководен - за довършване на силен водач. Цялата тази важна химическа сила може да се обясни по следния начин. При различни нива на H 2 S е лесно да се видят електрони към молекули на киселинност:
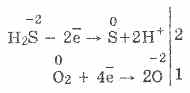
В същото време въздухът отново ще окисли лятната вода до времето, сякаш за да убие водата на деня с бедствие:
2H 2 S + O 2 \u003d 2S + 2H 2 O
Това се обяснява с тези, които не се натрупват в големи количества в природата с гниене на органични речи - кисело след окисляването му във въздуха.
4, Circumnavigation реагира енергично с халогени, например:
H 2 S + I 2 \u003d 2HI + S
5. Различна окислителна енергия реагира с циркулационната вода: с разредена азотна киселина се установява свободна сирка.

6. Причината за sirkovodnyu може да бъде кисела реакция чрез дисоциация:
H 2 SH + +HS - HS - H + +S -2
Звук над първия киселец. Вин е вече слаба киселина: слаба за ugіlnu, като звука на H 2 S s сулфиди.
Сулфид и хидросулфид
Сярната киселина, като двуосновна киселина, отговаря на два реда соли:
Среден - сулфиден (Na 2 S);
Киселина - хидросулфид (NaHS).
Qi солите могат да бъдат отнети: - в комбинация с хидроксиди от циркулираща вода: 2NaOH + H 2 S \u003d Na 2 S + 2H 2 Pro
Немеждинно взаимодействие на сирка с метали:
Обменна реакция на соли с H 2 S или между соли:
Pb(NO 3) 2 + Na 2 S \u003d PbS + 2NaNO 3
CuSO 4 +H 2 S=CuS+H 2 SO 4 Cu 2+ +H 2 S=CuS+2H +
Всички хидросулфиди могат да бъдат сортирани от водата.
Сулфиди ливадноземни металилесно се отделят и от водата, безбарвни.
Сулфидите на важни метали са практически неразличими или неясни във вода (FeS, MnS, ZnS); deakí от тях не се различават в разредени киселини (CuS, PbS, HgS).
Като сол на слаба киселина, сулфидът е силно хидролизиран във водни разновидности. Например металните сулфиди на локвата, когато се отделят от водата, могат да причинят реакция на локва:
Na 2 S+HOHNaHS+NaOH
Сулфидите на мустаците, като самия ден, са източници на енергия:
3PbS -2 + 8HN +5 O 3 (розб.) \u003d 3PbS +6 O 4 + 4H 2 O + 8N + 2 O
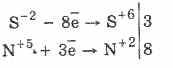
Деяки сулфиди могат да бъдат по-характерни: CuS і PbS - черен, CdS - жълт, ZnS - бял, MnS - розов, SnS - кафяв, Al 2 S 3 - оранжев. Върху различното разнообразие от сулфиди и различното богатство от тях, основите на прецизен анализ на катиони.
^ 4.3. Серен оксид (IV) и сярна киселина
Оксидът на сирка (IV), или сирхистият газ, за най-великите умове е газ без бар с остра, задушлива миризма. Когато се охлади до -10 ° C, той прераства в безплодна родина.
Отриманя
1. В лабораторните умове серният оксид (IV) се получава от соли на сярна киселина и се третира със силни киселини:
Na 2 SO 3 + H 2 SO 4 \u003d Na 2 SO 4 + S0 2 + H 2 O 2NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + 2SO 2 + 2H 2 O 2HSO - 3 + 2H + \u003d 2SO 2 +2H 2 O
2. Също така, серен газ се разтваря чрез взаимодействието на концентрирана сярна киселина при нагряване с ниско активни метали:
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 Pro
Cu + 4Н + + 2SO 2- 4 \u003d Cu 2+ + SO 2- 4 + SO 2 + 2H 2 O
3. Оксидът на сирката (IV) също се разтваря, когато сирката се натроши във въздуха:
4. В индустриалните умове SO 2 се отделя по време на изпаряването на пирит FeS 2 или серни руди от цветни метали (цинкова смес ZnS, оловен бликс PbS и др.):
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
Структурна формула на молекулата SO 2:
При осветяването на връзките с молекулата SO 2 вземете участието на два електрона и два атома кислород. Взаимно, взаимовръзката на свързването на електронните двойки и несподелената електронна двойка на цирка дава молекулярната форма на върха.
Химическа сила
1. Серният оксид (IV) показва цялата сила на киселинните оксиди:
Взаимодействие с вода
Взаимодействие с ливади,
Взаимодействия с основни оксиди.
2. За серен оксид (IV) е характерен в vídnovluvalní господство:
S +4 O 2 +O 0 2 2S +6 O -2 3 (в присъствието на катализатор, при нагряване)
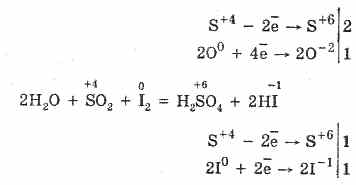
Елът в присъствието на силни източници на SO 2 се държи като окислител:
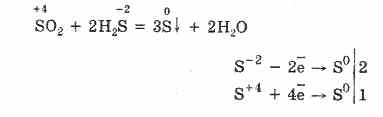
Оксидната двойственост на серния оксид (IV) се обяснява с факта, че сярата може да бъде в ново състояние на окисление +4 и че може, като даде 2 електрона, да се окисли до S +6 и като вземе 4 електрона, тя може да се окисли до S °. Като показа tsikh chi іnshih доминиращ за отлагане в природата на реагиращия компонент.
Серният оксид (IV) е добър във вода (в 1 обем при 20°С се диспергират 40 обема SO 2 ). С това е възможно само да се разтвори сярна киселина във вода:
SO 2 + H 2 OH 2 SO 3
Реакцията е обратна. Във воден разтвор серен оксид (IV) и сярна киселина присъстват в химическата фаза, така че те могат да бъдат потиснати. При свързване на H 2 SO 3 (неутрализиране на киселина
Ti) реакцията протича с разтвор на сярна киселина; когато SO 2 се отстрани (продухване с азот или нагряване), реакцията протича в края на речта. В случая на сярна киселина присъства серен оксид (IV), който й придава остра миризма.
Сярната киселина има цялата сила на киселините. В различни етапи на дисоциация често:
H 2 SO 3 H + + HSO - 3 HSO - 3 H + + SO 2- 3
Термично нестабилен, летящ. Сярната киселина, тъй като е двуосновна, прави два вида соли:
Среден - сулфит (Na 2 SO 3);
Киселини - хидросулфити (NaHSO 3).
Сулфитите се образуват с нова неутрализация на киселина и ливада:
H 2 SO 3 + 2NaOH \u003d Na 2 SO 3 + 2H 2 Pro
Хидросулфити се появяват в случай на нестъблена ливада:
H 2 SO 3 + NaOH \u003d NaHSO 3 + H 2 Pro
Сярната киселина и нейните соли могат да бъдат както окислителни, така и мощни, което зависи от естеството на реакционния партньор.
1. Така че, когато киселината е кисела, сулфитите се окисляват до сулфати:
2Na 2 S +4 O 3 + O 0 2 \u003d 2Na 2 S +6 O -2 4
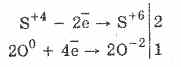
По-лесно е да окислите сярна киселина с бром и калиев перманганат:
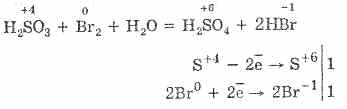
5H 2 S +4 O 3 +2KMn +7 O 4 \u003d 2H 2 S +6 O 4 +2Mn +2 S +6 O 4 + K 2 S +6 O 4 + 3H 2 O
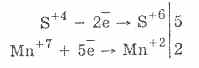
2. В присъствието на повече енергийни източници на сулфит, оксидите на мощността показват:
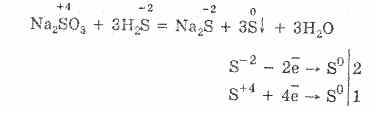
От солите на сярната киселина се различават всички хидросулфити и сулфити на метални локви.
3. Oskilki H 2 SO 3 е слаба киселина, с ди киселини на сулфит и хидросулфит, се вижда SO 2. Този метод се нарича vicorist при отстраняване на SO 2 в лабораторни умове:
NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + SO 2 + H 2 O
4. Разновидността на водния сулфит лесно се хидролизира, в резултат на което концентрацията на ОН - йони се увеличава в търговията на дребно:
Na 2 SO 3 + NOHNaHSO 3 + NaOH
Zastosuvannya
Серен оксид (IV) и сярна киселина znebarvlyuyut богато barvnikiv, utvoryuyuchi с тях без barvnі spoluki. Останалото може да бъде преоткрито при нагряване или на светлина, в резултат на което се преражда. Otzhe, d_ya, scho победи, SO 2 и H 2 SO 3 v_drіznyaєtsya v_d bіlit dі хлор. Звукът на rxid на sirki (IV) бие вълна, шовк и слама.
Серковият оксид (IV) инхибира много микроорганизми. Ето защо, за потискане на плесенясали гъбички, те опушват сирота, изби, бъчви за вино и др. Използва се и при транспортиране на събраните плодове и ягид. В големи количества серен оксид IV) се задържа за притежание на сярна киселина.
Важно е да знаете произхода на калциевия хидросулфит CaHSO 3 (сулфитна поляна), който се използва за отглеждане на дърво и хартиена маса.
^ 4.4. Sirka(VI) оксид. Сирханова киселина
Серен оксид (VI) (раздел. таблица. 20) е безпреградна материя, която е по-твърда при температура 16,8 ° C в твърда кристална маса. Вин вече се кълне във вологера, създавайки сярна киселина: SO 3 + H 2 O \u003d H 2 SO 4
Таблица 20
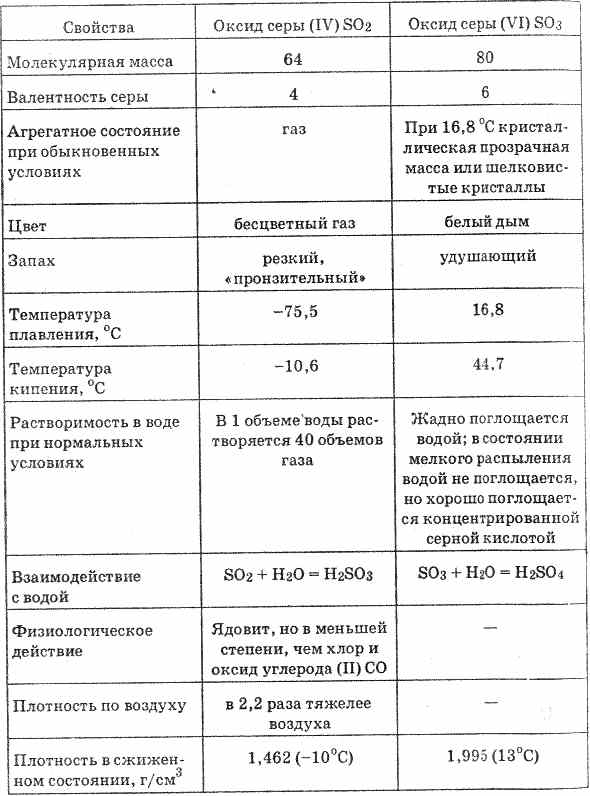
Окисляването на сярата (VI) във вода се придружава от значително количество топлина.
Серният оксид (VI) е по-разпространен в концентрирана сярна киселина. Разликата между SO 3 в безводна киселина се нарича олеум. Oleumi може да съдържа до 70% SO3.
Отриманя
1. Серният оксид (VI) се противопоставя на окисляването на газ без сяра чрез вкисване отново в присъствието на катализатори при температура от 450°C (разд. Съдържание на сярна киселина):
2SO 2 +O 2 \u003d 2SO 3
2. Най-добрият начин за окисляване на SO 2 до SO 3 е използването му като окислител до азотен оксид (IV):
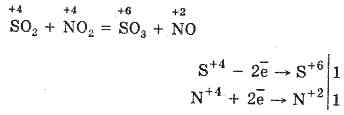
Азотният оксид (II) се разтваря при взаимодействие с кисел въздух, лесно и бързо се превръща в азотен оксид (IV): 2NO + O 2 \u003d 2NO 2
Които могат да бъдат рециклирани при окисляването на SO2. Също така NO 2 играе ролята на кисел носител. Този начин на окисляване на SO 2 до SO 3 се нарича неуместен. Молекулата SO 3 има формата на трико, близо до центъра
За да разберете атома на сирка:
Такава сграда е свързана с взаимни връзки на зв'язувални електронни двойки. Върху тях атомът на змията е натиснал шест звнішних ехтронів.
Химическа сила
1. SO 3 - типичен киселинен оксид.
2. Серният оксид (VI) може да има силата на силен окислител.
Zastosuvannya
Серен оксид (VI) виколютен за производството на сярна киселина. Най-важният метод за контакт
Сярна киселина. За този метод можете да вземете H2SO4, независимо от концентрацията, както и олеум. Процесът се състои от три етапа: екстракция на SO 2; окисляване на SO2 до SO3; съдържание на H 2 SO 4 .
SO 2 се отстранява с випален пирит FeS 2 в специални пещи: 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
За по-бързо випалу трябва да се добави пирит отпред, а за по-висока сила е необходимо да се вкара значително повече въздух (киселост), по-ниско според реакцията. Газът, който излиза от пещта на випалу, се състои от серен оксид (IV), кисел, азот, половин mish'yaku (от къща близо до пирит) и вода. Vin се нарича випалувиален газ.
Випалувален газ се дава на релето за почистване, за да предизвика малко количество прах в устата, а също и трион и вологер отварят катализатора. Víd spoluk mish'yaku и víd пие газът се изчиства, преминавайки през специални електрически филтри и promivnu; вологата се глинизира с концентрирана сярна киселина в сушилнята. Пречиствателният газ, който трябва да отмъсти на киселината, се нагрява в топлообменника до 450°C и трябва да се постави близо до контактното устройство. Средата на контактното устройство е частта от полицията, пълна с катализатор.
Преди това, в качеството на катализатор, победоносният метал платина беше победител. През годините ванадият е заменен с полуванадий - ванадиев (V) оксид V 2 O 5 или ванадил сулфат VOSO 4, който е по-евтин от платината и е по-ефективен.
Реакцията на окисление на SO 2 в SO 3 е обратна:
2SO 2 + O 2 2SO 3
Повишена киселинност във випалювалния газ, насърчаване на отделянето на серен оксид (VI): при температура от 450 ° C звукът достига 95% и повече.
След утаяване на серния оксид (VI), той се подава допълнително по метода на потока в глинената камера, девините се глинират с концентрирана сярна киселина. В света първо се установява безводната сярна киселина, а след това олеумът. Oleum Nadali се разрежда до 98% сярна киселина и се доставя на възрастни хора.
Структурна формула на сярна киселина:
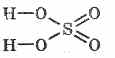
^ Физическа сила
Сярната киселина е маслена среда без масло, която кристализира при +10,4°C, може да бъде отстранена ( \u003d 1,83 g / cm 3) по-важно за водата, без мирис, нелетлив. Много гигантски-роскопски. Според вологера, като се има предвид голямото количество топлина, водата не може да се излива в концентрирана сярна киселина - киселината ще се пръска. за времена-
Развъждането изисква сярна киселина да се излива на малки порции във водата.
Безводната сярна киселина съдържа до 70% серен оксид (VI). При нагряване той разтваря SO 3 до успокояване, докато се утаи с масова част от H 2 SO 4 98,3%. Безводният H2SO4 може да не провежда електрическа струя.
^ Химическа сила
1. С вода се съберете във всякакъв вид spіvvіdnannyah и utvoryuê dírati razny склад:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4H 2 O, H 2 SO 4 6,5 H 2 O
2. Концентрираната сярна киселина образува органична реч - цукор, папир, дърво, влакна, като взема водни елементи от тях:
Z 12 H 22 Pro 11 + H 2 SO 4 \u003d 12C + H 2 SO 4 11 H 2 O
Вугилия, която се е установила, често влиза във взаимодействие с киселина:
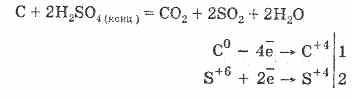
Сушенето на газовете е изградено върху глинеста вода със сярна киселина.
Колко силна е нелетливата киселина H 2 SO 4 вискозни други киселини от сухи соли:
NaNO 3 + H 2 SO 4 \u003d NaHSO 4 + HNO 3
Въпреки това, ако добавите H 2 SO 4 към разделянето на соли, тогава киселинността на киселините няма да бъде премахната.
H 2 SO 4 - силна двуосновна киселина: H 2 SO 4 H + + HSO - 4 HSO - 4 H + + SO 2- 4
Може да притежава цялата сила на нелетливите силни киселини.
Розовата сярна киселина се характеризира с цялата сила на неокислителните киселини. И за себе си: във взаимодействие с металите, да стои в електрохимичната серия на напрежението на металите до деня:
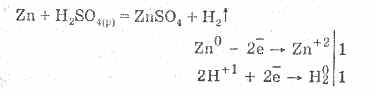
Взаимодействията с металите се разглеждат за сметка на обновяването на йони във водата.
6. Концентрираната сярна киселина е енергичен окислител. При нагряване се окисляват повече метали, освен че стоят в електрохимичната серия, налягането е равно на вода, Не реагира дори с платина и злато. Угар в дейността на метала като продукт на обновяване може да бъде S -2 , S ° і S +4 .
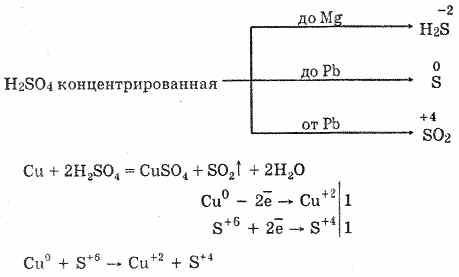
На студено концентрираната сярна киселина не взаимодейства с такива силни метали като алуминий, злато, хром. Това се обяснява с пасивирането на металите. Qiu osoblivіst широко vikoristovuyut при нея transportirovannі в zaliznіy тара.
При нагряване обаче:
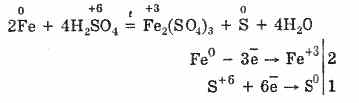
По този начин сярната киселина се концентрира във взаимодействие с метали за обмен на атоми на киселинообразуващия агент.
Киселинна реакция към сулфатния йон SO 2-4 е разтворът на бяла кристална утайка от BaSO 4, която е неразтворима във вода и киселини:
SO 2- 4 + Ba +2 BaSO 4
Zastosuvannya
Сярната киселина е най-важният продукт на осн химическа индустриякойто се занимава с производство на не-
Органични киселини, ливади, соли, минерални добавки и хлор.
За променливостта на използване сярната киселина е на първо място сред киселините. Най-важното е да получите фосфорни и азотни добавки. Тъй като е нелетлива, сярната киселина замества отстраняването на други киселини - солна, флуороводородна, фосфорна и окт.
Bagato я ide за пречистване на петролни продукти - бензин, керосин, масло - в shkіdlivih domіshok. При машинно бластиране със сярна киселина повърхността на метала се почиства с оксиди преди нанасяне на покритие (никелиране, хромиране и др.). Syrchanu киселина zastosovuyut при vibronitstvі vibukhovih rechovina, парче влакна, barvnikіv, пластмаси и богатства иnshih. Їя vicorist за пълнене на батерии.
Солите на сярната киселина са важни.
^ Натриев сулфат Na 2 SO 4 кристализира от водни разлики в това, което изглежда като Na 2 SO 4 10H 2 Pro хидрат, който се нарича праг на Глаубер. Zastosovuêtsya в медицината като пиърсинг. Безводният натриев сулфат се използва при производството на калцинирана сода.
^ Амониев сулфат(NH 4) 2 SO 4 - азотът не е вид.
Калиев сулфат K 2 SO 4 - вид поташ.
Калциев сулфат CaSO 4 е податлив в природата, изглежда като минерал-lu гипс CaSO 4 2H 2 O. При нагряване до 150 ° C, той консумира част от водата и преминава от хидрата към склада 2CaSO 4 H 2 O, заглавията са изгорен гипс или алабастър. Алабастърът, когато се смеси с вода в хистоподобна маса, след определен час се втвърдява отново, превръщайки се в CaSO 4 2H 2 O. Гипсът е широко фиксиран в ежедневието (гипс).
^ Магнезиев сулфат MgSO 4 m_statsya в морска вода, умопомрачителен я горещ вкус. Krystologidrat, от заглавията на перваза на girkoy, zastosovuyut като проспериращ.
витриол- техническо наименование на кристални сулфати на метали Fe, Cu, Zn, Ni, Co Midniy vitriol CuSO 4 5H 2 Pro - натъртване реч от син цвят. С rozvedenim ще покрием рослините и ще ги почистим за деня преди сеитбата. Zalizny vitriol FeSO 4 7H 2 Pro - светлозелена реч. Zastosovuyt за борба срещу zí shkіdniki roslin, подготовка на мастило, минерална farb toshcho. Цинков витриол ZnSO 4 7H 2 O победа се използва в производството на минерални фарби, в chintz, медицина.
^ 4.5. Етери на сярна киселина. Натриев тиосулфат
Към естерите на сярната киселина се добавят диалкилсулфати (RO 2)SO 2 . Tse висококипящи rídini; долни rozchinnі близо до водата; при наличие на ливади се използват алкохол и соли на сярна киселина. Долен диалкил сулфат - алкилиращи агенти.
Диетилсулфат(C2H5)2SO4. Точка на топене -26 ° C, точка на кипене 210 ° C, разтворим в алкохоли, неразтворим във вода. Приема се в комбинация със сярна киселина и етанол. Etіlyuyuchim агент в органичния синтез. Прониква през кожата.
диметилсулфат(CH3)2SO4. Точка на топене -26,8°C, точка на кипене 188,5°C. Rozchinny в алкохоли, гаден - във вода. Реагира с амоняк без търговец (с вибрация); серни деяки ароматни сполуки, например ефири феноли. Отстранете 60% олеум с метанол при 150°C, като метилиращ агент в органичния синтез. Канцерогенът засяга очите, кожата, органите на дихателната система.
^ Натриев тиосулфат Na 2 S 2 O 3
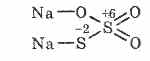
Силата на тиосярната киселина, под формата на два атома сяра, може да варира в степента на окисление: +6 и -2. Кристална реч, доброта край водата. Произвежда се под формата на Na 2 S 2 O 3 5H 2 O кристалохидрат, под името хипосулфит. Otrimuyut в комбинация с натриев сулфит със сяра при кипене:
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
Як и тиосярна киселина, силен агент, лесно се окислява от хлор до сярна киселина:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O \u003d 2H 2 SO 4 + 2NaCl + 6HCl
На тази реакция натриевият тиосулфат се основава на добавянето на натриев тиосулфат за глина към хлор (в първите антигазове).
С други думи, натриевият тиосулфат се окислява със слаби окислители. С това се разтварят соли на тетратионова киселина, например:
2Na 2 S 2 O 3 + I 2 \u003d Na 2 S 4 O 6 + 2NaI
Натриевият тиосулфат е страничен продукт при производството на NaHSO 3, хамбарите без сяра, при пречистването на промишлени газове от сяра. Zastosovuєtsya vydalennya slidіv хлор след vіdbіlyuvannya тъкани, За изследване на sríbla z руди; е фиксиране във фотографията, реагент в йодометрията, триене в случай на замърсяване с mish'yaku, живак, метод против миризма.
1 слайд
Сирка(IV) оксид. Сярна киселина. Учител по химия, MBOU "Yelhovska ZOSH" на Almetyevsk общински район на Република Татарстан Gafarova A.Z

2 слайд
Мета урок: Повторете и затвърдете знанията за силата на киселинните оксиди и киселините. Погледнете силата от страна на сирка - серен газ и сярна киселина и його соли. Обърнете внимание на инжектирането на серен газ на dovkіllya, че здрави хора. vmіti добавят равни реакции от молекулярна гледна точка и от гледна точка на процесите оксид-вода. Морално и естетически, научавайки се да твърде много средно положение.

3 слайд
Otrimanya oksidіv 1. Добив на речи (Окисление на киселина) а) прости речи Mg +O2=2MgO S+O2=SO2 b) сгъваеми речи 2H2S+3O2=2H2O+2SO2 2. Полагане на сгъваеми речи a) CaCO3=CaO+CO2 соли b) основи Cu (OH)2=CuO+H2O c) кисели киселини H2SO3=H2O+SO2

4 слайд
1) Денят гори на повърхността на черните полулуни, когато се разтваря серен газ или серен оксид (IV) SO2 и често серен оксид (VI) SO3: S + O2 \u003d SO2 серен оксид (IV)

5 слайд
Серен оксид (IV) (чист газ) молекулна формула SO2 етапи на окисление на сяра (+4). Ковалентна полярна връзка Молекулярна кристална решетка

6 слайд
Електронен баланс 1) S-2 -6e → S+4 Окислител O2+4e → 2O -2 Окислител 2) S0 -4e → S+4 Окислител O2+4e → 2O -2 Окислител

7 слайд
Назначеното правомощие ще бъде повторено. D повторете -? M(Повторение)= 29 g/mol M(H2S)=64g/mol D повторение = 64:29=2,21 D повторение =2,21

8 слайд
Обсебеност от промишлеността на серния газ. пареща сирка или сулфиди, главно пирит: 4FeS2+ 11O2 = 2Fe2O3 + 8SO2 ZnS + O2 = ZnO + SO2

9 слайд
Получаване на серен оксид (IV) в лабораторни кори чрез инжектиране на силни киселини върху сулфит и хидросулфит. Сярна киселина, която се разтваря - H2SO3 бързо се разлага на SO2 и H2O: Na2SO3 + H2SO4 = Na2SO4 + H2SO3 Също така действа концентрирана сярна киселина върху ниско активен метал при нагряване Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O

10 слайд
Физическа сила. Серен оксид (IV) или серен газ, за нормални умове, е газ без бар с характерна остра миризма (мирис на сирник, който е добър за сън), повече от 2 пъти по-важен за повторение, се различава в вода. Otruyny. Когато се охлади до -10 ° C, той прераства в безплодна родина. Диспергиран във вода със сярна нестабилна киселина, разпределение 11,5 g/100 g вода при 20 °C, намаляващо с повишаване на температурата. Предлага се и в етанол, сярна киселина.

11 слайд

12 слайд
Химическо доминиране на киселинните оксиди ХИМИЧНА ПОЛИТИКА НА КИСЕЛИННИТЕ ОКСИДИ 1. Киселинен оксид + Вода \u003d Киселина (p. z'ednannya) CO2 + H2O \u003d H2CO3, SiO2 - не реагира 2. Киселинен оксид + Основа \u003d Sil + H2O 2K3PO 4 + 3H2O 3. Основен оксид + Киселинен оксид \u003d Sil (p. z'єdnannya) CaO + SO2 \u003d CaSO3

13 слайд
Химическа сила на серен оксид (IV) 1. Киселинен оксид + Вода = Киселина SO2 + H2O = H2SO3 2. Киселинен оксид + Luga = Sil + H2O SO2 + 2KOH = K2SO3 + H2O SO2 + 2OH - = SO3 2- + H2 оксид + Киселинен оксид \u003d Sil CaO + SO2 \u003d CaSO3

14 слайд
Химично преобладаване на киселини 1. Променете препарата на индикатора. 2. Реагират с метали в серията активност до H2 (vikl. HNO3 -азотна киселина) Me + ACID = CIL + H2 (r. заместване) 3. С основни (амфотерни) оксиди MexOy + ACID = CIL + H2O (r. обмен) 4. Реакция с основи - реакция на неутрализация ACID + PIDSTAVI = CIL + H2O (r. обмен) vaê в серията: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 > H2CO3 > H2S > H2SiO3. Предната кожна киселина може да бъде отстранена от солената атака

15 слайд
Равномерна дисоциация на сярна киселина. H2SO3 → H+ + HSO3 - HSO3 - ↔ H+ + SO3 2- Ce киселина със средна сила, която се среща само във водни източници. Вон дава 2 вида соли: HSO3 - SO3 2-хидросулфит сулфит

16 слайд
Якисна реакцияна сулфит. Взаимодействие на сол със силна киселина, при което се вижда газ със силна миризма Na2SO3+H2SO4=Na2SO4+S02 +H2O

17 слайд
Окисляване на силата на серен оксид (IV). 2H2S-2 + S +4O2 → 2H2O + 3S 0 S+4 +4е→ S0 Окислител S-2 -2е→ S0 Видновник

18 слайд
Влияние върху доминирането на серен оксид (IV) 2SO2+ O2 = 2SO2 SO2 + Br2 + 2H2O = H2 SO4 + 2HBr 5 SO2 + 2KMn SO4 + 2H2O = 2H2SO4 + 2Mn SO4 + K2 SO4 S+4 - 2е→

19 слайд
Използване на серен оксид (IV). Повечето от серния оксид (IV) е викотен за производството на сярна киселина. Използва се и като консервант (kharchova добавка E220). Така че, тъй като този газ се вкарва от микроорганизми, зеленчуците и складовете се опушват с него. Оксидът на сирка (IV) е викотен за обработка на слама, шев и мъх, така че материалите не могат да бъдат третирани с хлор. Виното е регистрирано и като търговец на дребно в лаборатории. Серен оксид (IV) също се използва за притежание на различни соли на сярна киселина.

20 слайд
Физиологична активноствърху организма. SO2 също е токсичен. Симптомите на отравяне със серен газ са немъртви, кашлица, дрезгав глас, силно гъделичкане в гърлото и странна въздишка. При вдишване на серен газ, висока концентрация - отрова, несъгласие на движението, трудно коване, повръщане и способност за враждебен набряк крак. С кратко вдишване направете силна закачка, извикайте кашлица и гъделичкане в гърлото. Tsíkavo, scho чувствителността към SO2 също е различна в отделните хора, същества и roslin. И така, средната роза е най-голямото стъбло по отношение на излагане на серен газ бреза и дъб, най-малко - троянда, бор и ялина.

21 слайд
Влияние върху атмосферата. Чрез създаването на големите градове, като един от основните газове, които замърсяват атмосферата, се отделя серен диоксид. Най-големият проблем е замърсяването с полуразпад на сярата, която се отделя в атмосферата при изгарянето на въглища, нафта и природен газ, както и при кипене на метали и образуване на сярна киселина. Антропогенна забруднения сиркой вдвичи перевишую естествена. Серният анхидрид става кисел при поетапното окисление на серния анхидрид след участието на светлината. Крайният продукт на реакцията е аерозол от сярна киселина в povitria, rozchin в дървена вода (в мрачен). Падайки с падането, той вкисва почвата, zagostryu zahvoryuvannya диви начини, прикрепени към здрави хора. Използването на аерозол със сярна киселина от димни смоли в химическата промишленост често е показано при ниска тъмнина и високо съдържание на вода. Израстъците на такива предприятия звънят плътно с капещи некротични пламъци, които са се заселили в местата на утаяване на капки сярна киселина, за да доведат присъствието й в необходимата среда в istotnyh kіlkosti. Пирометалургичните предприятия на цветната и черната металургия, както и топлоелектрическата централа, масово отделят десетки милиони тонове серен анхидрид в атмосферата. Най-високите концентрации на серен газ са налични в pivnichny pivkul, особено на територията на САЩ, Европа, Китай, европейската част на Русия и Украйна. В pivdenniy pivkulí vmíst yogo е значително по-нисък.

22 слайд
§12 p34 No. 5 поставя еднакви реакции в йонен и краткотраен йонен вид. Дякую за урока. Урокът свърши.
Етап на окисление +4 за sirka е стабилен и се проявява в тетрахалогениди SHal 4, оксодихалиди SOHal 2, диоксид SO 2 и подобни аниони. Знаем силата на серния диоксид и сярната киселина.
1.11.1. Sirka(IV) оксид Budov молекули so2
Молекулата на Будов SO 2 е подобна на молекулата на Будов за озон. Атомът на кръга се прекупува в sp 2 -хибридизационната станция, формата на въртене на орбиталите е правилното трико, формата на молекулата е върхът. Електронна двойка не е прикрепена към атомите на сирка. Довжина връзка S - O е 0143 nm, разрезът на валентността е 119,5 °.
Будова потвърждава появата на резонансни структури:
В същото време като озон, множествеността на S-O връзката е равна на 2, така че основният принос към първата резонансна структура. Молекулата се вдъхва от висока термична стабилност.
Физическа сила
За изключителни умове, серният диоксид и серният газ са газ без варели с остра, задушлива миризма, точка на топене -75 °С, точка на кипене -10 °С. Добро разпределение във вода, при 20 ° C в 1 обем вода се отделят 40 обема кисел газ. Токсичен газ.
Химично преобладаване на серен оксид (IV)
Sirchisty газът е силно реактивен. Сирка диоксидът е киселинен оксид. Vín dosit добра rozchinny близо до водата с одобрението на hydrativ. Освен това вината често взаимодействат с вода, задоволявайки слаба сярна киселина, която не се вижда в индивидуалния вид:
SO 2 + H 2 O \u003d H 2 SO 3 \u003d H + + HSO 3 - \u003d 2H + + SO 3 2-.
В резултат на дисоциацията се установяват протони, поради което средата е кисела.
Когато газоподобният серен диоксид преминава през натриев хидроксид, натриевият сулфит се разтваря. Натриевият сулфит реагира с излишния серен диоксид и разтваря натриевия хидросулфит:
2NaOH + SO 2 = Na 2 SO 3 + H 2 O;
Na 2 SO 3 + SO 2 \u003d 2NaHSO 3.
За серен газ е характерна двойствеността на окислителната вода, например vin, влияеща върху мощността, игнорирайки бромната вода:
SO 2 + Br 2 + 2H 2 O \u003d H 2 SO 4 + 2HBr
и розчин калиев перманганат:
5SO 2 + 2KMnO 4 + 2H 2 O \u003d 2KНSO 4 + 2MnSO 4 + H 2 SO 4.
окислен от кисел в безводен безводен:
2SO 2 + O 2 \u003d 2SO 3.
Оксидите на силата се проявяват при взаимодействие със силни лидери, например:
SO 2 + 2CO \u003d S + 2CO 2 (при 500 ° C, в присъствието на Al 2 O 3);
SO 2 + 2H 2 \u003d S + 2H 2 O.
Получаване на серен оксид (ІV)
Spalyuvannya sirka на пода
S + O2 = SO2.
Окисляване на сулфиди
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2.
Диагностика на силни киселини върху сулфитни метали
Na 2 SO 3 + 2H 2 SO 4 \u003d 2NaHSO 4 + H 2 O + SO 2.
1.11.2. Сярна киселина и нейните соли
Когато серният диоксид се разтвори във вода, се разтваря слаба сярна киселина, основната маса на разтворения SO 2 се намира в очевидно хидратирана форма SO 2 H 2 O, когато се охлади, също се вижда кристалохидрат, само малка част от молекулите на сярната киселина се дисоциират върху сулф t-i хидросулфит-йони. В свободната станция не е видяна киселина.
Като двуосновен, той образува два вида соли: средни - сулфитни и кисели - хидросулфитни. Във водата има повече сулфити от локви метали и хидросулфити от локви и метали от локва.
