Nemetalinis rūgšties oksido rūgšties stiprus pistoletas. Genetinis ryšys tarp pagrindinių neorganinių kalbų klasių
>> Chemija: genetinis ryšys tarp kalbos klasių
Genetinė
vadinama sąsaja tarp skirtingų klasių kalbų, jų tarpusavio transformacijų pagrindų ir panašumo vienovės atsiradimo, su kalbų geneze.
Mūsų informacijos apie kalbų klasifikaciją santrauką galima pateikti pažvelgus į schemą.
Žinodami paprastų kalbų klasę, galime sudėti dvi genetines eilutes: genetinę metalų eilutę.
Genetinė metalų serija įtakoja skirtingų klasių kalbų tarpusavio ryšius, kurių pagrindas yra tas pats metalas.
Atskirai dvi skirtingos genetinės metalų serijos
1. Genetinė metalų serija, kaip hidroksidas pievoje. Laukinis ieškotojas gali turėti tokią idėjų seriją su įmantriu pakeitimu:

2. Genetinė metalų serija, kaip tam tikras neaiškus pagrindas. Ši serija yra turtingesnė genetiniais ryšiais, todėl geriau parodyti abipusių transformacijų (tiesioginių ir atvirkštinių) idėją. Laukinis ieškotojas gali turėti tokią idėjų seriją su įmantriu pakeitimu:
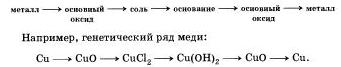
Genetinė nemetalų serija įtakoja skirtingų klasių kalbų tarpusavio ryšius, kurių pagrindus ir kloja tas nemetalas.
Čia taip pat galite pamatyti du skirtingus dalykus.
1. Genetinė nemetalų serija, kaip ir rausvos rūgšties hidroksidas, gali būti matoma tokiame lankelyje:
nemetaliniai -> rūgšties oksidas-> rūgštis -> stiprus
Pavyzdžiui, fosforo genetinė serija:
2. Tokios lancetinės transformacijos pagalba gali būti pavaizduota nemetalų genetinė serija, kaip tam tikra netvirta rūgštis:
nemetalas - rūgštinis oksidas - stiprus - rūgštis - rūgštinis oksidas - nemetalas
Oskіlki z vyvchennyh mums rūgštys nerazchinnoy є mažiau silicio rūgšties, kaip likusios genetinės serijos pavyzdį galime pažvelgti į genetinę silicio seriją:
1. Genetinis ryšys.
2. Genetinė metalų ir atmainų serija.
3. Genetinė nemetalų ir atmainų serija.
Užrašykite lygias reakcijas, kurių pagalba galite sukurti transformaciją, kuri yra metalų ir nemetalų genetinės serijos indukcija. Nurodykite kalbų pavadinimus, lygias reakcijas į elektrolitų dalyvavimą, parašykite tą patį jonine forma.
Užrašykite lygias reakcijas, kurių pagalba galite sukurti tokias transformacijas (rodyklių įgūdžius, lygių reakcijų rodykles):
a) Li - Li2O - LiOH - LiNO3
b) S - SO2 - H2SO3 - Na2SO3 - SO2 - CaSO3
Lygios reakcijos dėl elektrolitų dalyvavimo taip pat turėtų būti parašytos jonine forma.
Kaip vadovas žemesniems kalboms, jie bus tarpusavyje modifikuojami su druskos rūgštimi: magnis, midi oksidas (II), midi hidroksidas (II), midi, magnio nitratas, hidroksido druska (III), silicio oksidas (IV), nitrato sriblis, sulfidas. druska (II)? Užrašykite galimų reakcijų skaičių molekuline ir jonine forma.
Jei reakcijos neįmanoma išsiaiškinti, paaiškinkite, kodėl.
Yaki z, režisuojantis žemesnes kalbas, bus intermodalinis su natrio hidroksidu: anglies oksidu (IV). kalcio hidroksidas, midi (II) oksidas, midi (II) nitratas, amonio chloridas, silicio rūgštis, kalio sulfatas? Užrašykite galimų reakcijų skaičių molekuline ir jonine forma. Jei reakcijos nevyksta, paaiškinkite, kodėl.
Suteikite pavadinimą visoms kalbų klasėms, nukreiptoms į stalą. Jakі grupėse daro odos klasės kalbas?
Tarp neorganinių laukų klasių yra genetinis ryšys. Iš paprastų kalbų galite paimti lankstymą ir navpaką. Vienos klasės tvarka gali būti atimta iš kitos klasės.
Supaprastintas genetinis ryšys tarp neorganinių laukų klasių gali būti pavaizduotas tokia schema:
Tokių nemetalų transformacijų seka gali būti pavaizduota įžeidžiančia schema: CaHPO 4
R → R 2 Pro 5 → H 3 RO 4 → Ca 3 (RO 4) 2
(SaOH) 3 RO 4
Įprastiems metalams galima sukurti naują diržo pakeitimą:
Ba → BaO → Ba(OH) 2 → BaSO 4
Metalams, oksiduotiems ir hidroksidiniams amfoteriniams junginiams (metalams) galima pakeisti virsmo pradžią:
Al → Al 2 O 3 → Al(OH) 3 → Na → AlCl 3 → AlOHCl 2 → Al(OH) 3 → Al 2 O 3.
Nuorodos tarp klasių:
1. Metimas, nemetimas→ druskos.
Nepertraukiamai sąveikaujant metalams ir nemetalams, ištirpsta rūgščių be rūgščių druskos (halogenidas, sulfidas):
2Na + C1 2 = 2NaCl
Qi puselės yra stabilios ir kaitinamos, kaip taisyklė, neišsiplečia.
2. Baziniai oksidai, rūgštiniai oksidai→druskos.
CaO + CO 2 \u003d CaCO 3;
Na 2 O + SO 3 \u003d Na 2 SO 4.
3. Bazės, rūgštys→druskos.
Atlikite papildomą neutralizacijos reakciją:
2NaOH + H2SO4 \u003d Na2SO4 + 2H2O,
ВІН - + Н + Н 2 O;
Mg (OH) 2 + 2HC1 \u003d MgCl 2 + 2H 2 O,
Mg (OH) 2 + 2H + → Mg 2+ + 2H2O.
4. Metalai→Pagrindiniai oksidai.
Dauguma metalų sąveikauja su rūgščiais gesinančiais oksidais:
2Ca + O2 = 2CaO;
4A1 + 3O2 = 2A12O3.
Auksas, sidabras, platina ir kiti taurieji metalai nesąveikauja su rūgštimi, tokių metalų oksidai turi netiesioginį kelią.
5. Nemetali→ rūgščių oksidai.
Nemetalai (su halogenų ir tauriųjų dujų užuominomis) sąveikauja su rūgščiais, gesinančiais oksidais:
4P + 5O 2 \u003d 2P 2 O 5;
S + O2 = SO2.
6. Baziniai oksidai→ pamatai.
Be tarpinės sąveikos su vandeniu, galima pašalinti tik hidroksidus ir pievų žemės metalus (pievas):
Na2O + H2O \u003d 2NaOH;
CaO + H 2 O \u003d Ca (OH) 2.
Kiti siūlo naudoti netiesioginį kelią.
7. Rūgščių oksidai→rūgštys.
Rūgščių oksidai sąveikauja su vandeniu, palengvindami rūgštines rūgštis:
SO 3 + H 2 O \u003d H 2 SO 4;
P 2 O 5 + 3H2O \u003d 2H3PO4.
Vignatok SiO 2, kuris nereaguoja su vandeniu.
8. Bazės, rūgščių oksidai→ druskos.
Pievos sąveikauja su rūgštiniais oksidais, druskų druskomis:
2NaOH + SO 3 \u003d Na 2 SO 4 + H 2 O,
2OH - + SO3 = SO4 2- + H2O;
Ca (OH) 2 + CO 2 \u003d CaCO 3 ↓ + H 2 O,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Rūgštys, baziniai oksidai→druskos.
Metalų oksidai ištirpsta rūgštyse, todėl susidaro druskos:
CuO + H 2 SO 4 \u003d CuSO 4 + H 2 O,
CuO + 2Н + = Cu 2+ + Н 2 O;
Na 2 O + 2HC1 \u003d 2NaCl + H 2 O,
Na2O + 2H+ = 2Na + + H2O.
10. Pateikti→Pagrindiniai oksidai.
Neatskiriamos bazės ir LiOH kaitinimo metu išdėstomos:
2LiOH \u003d Li 2O + H2O;
Cu (OH) 2 \u003d CuO + H 2 O.
11. Rūgštys→rūgščių oksidai.
Nestabilūs bučiniai gali atsispirti rūgštims ir plisti kaitinant (H 2 SiO 3) ir įkaisti nekaitinant (H 2 C 3, HClO). Tą pačią valandą nemažai rūgščių yra atsparios kaitinimui (H 2 SO 4 H 3 PO 4).
H 2 SiO 3 \u003d H 2 O + SiO 2;
H 2 CO 3 \u003d H 2 O + CO 2.
12. Metalo oksidas→ metalo.
Ant metalo ir deguonies gali nusodinti svarbūs metalų oksidai:
2HgO = 2Hg + O2.
Taip pat kreipiančiųjų pagalba metalai išgaunami iš svarbiausių oksidų:
3MnO2 + 4Al = 3Mn + 2Al 2O3;
Fe2O3+3H2=2Fe+3H2O.
13. Rūgščių oksidai→ neišmestas.
Dauguma nemetalų oksidų kaitinant nesiplečia. Nemetalų oksidai (halogeno oksidai) yra išdėstyti ant nemetalų ir kisen.
Deyakі nemetal otrimuyut at vіdnovlennі z vіdpovіdnyh oksіv:
SiO 2 + 2Mg \u003d 2MgO + Si.
14. Druskos, bazės → bazės.
Nenuoseklios bazės skiriasi rūgščių rūgščių skirtumais:
CuSO 4 + 2NaOH \u003d Cu (OH) 2 ↓ + Na 2 SO 4,
Cu 2+ + 2OH - → Cu(OH) 2 ↓;
FeCl 2 + 2KOH \u003d Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - \u003d Fe (OH) 2 ↓.
15. Druskos, rūgštys → rūgštys.
Rozmarinų druskos sąveikauja su rūgštimis (priklausomai nuo vitiligo serijos), dėl to ištirpsta silpna arba laki rūgštis:
Na 2 SiO 3 + 2HCl \u003d 2NaCl + H 2 SiO 3 ↓,
SiO 3 2- + 2H + → H 2 SiO 3 ↓;
NaCl (kietas) + H2SO4 (c) = NaHSO4 + HCl.
16. Druskos→ baziniai oksidai; rūgščių oksidai.
Dearūgštinių rūgščių druskos (nitratai, karbonatai) suyra kaitinant:
CaCO 3 \u003d CaO + CO 2;
2Cu(NO 3) 2 \u003d 2CuO + 4NO 2 + O 2.
TEISĖ Į SAVARANKIŠKĄ DARBĄ TEMA "GENETINIAI SANTYKIAI PAGAL NEORGANIŠKŲ TYRIMŲ KLASES"
1. Pavadinkite po kalba esančią dangą, suskirstykite jas pagal neorganinių nuosėdų klases: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O 7, Fe (OH) 2, P 2 O 5 HF, MnO 2.
2. Bet kokiam apatinių dalių padengimui hidroksidą (rūgštį arba bazę) galima pašalinti vienu etapu: varis, druskos oksidas (P), bario oksidas, azoto oksidas (P), azoto oksidas (V), silicis oksidas, midi sulfatas, kalio chloridas, kalis, magnio karbonatas.
3. Iš pasiūlymo surašykite kalbų formules, kurios priklauso: 1) oksidams; 2) pakaitas; 3) rūgštys; 4) druskos:
H 2, NaOH, HCl, SO 3, CuSO 4, NaNO 3, KCl, H 2 SO 4, Ca(OH) 2, P 2 O 5, HNO 3, Al(OH) 3.
4. Vardinė kalba: Zn (OH) 2, MgO, P 2 O 3, NaHCO 3, H 3 PO 3, Fe 2 (SO 4) 3, KOH, (AlON) 3 (PO 4) 2, Ba (MnO 4) ) 2, CO, HI. Pasakyk man, kokiai klasei turėtų būti kalbama apie odą.
5. Parašykite prasidėjusių kalbų molekulines formules ir nurodykite, kuriai klasei priklauso odos kalba:
1) hidroksokarbonato midi (II);
2) azoto oksidas (V);
3) nikelio (II) hidroksidas;
4) bario hidrofosfatas;
5) perchloro rūgštis;
6) chromo (III) hidroksidas;
7) kalio chloratas;
8) sirkovodny rūgštis;
9) natrio cinkatas.
6. Pateikite dienos reakcijų pavyzdžių tarp:
1) paprasta kalba-nemetalai;
2) paprasta kalba ir oksidas;
3) oksidai;
4) sulankstoma kalba, bet ne oksidai;
5) metaliniai ir nemetaliniai;
6) kalbų trioma.
7. Kuris iš šių kalbų gali sukelti reakciją:
1) anglies oksidas (IV): HCl, O 2, NO 2, KOH, H 2 O;
2) magnio oksidas: (OH) 2, HCl, CO 2, O 2, HNO 3;
3) druskos hidroksidas (II): KCl, HC1, KOH, O 2, H 2 O, HNO 3;
4) chloridinis vanduo: Zn, MgO, ZnCl 2, HNO 3, Ca(OH) 2, Cu, (ZnOH)Cl.
8. Galima bendrauti tokiomis kalbomis:
1) anglies oksidas (IV) ir kalio hidroksidas;
2) kalio hidrosulfatas ir kalcio hidroksidas;
3) kalcio fosfatas ir sieros rūgštis;
4) kalcio hidroksidas ir sieros oksidas (IV);
5) sieros rūgštis ir kalio hidroksidas;
6) kalcio bikarbonatas ir fosforo rūgštis;
7) silicio oksidas ir sieros rūgštis;
8) cinko oksidas ir fosforo (V) oksidas.
Parašykite vienodas galimas reakcijas, tarkime, mintis, kurioms smirda. Jei reakcijos gali sukelti skirtingas kalbas, pasakykite mums, kodėl skiriasi jų elgesys.
9. Sukelti įžeidžiančių kalbų valdymo reakcijų išlyginimą: natrio ortofosfatas (4 metodai), kalio sulfatas (7 metodai), cinko hidroksidas.
10. Vienas iš sodos (natrio karbonato) pašalinimo būdų naudojamas anglies dioksido (IV) oksidui redukuoti ant natrio aliuminato. Išsaugokite vienodas reakcijas.
11. Nekeisdami koeficientų, parašykite reakcijos produktus:
1) MgO + 2H 2 SO 4 →
2) 2SO 2 + Ba (OH) 2 →
3) 3N 2 O 5 + 2Аl(OH) 3 →
4) Р 2 O 5 + 4NaOH →
5) P 2 O 5 + 6NaOH →
6) P 2 O 5 + 2NaOH →
12. Išsaugokite vienodas reakcijas skirtingų tipų druskoms:
1) SO 2 + (OH) 2 → (vidutinė ir rūgšti druska),
2) A1 2 O 3 + H 2 O + HNO 3 → (vidutinio stiprumo, bazinės druskos),
3) Na 2 O + H 2 S → (vidutinės rūgšties druska),
4) SO 3 + Ca (OH) 2 → (vidurinės ir bazinės druskos),
5) CaO + H 2 O + P 2 O 5 → (bazinis stiprumas, rūgščių druskos).
13. Užbaikite reakcijų išlyginimą:
CaO + A1 2 O 3 → CaHPO 4 + Ca (OH) 2 →
Cr 2 O 3 + H 2 SO 4 → AlOHSO 4 + NaOH →
Cr 2 O 3 + NaOH → CaCO 3 + CO 2 + H 2 O →
A1 2 O 3 + HClO 4 → Ca(HCO 3) 2 + HCl →
Mn 2 O 7 + KOH → ZnS + H 2 S →
NO 2 + Ca (OH) 2 → CaSO 4 + H 2 SO 4 →
Zn(OH) 2 + NaOH → (ZnOH)Cl + HCl →
Zn(OH)2 + HNO3 → Bi(OH)3 + H2SO4 (trūksta) →
AlCl 3 + NaOH (trūksta) → (FeOH)Cl + NaHS →
AlCl 3 + NaOH → Na 2 ZnO 2 + H 2 SO 4 (per daug) →
AlC1 3 + NaOH (per daug) → Ca(AlO 2) 2 + HC1 (per daug) →
14. Užrašykite lygias reakcijas, kurių pagalba galite sukurti tokią transformaciją:
1) Cu → CuO → CuSO 4 → Cu(OH) 2 → CuC1 2 → Cu(NO 3) 2
2) Zn → ZnO → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2 → ZnCl 2
3) R → R 2 O 5 → H 3 R 4 → K 3 R 4 → Ca 3 (PO 4) 2 → H 3 RO 4
4) Mg → MgO → MgCl 2 → Mg(OH) 2 → Mg(HSO 4) 2 → MgSO 4
5) Ca → CaO → Ca(OH) 2 → CaCO 3 → Ca(HCO 3) 2 → CO 2
6) Cr → Cr 2 (SO 4) 3 → Cr(OH) 3 → NaCrO 2 → Cr 2 O 3 → K
7) P → P 2 O 5 → HPO 3 → H 3 PO 4 → NaH 2 PO 4 → Na 3 PO 4
8) CuS → CuO → CuSO 4 → Cu(OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al(HSO 4) 3 → Al(OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl 2 → Zn → Na 2
12) Zn → ZnSO 4 → ZnCl 2 → Zn(OH) 2 → Na 2 → Zn(NO 3) 2
13) Ca → CaCl 2 → CaCO 3 → Ca(HCO 3) 2 → Ca(NO 3) 2
14) Ca → Ca(OH) 2 → CaCO 3 → CaCl 2 → CaCO 3 → Ca(NO 3) 2
15) CuO → CuCl 2 → Cu(NO 3) 2 → CuO → CuSO 4 → Cu
16) CaO → Ca(OH) 2 → Ca(NO 3) 2 → Ca(NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgSO 4 → MgCl 2 → Mg(NO 3) 2 → Mg(OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca(H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca(H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaCl 2 → Ca(NO 3) 2 → CaSO 4
21) PbO → Pb (NO 3) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbCl 2
22) ZnO → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2 → Zn(OH) 2 → K 2
23) Al 2 O 3 → AlCl 3 → Al(OH) 3 → NaAlO 2 → Al(OH) 3 → K
24) ZnSO 4 → Zn(OH) 2 → ZnCl 2 → Zn → ZnO → Zn(NO 3) 2
25) AlCl 3 → Al(NO 3) 3 → Al(OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na 2 PbO 2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe(OH) 3 → FeOH(NO 3) 2 → Fe(NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO 4 → K 2 SO 4 → KCl → KNO 3
29) Cu(OH) 2 → CuOHNO 3 → Cu(NO 3) 2 → CuSO 4 → CuCl 2 → Cu(NO 3) 2
30) CaCl 2 → Ca → Ca(OH) 2 → CaCl 2 → Ca(NO 3) 2 → CaSO 4
31) Su → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgSO 4 → MgCl 2 → MgOHCl → Mg(OH) 2 → MgOHNO 3
33) CuSO 4 → CuCl 2 → ZnCl 2 → Zn(OH) 2 → Na 2 ZnO 2 → Zn(OH) 2
34) Hg(NO 3) 2 → Al(NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al(OH) 3 → AlOHCl 2
35) ZnSO 4 → Zn(OH) 2 → ZnCl 2 → AlCl 3 → Al(OH) 3 → A1 2 O 3
36) CuCl 2 → Cu(OH) 2 → CuSO 4 → ZnSO 4 → Zn(OH) 2 → Na 2 ZnO 2
37) Fe(NO 3) 3 → FeOH(NO 3) 2 → Fe(OH) 3 → FeCl 3 → Fe(NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al(OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg(OH) 2 → MgSO 4 → MgCl 2 → Mg(NO 3) 2 → Mg(OH) 2 → MgO
40) aliuminio sulfatas → aliuminio chloridas → aliuminio nitratas → aliuminio oksidas → kalio aliuminis → aliuminio hidroksidas → aliuminio hidroksochloridas → aliuminio chloridas.
41) Na → NaOH → Na 3 PO 4 → NaNO 3 → HNO 3 → N 2 O 5
42) BaCO 3 → Ba(HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu(OH) 2 → Cu(HSO 4) 2 → CuSO 4
44) baris → bario hidroksidas → bario hidroksidas → bario chloridas → bario karbonatas → bario chloridas → bario hidroksidas
45) P → P 2 O 5 → H 3 PO 4 → Ca(H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr 2 O 3 → NaCrO 2 → CrCl 3 → Cr(OH) 3 → Cr 2 O 3 → Cr
47) Cr 2 O 3 → CrCl 3 → Cr(OH) 3 → Na 3 → Cr 2 (SO 4) 3 → CrCl 3
48) K → KOH → KCl → KOH → K 2 SO 4 → KNO 3 → KNO 2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl 2 → Zn(OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca(HCO 3) 2 → CaCO 3 → CaCl 2
51) Z → CO 2 → NaHCO 3 → Na 2 CO 3 → CO 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Сu → Сu(OH) 2 → Cu(NO 3) 2 → CuO → Сu
54) R2O5 → H3R4 → CaHP4 → Ca (H2R4)2 → Ca3 (PO 4) 2
55) Fe → FeCl 2 → Fe(OH) 2 → FeSO 4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (NO 3) 2 → ZnO
57) CuS → SO 2 → KHSO 3 → CaSO 3 → SO 2
58) SO 2 → H 2 SO 4 → CuSO 4 → CuO → Cu(NO 3) 2
59) KHSO 3 → CaSO 3 → Ca(HSO 3) 2 → SO 2 → K 2 SO 4
60) SO 2 → CaSO 3 → SO 2 → NaHSO 3 → SO 2
61) NaHCO 3 → Na 2 CO 3 → NaCl → NaHSO 4 → Na 2 SO 4
62) K → KOH → KCl → KNO 3 → K 2 SO 4 → KCl
63) NaCl → Na → NaOH → Na 2 SO 4 → NaCl
64) Al → AlCl 3 → Al(OH) 3 → A1 2 O 3 → Al(OH) 3
65) CuO → Su → CuCl 2 → CuSO 4 → CuS
66) Fe → FeSO 4 → Fe(OH) 2 → Fe → Fe(OH) 3
67) Fe → Fe(OH) 2 → FeCl 2 → Fe(NO 3) 2 → Fe
68) Fe(NO 3) 3 → Fe 2 O 3 → FeCl 3 → Fe(NO 3) 3 → Fe
69) CuO → CuSO 4 → Cu(OH) 2 → CuO → Su
70) MgCO 3 → MgO → MgCl 2 → Mg(OH) 2 → Mg(NO 3) 2
71) Mg → Mg(OH) 2 → MgSO 4 → MgCO 3 → Mg(HCO 3) 2
72) CaO → Ca(OH) 2 → CaCl 2 → CaCO 3 → CO 2
73) CaCO 3 → Ca(HCO 3) 2 → CaCl 2 → Ca(NO 3) 2 → O 2
74) FeS → Fe 2 O 3 → Fe(OH) 3 → Fe 2 (SO 4) 3 → FeCl 3
75) KC1 → K 2 SO 4 → KOH → K 2 CO 3 → KOH
76) CuS → CuO → Cu(OH) 2 → CuSO 4 → Cu
77) Fe → Fe(OH) 3 → Fe(NO 3) 3 → FeCl 3 → Fe 2 (SO 4) 3
78) CuSO 4 → CuO → Cu(NO 3) 2 → CuO → CuS
79) ZnS → H 2 S → SO 2 → Na 2 SO 4 → NaOH
80) Al → Al(OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al(OH) 3
81) CaCl 2 → CaCO 3 → Ca(HCO 3) 2 → CaCO 3 → CaSiO 3
82) S → ZnS → H 2 S → Ca(HSO 3) 2 → SO 2
83) Na 2 SO 4 → NaCl → HCl → CaCl 2 → Ca(NO 3) 2
84) Na 2 SO 3 → SO 2 → H 2 SO 4 → HCl → FeCl 2
85) Z → Na 2 CO 3 → CaCO 3 → CaSiO 3 → H 2 SiO 3
86) P → P 2 O 5 → Ca(H 2 PO 4) 2 → CaHPO 4 → H 3 PO 4
87) Al → A1 2 O 3 → Al(OH) 3 → A1C1 3 → A1(NO 3) 3
88) HCl → CuCl 2 → Cl 2 → HCl → H 2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH 3 → NH 4 C1 → NH 3 ∙ H 2 O → NH 4 HCO 3 → NH 3
91) NH 4 C1 → KC1 → HCl → CuCl 2 → Cu(OH) 2
92) NH3 → NH 4 H 2 PO 4 → (NH 4) 2 HPO 4 → NH 3 → NH 4 NO 3
93) KOH → KHCO 3 → K 2 CO 3 → CO 2 → Ca(HCO 3) 2
94) Na → NaOH → NaHCO 3 → Na 2 SO 4 → NaOH
95) KNO 3 → K 2 SO 4 → KC1 → KNO 3 → KNO 2
96) Cl 2 → KC1 → K 2 SO 4 → KNO 3 → KHSO 4
97) FeSO 4 → FeS → SO 2 → KHSO 3 → K 2 SO 4
98) KOH → Cu(OH) 2 → CuSO 4 → Cu(OH) 2 → Cu
99) Fe 2 O 3 → FeCl 3 → Fe(OH) 3 → Fe(NO 3) 3 → Fe 2 O 3
100) Al → A1 2 O 3 → A1(NO 3) 3 → A1 2 O 3 → Al(OH) 3
101) CaO → CaCO 3 → CaSiO 3 → Ca(NO 3) 2 → O 2
102) Cu → Cu(OH) 2 → Cu → CuSO 4 → CuCl 2
103) H 2 S → SO 2 → ZnSO 4 → ZnS → ZnO
104) Cl 2 → NaCl → HCl → CuCl 2 → CuO
105) Cl 2 → FeCl 3 → Fe 2 O 3 → Fe(OH) 3 → Fe(NO 3) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca(H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl 2 → Zn(NO 3) 2
108) ZnO → ZnSO 4 → Zn(NO 3) 2 → ZnO → Zn(OH) 2
109) H 3 PO 4 → NH 4 H 2 PO 4 → ( NH 4 ) 2 HPO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 2
110) CaCO 3 → Na 2 CO 3 → Na 3 PO 4 → NaH 2 PO 4 → Ca 3 (PO 4) 2
111) CaCl 2 → CaSO 3 → Ca(OH) 2 → CaCl 2 → Ca(NO 3) 2
112) NaOH → Na 2 CO 3 → NaHSO 4 → NaNO 3 → NaHSO 4
113) Na 2 SiO 3 → Na 2 CO 3 → Na 2 SO 4 → NaCl → Na 2 SO 4
114) KNO 3 → KHSO 4 → K 2 SO 4 → KCl → Na 2 SO 4
115) SiO 2 → K 2 SiO 3 → H 2 SiO 3 → SiO 2 → CaSiO 3
116) Cu → CuCl 2 → Cu(NO 3) 2 → NO 2 → HNO 3
117) Ca(NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H 3 PO 4 → Ca 3 (PO 4) 2 → CaHPO 4 → Ca(H 2 PO 4) 2
119) CuSO 4 → Cu → CuS → CuO → CuCl 2
120) Al → A1 2 (SO 4) 3 → Al(OH) 3 → A1C1 3 → A1(NO 3) 3
121) S → SO 3 → H 2 SO 4 → KHSO 4 → BaSO 4
122) N 2 O 5 → HNO 3 → Cu(NO 3) 2 → CuO → Cu(OH) 2
123) Al → A1 2 O 3 → Al(OH) 3 → A1 2 (SO 4) 3 → A1(NO 3) 3
124) Ca → Ca(OH) 2 → Ca(HCO 3) 2 → CaO → CaCl 2
125) NH 3 ∙H 2 O → NH 4 C1 → NH 3 → NH 4 HCO 3 → (NH 4) 2 CO 3
126) Cu (OH) 2 → H 2 O → HNO 3 → Fe (NO 3) 3 → Fe
127) SO 2 → Ca(HSO 3) 2 → CaCl 2 → Ca(OH) 2 → Ca(HCO 3) 2
128) NH 3 ∙H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO 4 → Cu → CuO → Cu(OH) 2 → Cu
130) Fe(OH) 3 → Fe → FeCl 3 → Fe(NO 3) 3 → Fe
131) Zn → Zn(OH) 2 → Na 2 → Zn(OH) 2 → Na 2 ZnO 2 → Zn
132) Zn → ZnO → Na 2 ZnO 2 → Zn(OH) 2 → Na 2 → ZnCl 2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn(NO 3) 2 → ZnO
134) ZnO → Zn(OH) 2 → K 2 ZnO 2 → ZnSO 4 → ZnCl 2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn(NO 3) 2 → ZnO → Zn
136) Al → K 3 → Al(OH) 3 → Na 3 → A1C1 3 → Al(OH) 3
137) Al 2 O 3 → KAlO 2 → Al(OH) 3 → Al 2 Pro 3 → Na 3 → Al 2 O 3
138) Al(OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1(NO 3) 3
139) A1C1 3 → K 3 → Al(NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na 2 → Be(OH) 2 → Na 2 BeO 2 → BaBeO 2
EKSPERIMENTINĖS IŠVADOS TEMAI „NEORGANIJOS STUDIJŲ PAGRINDINĖS KLASĖS“
DOSVID 1. Neutralizacijos reakcija.
a) Stiprios rūgšties ir stiprios bazės sąveika.
Į porcelianinį puodelį įpilkite 5 ml 2 N druskos rūgšties ir įlašinkite 2 N natrio hidroksido. Sumaišykite rožes su stiklo lazdele ir išbandykite jogą ant lakmuso, perkeldami rožių lašus ant lakmuso popieriaus. Būtina pasiekti neutralią reakciją (mėlyna ir raudona lakmuso paprika nekeičia užterštumo). Otrimany rozchin viparuvati sausas. Kas nutiko? Parašykite molekulines ir jonines lygias reakcijas.
b) Silpnos rūgšties ir stiprios bazės sąveika.
Į mėgintuvėlį įpilkite 2 ml 2 n tirpalo ir į neutralų tirpalą įpilkite optinės rūgšties. Parašykite molekulines ir jonines lygias reakcijas. Paaiškinkite, kodėl lygiavertė joninė reakcija, kurios likimas yra silpnas elektrolitas (oktoinė rūgštis), yra susijusi su vandens molekulių susidarymu.
DOSVID 2. Hidroksidų amfoteriškumas.
Trys iš naujausių laboratorinių reagentų nusodino cinko hidroksidą. Sustabdyti apgultį ir parodyti nedidelį kiekį jogo 2 mėgintuvėliuose. Į vieną mėgintuvėlį įpilkite druskos rūgšties, į kitą – natrio hidroksido (per daug). Ko saugotis? Parašykite dažniausiai vykstančių reakcijų molekulinės ir joninės formos santykį.
DOSVID 3. Cheminis druskų dominavimas.
a) Druskų skirtumų sąveika su svarbia kalbos įvairove.
Į mėgintuvėlį įpilkite 2 ml natrio karbonato tirpalo ir įpilkite bario chlorido tirpalo iki baltų nuosėdų. Parašykite cheminės reakcijos lygtį jonine ir molekuline išraiška. Apgulties pašalinimas padalintas į dvi dalis. Į vieną mėgintuvėlį įpilkite sieros rūgšties, į kitą – natrio hidroksido. Zrobiti visnovok apie rozchinnist apgultį rūgštyse ir pievose.
b) Lakiojo augalo druskų ir rūgščių bei tirpalų sąveika.
Į mėgintuvėlį įpilkite 2 ml natrio karbonato ir įpilkite nedidelį kiekį druskos rūgšties. Ko saugotis? Parašykite cheminės reakcijos lygtį jonine ir molekuline išraiška.
c) Sąveika tarp druskų pasiskirstymo iš pievų ir skraidančio augalo gyvenviečių.
Į mėgintuvėlį įpilkite amonio druskos, įpilkite 1-2 ml natrio hidroksido ir pakaitinkite iki užvirimo. Prie mėgintuvėlio su reakcine suma pridėkite raudono lakmuso popieriaus vologiją. Ko saugotis? Pateikite paaiškinimą. Parašykite vienodas reakcijas.
G ) Sąveika tarp druskų pasiskirstymo su aktyvesniais metalais, žemesniuoju metalu, kuris turėtų patekti į druskos sandėlį.
Zalizny (plienines) gėles reikia nuvalyti plonu švitriniu popieriumi. Išleiskime jogos sulfato midi. Silpnomis valandomis stebėkite, ar ant gėlių paviršiaus nematyti midi. Užrašykite reakcijos panašumą jonine ir molekuline išraiška.
DOSVID 4. Bazinių ir rūgščių druskų turėjimas.
a) Švino hidroksokarbonato turėjimas.
Į švino (II) acetatą įpilkite šiek tiek švino (II) oksido ir užvirinkite sumišą su dekilkoh hvilinu. Ohololijus Rozchinas supykdė apgultį ir perleido ją per naują stulpą anglies dioksidas. Ko saugotis? Filtravimo ir džiovinimo apgultis tarp filtravimo popieriaus lapų. Nurodykite pašalintų švino hidroksokarbonato nuosėdų spalvą ir pobūdį. Parašykite vienodas reakcijas. Sulenkite paimtos druskos grafinę formulę.
b) Magnio bikarbonato manija.
Į lanką stipriai rozvedenoy rozvedeny roznachka kaip magnio druska pridėti trohi rozka natrio karbonato. Kaip kalba patenka į apgultį? Rozchinas su gyvenvietės apgulimu anglies dioksidu. Posterіgat laipsniškai razchinennya apgultis. Kodėl tau rūpi? Parašykite vienodas reakcijas.
DOSVID 5. Sudėtingų druskų turėjimas.
a) Pasmerkimas su sudėtingu katijonu.
Į 2–3 ml mėgintuvėlį įlašinkite midi(II) chlorido amoniako lašą, kol nusistovės midi(II) hidroksido nuosėdos, tada įpilkite amoniako perteklių, kol nuosėdos išnyks. Cu 2+ jonų suvartojimą padalinkite iš pasirinkto kiekio. Ar tokių jonų buvimas skamba painiai? Parašykite lygią kompleksinės dalies reakciją.
b) Sprendimas su kompleksiniu anijonu.
Iki 1-2 ml gyvsidabrio (II) nitrato tirpalo lašinamas kalio jodidas, kol nusistos HgI 2 nuosėdos. Tada įpilkite per daug kalio jodido, kol apgultis nutrūks. Parašykite kompleksinės druskos reakcijos lygtį.
DOSVID 6.Žemesniųjų druskų (aliuminio-kalio galonų) turėjimas.
Paimkite 7,5 g Al 2 (SO 4) 3 18H 2 O ir sumaišykite su 50 ml vandens, tam paimdami didelį porcelianinį puodelį. Razrahuvat vienodoms reakcijoms ir pavadinimas yra būtinas reakcijai su kalio sulfatu. Paruoškite karštą kalio sulfato mišinį ir supilkite jogą, maišydami porcelianiniame puodelyje su aliuminio sulfatu. Saugokitės, kad po dienos nukris aliuminio oksido ir kalio galonų kristalai. Atvėsus ir pasibaigus kristalizacijai, supykdykite gimdos rožes, pakabinkite galonų kristalus tarp filtravimo popieriaus lapų ir pašalinkite kristalus. Apskaičiuokite išėjimų skaičių.
PLĖTROS UŽDUOTYS
1. Praleidžiant per daug vandens, po 16 g midi(II) sulfato pašalinta 1,92 g nuosėdų. Išsiaiškinti midi sulfato masės dalį vikriniame ir obsyag vitražo vandenyje.
2. Visiškam midi nusodinimui, kai yra 291 cm 3 sulfido, midi (II) sulfato skirtumas su 10% vikoristalinių dujų masės dalimi, atimant 17,6 g druskos (II) sulfido su druskos pertekliumi. rūgšties. Išsiaiškinkite išorinio midi sulfato sluoksnio storį.
3. Dujos, pastebėjimai, kai K 2 S plečiasi praskiesta sieros rūgštimi, švino (II) nitrato pralaidos per perteklinę plėtrą. Otrimaniy siege maє masu 71,7 g Išsiaiškinkite sieros rūgšties tūrį, kuri, sureagavusi, yra 1,176 g / cm 3, o masės dalis yra 25%.
4. Iki ribos, norėdami atkeršyti 8 g midi (II) sulfato, jie pridėjo rozvino, kad atkeršytų 4,68 g natrio sulfido. Apgultis filtruojama, filtratas išgarinamas. Vyznachte masė kalbų prie filtrato po išgarinimo ir masės nusodinimo midi sulfido.
5. Deyaku masu sulfido druska (II) buvo apdorota druskos rūgšties pertekliumi. Reakcijos dujų pašalinimas iš 12,5 cm 3 NaOH skirtumo, kurio masės dalis yra 25%, o storis 1,28 g / cm 3 gesinant rūgšties jėgą. Išsiaiškinkite laisvos sulfido druskos masę.
6. Sulfido druska (II), kurios masė 176 g, buvo apdorota per daug druskos rūgšties ir per daug nudegė dujos. Kokio tūrio KOH, kurio masės dalis yra 40%, o storis 1,4 g / cm 3, reikia visiškai neutralizuoti spjaudomąsias dujas?
7. Išgarinus 100 g pramoninio pirito, pašalintos dujos ir neutralizuota 400 cm 3 NaOH, kurios masės dalis 25 %, o storis 1,28 g/cm 3. Paskirkite masinę namų dalį prie pirito.
8. Iki 2 g fiziologinio tirpalo, seilių oksido (II) ir seilių oksido (III) sumos buvo pridėta 16 cm 3 su HC1 skirtumu, kurio masės dalis 20% ir storis 1,09 g/cm3. Rūgšties pertekliui neutralizuoti reikėjo 10,8 cm 3 NaOH, kurio masės dalis 10 % šarmo yra 1,05 g/cm 3. Žinoti daugybę kalbų iš sumišių, tarsi jie būtų susipažinę su vandeniu, ką matė, jie pasiekė 224 cm 3 (n.s.).
9. Ca (OH) 2 CaCO 3 ir BaSO 4 suma, kurios masė 10,5 g. Paėmus druskos rūgšties pertekliaus sumą, buvo matyti 672 cm 3 (n.o.) dujų ir 71,2 g rūgšties su masės dalis įtraukta į reakciją 10%. Įvertinkite daugybę kalbų sumishi.
10. Sumish bario chloridas, kalcio karbonatas ir natrio bikarbonatas. Sumaišius 10 g sumos vandenyje, neaiškus perteklius yra 3,5 g.
11. Є rozchin, scho atkeršyti už vieną valandą ugnies ir azoto rūgšties. Norint visiškai neutralizuoti, 10 g kiekvieno dydžio dažoma 12,5 cm 3 KOH dydžio, dažnai 19% ir 1,18 g / cm 3 storio. Pridedant iki 20 g, į bario chlorido perteklių pridedama rūgšties kiekis yra 4,66 g nuosėdų. Raskite rūgščių masės dalis sumish.
12. Visą chloro dieną, paėmus 100 g sumišų KS1 ir KNO 3, sumažėjo iki 71,8 cm 3 vandens. Skrudinant 100 g druskų sumos lieka 93,6 g kieto pertekliaus. Raskite chloro vandens masės dalį šalia vandens.
13. Per Ca(OH) 2 tarpą vėl praleidžiant 2 m 3 (n.o.), pašalinta 3 g nusodintos anglies rūgšties druskos. Išsiaiškinkite CO 2 masės dalį lauke.
14. Per suspensiją, kurioje yra 50 g CaCO 3, leidžiamos anglies dioksido dujos. Reakcija buvo 8,96 dm3 dujų (N.O.). Kiek CaCO 3 buvo prarasta iš kietosios fazės?
15. Įpylus CaO vandens masė padidėjo 30%. Kiek CaO (masės procentais) buvo grąžinta?
16. Prie upelio vandens kaitintas švino oksidas (II), kurio masė 18,47 g. Po reakcijos pašalinto švino, kuris nereagavo su oksidu, svoriui pridėjo 18,07 g Su kokiu svoriu nereagavo švino oksidas?
17. Čadny dujos praėjimo per oksidą (III) kaitinant. Kietojo pertekliaus masė po reakcijos į 2 g yra mažesnė nei druskos oksido pertekliaus masė. Koks CO dalyvauja reakcijoje (oksidas atsinaujins)?
18. Є 8,96 dm 3 (n.o.) suma N 2, CO 2 ir SO 2 su vandens keliamoji galia 25. Praleidus per daug KOH, suma pakito 4 kartus. Sužinokite apie dujų tiekimą iš išorės sumų.
19. Dviejose kolbose yra po 100 g HC1, dažna 2,5 % dozė. Į vieną kolbą įpilta 10 g CaCO 3, į kitą – 8,4 g MgCO 3. Kaip pažadinti kolbų masę po reakcijos?
20. Kokio tūrio (n.o.) rūgščių dujų reikia, kad per 200 cm 3 skirtumų su NaOH masės dalimi 0,1% ir 1 g / cm 3 būtų pašalintas rūgšties stiprumas?
21. Koks yra didžiausias anglies dioksido dujų tūris (n.o.), kuris gali išblukti 25 cm 3, kai NaOH masės dalis yra 25% ir 1,1 g / cm 3?
22. Kokiu minimaliu tūrio skirtumu, kai KOH masės dalis yra 20% ir storis 1,19 g / cm 3, galima užgesinti visas anglies dvideginio dujas, juodosiomis dujomis pašalinant 23,2 g magnetito?
23. Kokia minimali KOH masė gali reaguoti su 24,5 g fosforo rūgšties, kad produktas būtų daugiau kalio-divandenilio fosfato?
24. Kokia yra minimali Ca (OH) 2 masė, reikalinga norint pridėti iki 16 g kalcio bikarbonato, kurio druskos masės dalis yra 5%, esant vidutiniam druskos kiekiui?
25. Kiek kalio vandenilio fosfato reikia pridėti į intervalą, kiek turi būti 12,25 g H 3 PO 4, po kurio skirtumą reikia pridėti prie kalio dihidrofosfato?
26. Panašioje suspensijoje buvo paimta 56,1 g bendro kalcio ir magnio karbonatų. їх pavertimui ant angliavandenilių buvo pašalintas visas anglies dioksidas, išspjovus 7 dm 3 (n.o.) etano. Sužinokite kalcio karbonato masę vihdniy sumishi.
27. Norint 9,5 g vandenilio sumos natrio dihidrofosfatu paversti vidutinio stiprumo, reikia turėti 10 cm 3 skirtumą, kai NaOH masės dalis yra 27,7 % ir 1,3 g/cm 3. Išsiaiškinkite hidrofosfato masę sumish.
28. Per tarpą praleidžiant anglies dioksidą, pakeičiant 6 g NaOH, buvo pašalinta 9,5 g bendros rūgšties ir vidurinių druskų. Sužinokite apie nudažytą anglies dioksidą.
29. Praleidus 11,2 dm 3 (n.o.) 2, per KOH tarpą buvo paimta 57,6 g bendros rūgšties ir vidurinių druskų. Išsiaiškinkite vidurinės druskos svorį.
30. Kokią masę fosforo rūgšties reikia neutralizuoti, kad būtų paimta 1,2 g divandenilio 4,26 g natrio vandenilio fosfato?
31. NaOH buvo pridėta iki sieros rūgšties lygio ir pašalinta 3,6 g hidrosulfato ir 2,84 g natrio sulfato. Vyznachte khіmіchnі kіlkostі rūgštis ir pieva, mokyklų mainai pateko į reakciją.
32. Praleidus chloro vandenį per 200 cm 3 NaOH skirtumą, kurio masės dalis yra 10%, o storis 1,1 g / cm 3, NaOH masės dalis toje pačioje frakcijoje sumažėjo du kartus. Naudokite NaCl masės dalį skirtume, kurį nustatėte.
33. 14,4 g sumish midi ir її oksido (II) paskirstymui buvo stiklinama 48,5 g mažmeninės prekybos, kurios masės dalis HNO 3 80%. Išsiaiškinkite midi ir oksido masės dalis išorinėje sumoje.
34. 6,2 g masės natrio oksidas ištirpintas 100 cm 3 vandens ir atimta markė Nr.1. Į galutinę rūšį įpylėme 10% masės druskos rūgšties, terpė netapo neutrali, ir buvo atimta klasė Nr.
1) masinės kalbų dalys variantais Nr. 1, 2;
2) HC1 žymėjimo masė, kuri buvo išsiųsta žymėjimo Nr. 1 neutralizavimui.
35. Pakeiskite 3 g cinko su 18,69 cm 3 HC1, kurio masės dalis yra 14,6% ir 1,07 g / cm 3. Kaitinant per iškeptą CuO, kurio masė 4 g, praleidžiama daug dujų.
36. Dujos, kurios buvo matomos kalcio hidridui pavertus vandens perteklių, buvo išleistos per FeO. Dėl to oksido masė pasikeitė 8 g.
37. Skrudinant CaCO 3 Yogo masė pakito 35,2%. Kietieji reakcijos produktai padarė druskos rūgšties perteklių ir pašalino 0,112 dm 3 (n.o.) dujų. Įvertinkite išorinio kalcio karbonato ženklo svorį.
38. Midi nitratas buvo iššifruotas, o midi oksido (II) manija dažniausiai buvo pakeista vandeniu. Tuo pat metu produktai buvo perleisti per vamzdelį su P 2 O 5, o tūbelės svoris buvo 3,6 g.dosvid midi ir kokia druskos masė, ką jūs sakėte?
39. Naudojant azoto oksido (IV) per daug KOH šaltyje be rūgštumo, buvo pašalinta 40,4 g KNO 3. Kokios kalbos dar nusistovėjo ir kokios mišios?
40. 400 g skirtumo neutralizavimui, siekiant atkeršyti druskos rūgštį ir sieros rūgštį, nudažoma 287 cm 3 natrio hidroksido, kurio masės dalis yra 10 % ir 1,115 g/cm 3 . Jei iki 100 g viso kiekio, įpilkite per daug bario chlorido, vipad 5,825 g apgulties. Nustatykite rūgščių masės dalis tam tikrame diapazone.
41. Anglies dioksidui praėjus per natrio hidroksidą, buvo atimta 13,7 g vidutinių rūgščių druskų sumos. Norint juos paversti natrio chloridu, reikia 75 g druskos rūgšties, kurios masės dalis yra 10% HCl. Išsiaiškinkite molio anglies dioksido tūrį.
42. Sumišo druskos ir sieros rūgštys karšta masė 600 g diapazonas su tomis pačiomis masės rūgščių frakcijomis buvo apdorotas natrio bikarbonato pertekliumi ir pašalinta 32,1 dm 3 dujų (n.a.). Raskite rūgščių masės dalis bendroje sumoje.
43. 1 dm 3 neutralizavimui NaOH kiekis nudažytas 66,66 cm 3 HNO 3 reikšme, kurios masės dalis 63 % ir 1,5 g/cm 3 . Kokio tūrio sieros rūgšties, kurios masės dalis yra 24,5%, o storis 1,2 g / cm 3, reikėjo norint neutralizuoti tokį patį kiekį pievos?
44. Tam tikram tūriniam santykiui paimkite sieros rūgšties diapazonus, kurių masės dalis yra 5% ir 1,03 g / cm 3, ir bario hidroksido diapazoną, kurio masės dalis yra 5% ir 1,1 g / cm 3 bendram neutraliam izatsii? Vіdpovіd failą kaip privatų vіd rozpodіl rozdіl rozchiny pieva ant rozchin rūgšties.
45. Apskaičiuokite minimalų amoniako tūrį, kurio kiekis yra 0,9 g / cm 3 ir masės dalis 25%, kuris būtinas norint visiškai išvalyti anglies dioksidą, kuris buvo pašalintas klojant 0,5 kg natūralių garų, kurių masės dalis kalcio karbonato, kuris yra geras 92 %.
46. Norint visiškai paversti 2,92 g bendro natrio hidroksido ir natrio karbonato į chloridą, reikia 1,344 dm 3 chloro vandens (n.o.). Raskite natrio karbonato masę sumis.
47. Iki 25 g sulfato midi (II), kurio masės dalis yra 16%. Nusistovėjusi apgultis buvo filtruojama, po to filtratas sukėlė reakcijos balą. Norint visiškai neutralizuoti, filtratui reikia 25 cm3 sieros rūgšties, kurios molinė koncentracija yra 0,1 mol/dm3. Apskaičiuokite nurodyto natrio hidroksido kiekio masę.
48. Rechovinas, kuris buvo atkirstas pridedant 15,8 g CuO, kurio vandens tūris buvo 11,2 dm 3 (n.s.), buvo suremontuotas kaitinant koncentruotoje sieros rūgštyje. Kokias dujas (n.s.) matėte po reakcijos?
49. Visiškai neutralizuoti 50 cm 3 druskos rūgšties, kurios masės dalis yra 20% HCl, ir 1,10 g / cm 3 skaidraus kalio hidroksido, kurio masės dalis KOH yra 20%. Kokia yra kilkіst vіd mіstsya chemija otrimanomu razchinі?
50. Dujos, otrimany, kai CO 2 perteklius praleidžiamas per 0,84 g kepto vogulo, reakcijos nuo 14,0 g pakaitinto midi (II) oksido nurodymai. Koks azoto rūgšties tūris, kurio masės dalis yra 63%, o kiekis 1,4 g / cm 3, reikalingas visam azoto rūgšties atskyrimui likusioje kalbos reakcijoje?
51. Skrudinant iki liesos midinitrato masės (II), druskos masė pakito 6,5 g.
52. Kai ant aliuminio su nežinomu vienavalenčiu metalu sumos buvo druskos rūgšties perteklius, dujose buvo matyti 6,72 dm 3 (n.o.), sumos masė pasikeitė du kartus. Tiriant praskiestos azoto rūgšties pertekliumi, nustatyta 0,373 dm3 (N.O.) NO. Rinkitės ne-domy metalą.
53. Grietinės svoris 105 g, o rūgščiojo elemento cheminis kiekis sandėlyje 1 mol. Naudokite CaCO 3 masės dalį prie lopšio krašto (mažiau tikėtina, kad kisenas pateks į kalcio karbonato sandėlį).
54. Sieros oksido (VI) sąveikoje su vandeniu skirtumas gautas iš sieros rūgšties masės dalies 25%. Pridedant prie pertekliaus (OH) 2, nusodinus apgultį, kurios masė 29,13 g.
55. Praleidus SO 2 per 200 g skirtumo su 16% NaOH masės dalimi, ištirpo suma druskų, įskaitant 41,6 g rūgšties druskos. Yaka masa s_rki, scho, kad atkeršytų už 4,5% namo su masa, buvo pergalė pašalinus SO 2? Kokia vidutinės druskos masė?
56. Mainais už 80 g Ca(NO 3) 2 reikėjo 50 g Na 2 CO 3. Apgultis, kuri buvo nušluota, buvo pašalinta, o perdirbant per daug druskos rūgšties dujose buvo matyti 2,24 dm 3 (n.o.). Kokios yra druskų masės dalys skirtinguose regionuose? Kokia yra natrio nitrato masės dalis po apgulties?
57. Cinkui sąveikaujant su sieros rūgštimi, bendrame SO 2 ir H 2 S ištirpo 10 dm 3 (n.o.), kurių argono talpa 1,51. Yaku khіmіchnu kіlkіst cinkas suremontuotas? Kokia yra SO 2 masės dalis visose dujose?
58. Zrazok sumishi cinko ir aliuminio tirsis su 11 g masės remontuotas virš pievos. Vznachte obsyag (n.o.) dujos, kaip matyti, kaip cinko masės dalis, sumoje 30%.
59. 4,0 g natrio hidroksido sulydoma su 9,8 g aliuminio hidroksidu.
60. Apdorojant 10 g sumish midi ir aliuminio koncentruota azoto rūgštimi, kambario temperatūroje buvo matyti 2,24 dm 3 dujų (n.o.). Kokios obsyag (n.s.) dujos matomos apdorojant tokią masę, sumaišant per daug KOH?
61. Pievoje apdirbtas midi ir aliuminio lydinys, kurio masė 20 g, perteklius, neatskiriant, suremontuotas koncentruotoje azoto rūgštyje. Otrimanu matėsi tokio pat stiprumo, iškepęs iki liesos masės ir nuimtas 8 g kieto pertekliaus. Nustatykite dažyto NaOH tūrį, kurio masės dalis yra 40%, o storis 1,4 g / cm 3).
62. Aliuminio ir metalo oksido (II) (oksidas nėra amfoterinis) suma, kurios masė 39 g, susidarė per daug KOH, dujos, kurias matė, sudegino ir paėmė 27 g vandens. Neišspręstas perteklius buvo iš dalies suremontuotas 25,2 cm 3, kai HC1 masės dalis buvo 36,5% ir storis 1,19 g / cm 3). Vyznachte oksidas.
63. Cinko ir midi drožlių suma pagamino per daug KOH, todėl buvo matyti 2,24 dm 3 (n.o.) tūrio dujos. Norint visiškai chloruoti tokį metalą, reikia 8,96 dm 3 (n.u.) tūrio chloro. Razrahuyte masės dalis cinko ir zrazku.
64. Sumišo tizio, aliuminio ir magnio masė 49 g buvo apdorota per daug praskiestu H 2 SO 4, išskiriant 1,95 mol dujų. Antroji porcija tієї ir sumіshi, kurių masė 4,9 g, buvo auginami su per dideliu kiekiu pievos, jie paėmė 1,68 dm 3 (n.o.) dujų. Iš sumos sužinokite metalų mases.
65. Kaip gali nusistovėti apgultis išpylus, ką daryti su 10 g NaOH ir 13,6 g ZnCl 2?
66. Dvi identiškos porcijos pagal molinę sandėlio sumą Al, Mg, Fe, Zn, odos svoris 7,4 g. vandenilio chlorido rūgštis jie paėmė 3,584 dm 3 dujų (nr.), o kitoje - prie atskiros pievos paėmė 2,016 dm 3 dujų (nr.). Matyt, prie abiejų sumų su vienu A1 atomu pridedami 3 Zn atomai. Iš sumos sužinokite metalų mases.
67. Sumish midi, magnio ir aliuminio masė 1 g buvo apdorota per daug druskos rūgšties. Tirpalas filtruojamas ir į filtratą buvo pridėta per daug NaOH. Otrymani apgultis buvo kremuota ir iškepta iki liesos masės, kuri kainavo 0,2 g. Iš sumos raskite aliuminio masės dalį.
68. Kaitinant rūgšties purškime iki cinko, magnio ir midi lydinio, sumos svoris išaugo 9,6 g.3 . Reakcijai su ta pačia metalo dalimi reikia 0,7 mol HC1. Išsiaiškinkite metalų cheminį kiekį lydinyje.
69. Midi lydinys su cinku, masė 5 g, buvo perdozuotas NaOH. Tada kietas perteklius buvo kremuotas ir apdorotas koncentruotu HNO 3 otrimanu tokiu pat stiprumu, koks buvo matomas, kepti iki liesos masės ir pašalinta 2,5 g kieto pertekliaus. Apsvarstykite metalų masę lydinyje.
70. Midi ir aliuminio lydinys, kurio masė 12,8 g, buvo apdorotas druskos rūgšties pertekliumi. Perteklius, kuris nebuvo atskirtas, buvo konservuotas koncentruotoje azoto rūgštyje, pašalintas skalavimas išgarinamas, sausas perteklius pakepinamas iki liesos masės ir pašalinta 4 g kietos kalbos. Lydinio masės dalį pažymėkite midi.
71. Kuriam spіvvіdnіnіnі maslіd paimti dvi porcijas A1, schobіnіnіnі vіdnіnі іїї iki rozschin pievos, o іnshої – į vandenilio chlorido rūgštį pjauti vienodus kiekius?
72. Apdorojant aliuminio ir midi(II) oksido sumą, KOH perteklius buvo 6,72 dm 3 (n.o.) dujų, o paėmus tą pačią koncentruoto HNO 3 sumos dalį kambario temperatūroje, 75,2 buvo nuimta g druskos. Žinoti daugybę išorinių suminių kalbų.
73. Kiek midi(II) oksido masės galima pakeisti vandeniu, galime pašalinti, sumaišius su aliuminio pertekliumi, 139,87 cm 3 skirtumą, kai NaOH masės dalis yra 40% ir storis 1,43 g / cm 3?
74. Visiškai oksidavus 7,83 g dviejų metalų metalo, ištirpo 14,23 g oksidų, įdirbant tokią perteklinę pievą, liko neištirpusi 4,03 g apgulties. Pasirinkite metalo sandėlį, kuriame gaminamas lydinys, nes jų katijonų oksidacijos lygis gali būti +2 ir +3, o oksidų molinis santykis yra 1:1 (atkreipkite dėmesį, kad metalo oksido oksidacijos lygis yra +3, amfoterinis galios lygis).
75. Sutaisytos dvi aliuminio porcijos, kurių masė gali būti vienoda: viena skirta kalio hidroksidui, kita – druskos rūgštis. Kaip matote aplink esančias dujas, ką matėte (n.s.)?
76. Midi lydinys su aliuminio svoriu 1000 g pervargė pievą; Naujo pertekliaus svoris 0,398 g.Koks metalų svoris lydinyje?
77. Cinko ir midi lydinys, kurio masė 20 g, buvo perdozuota NaOH, kurio masės dalis 30 %, o storis 1,33 g/cm 3 . Buvo matyti solidus perteklius ir buvo pervargta koncentruotas HNO3. Su tsoma pasislėpusi jėga buvo pamatyta ir iškepta iki liesos masės. Kietojo pertekliaus masė sulankstyta 10.016 rub. Apskaičiuokite metalų masės dalis lydiniuose ir pievos beicavimo tūrius.
78. Midi ir aliuminio lydinys, kurio svoris 2 g, pervargė pievą. Perteklius filtruojamas, nuplaunamas, supjaustomas į HNO, 3 gabalai išvirti ir kepti iki liesos masės. Perteklinis svoris po skrudinimo buvo 0,736 g.
79. Chloro maudymosi sumish fiziologiniam tirpalui, midi ir aliuminiui reikia 8,96 dm 3 chloro (n.o.), o tokiam deriniui su chloruotu vandeniu - 5,6 dm 3 (n.o.). Tokios metalų sumos masės sąveikoje pievoje matosi 1,68 dm 3 (n.o.) dujų. Išsiaiškinkite cheminį metalų kiekį sumoje.
80. Kalio hidridas, kurio masė 5,0 g, buvo disperguotas 80 cm 3 tūrio vandenyje, o aliuminis, kurio masė 0,81 g, buvo pridėtas prie netolydybių atėmimo.
NUORODOS
1. Bararannik, V.P. Šiuolaikinė rusų neorganinių laukų nomenklatūra / V.P. Barannik // Visos Sąjungos chemijos partnerystės žurnalas, pavadintas. D.I. Mendelevas. - 1983. - T. XXVIII. – P. 9–16.
2. Vrublevskis, A.I. Chemija / O.I. Vrublovskis. - 2-asis vaizdas, kun. kad dod. - Minskas: Krasiko-Print, 2007. - 624 p.
3. Glinka, N.L. Biuro vadovas teisus chemijos srityje: Navčas. vadovas universitetams / Raudonam. V.A. Rabinovičius ir Kh.M. Rubina. - M.: Integral-Pres, 2004. - 240 p.
4. Lidinas, R.A. Pareigūno vadovas neorganinė chemija: navch. vadovas aukštųjų mokyklų studentams. navch. hipoteka/R.A. Lidinas, V.A. Pienas, L.L. Andreeva; už raudoną. R.A. Lidina. - M.: VLADOS, 2004. - 383 p.
5. Lidinas, R.A. Neorganinės kalbos nomenklatūros pagrindai / R.A. Lіdin [kad іn]; už raudoną. B.D. Įsikišti. - M.: Khimiya, 1983. - 112 p.
6. Stepinas, B.D. Zastosuvannya IUPAK taisyklės dėl neorganinių spolukų nomenklatūros rusų kalba / B.D. Stepinas, R.A. Lіdin // Visos Sąjungos chemijos partnerystės žurnalas, pavadintas vardu. D.I. Mendelevas. - 1983. - T. XXVIII. – P. 17–20.
| Įėjimas …………………………………………………………………… Pasaulinės taisyklės neorganinių kalbų nomenklatūra………….. Oksidai ………………………………………………………………… Baziniai oksidai ………………………………… …… …………………... Rūgščių oksidai …………………………………………………………. Amfoteriniai oksidai …………………………………………………….. Oksidų sulaikymas ……………………………………………………… Tinka savarankiškas darbas tema „Oksidas“ ………………………………………………………. Rūgštys………………………………………………………………. Teisė savarankiškam darbui tema „Rūgštis“ ………………………………………………………………………………………………………… ……… ……….. Teisė į savarankišką darbą tema „Pateikti“ ………………………………………………………. Druska ………………………………………………………………………. Teisė savarankiškam darbui tema „Druska“ ………………………………………………………………………………………………………… ……………………………………………… …… …………….. Teisė į savarankišką darbą tema „Genetinis ryšys tarp neorganinių rūšių klasių“ ……………… …………………………………………………….. Rosrachunkovskio užduotis ……………………………………………………………… ……………………………………………………………………………………………………… |
Tema: GENETINIS MIZH RYŠYS su metalais ir nemetalais bei su jais. 9 klasė
Tsіlі: ilіvіnі: zakrіpiti vypitetya "genetinės serijos", "genetinės zv'azok"; išmokti sumuoti genetines elementų serijas (metalų ir nemetalų), suvesti lygias reakcijas, atitinkančias genetinę eilutę; supainioti, kaip įgyjamos žinios apie cheminė galia oksidai, rūgštys, druskos, bazės; plėtoti: sukurti vminnya analizuvati, porіvnyuvati, zagalnyuvati ir robiti visnovki, sulenkite lygus cheminės reakcijos; vikhovnі: priimti mokslinės svetoglyad formavimą.
Darbo sauga: lentelės "Periodinė sistema", "Ražolių lentelė", "Metalų veiklos serija", instrukcijos studentams, žinių patikrinimo užduotis.
Darbo vadovas: 1) Org. momentas
2) Pakartotinis d / s patikrinimas
3) Naujos medžiagos įvedimas
4) Pataisyta
5) D/Z
1) Org. momentas. Vitanija.
2) Pakartotinis d / s patikrinimas.
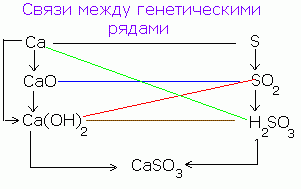
Genetiniai ryšiai – visi ryšiai tarp skirtingų klasių, kurie yra pagrįsti jų tarpusavio transformacijomis.
Žinant neorganinių kalbų klasę, galima sudaryti genetinę metalų ir nemetalų seriją. Šios eilutės yra pagrįstos vienu ir tuo pačiu elementu.
Tarp metalų galite pamatyti dvi skirtingas eilutes:
1 . Genetinė serija, kurios pagrindas yra pieva. Šią seriją galima įsivaizduoti tokių transformacijų pagalba:
metalas → bazinis oksidas → pieva → stiprus
Pavyzdžiui, K→K 2 O→KOH→KCl
2 . Genetinė serija, de jak neaiškaus pagrindo pagrindu, tą pačią seriją galima parodyti niūriai:
metalas → bazinis oksidas → stiprus → nesuiręs pagrindas →
→bazinis oksidas→metalas
Pavyzdžiui, Cu→CuO→CuCl 2 → Cu(OH) 2 →CuO→Cu
1 . Genetinė nemetalų serija, de jak lanka iki daugybės išsikišusių rūgščių. Lanzyzhok transformaciją galite įsivaizduoti tokiu būdu:
nemetalas → rūgšties oksidas → rožių rūgštis → stipri
Pavyzdžiui, P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
2 . Genetinė nemetalų serija, de jak lanka į netvirtų rūgščių seriją:
nemetalas → rūgštinis oksidas → stiprus → rūgštis →
→rūgštinis oksidas → nemetalas
Pavyzdžiui,Si→ SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Priekinis pokalbis su maistu:
Kas yra genetinis ryšys? Genetiniai saitai – visi ryšiai tarp skirtingų klasių, pagrįsti jų tarpusavio transformacijomis. Kas yra genetinė serija?
Genetinės serijos - kalbų serija - skirtingų klasių atstovai, kurie yra iš to paties cheminis elementas, pov'yazanih vzaemopertvorennymi kad vіdobrazhayut reinkarnacija šių kalbų. Šios eilutės yra pagrįstos vienu ir tuo pačiu elementu.
Kaip galite pamatyti genetines serijas? Tarp metalų galite pamatyti dvi skirtingas eilutes:
a) Genetinė serija, kurios pagrindas yra pieva. Šią seriją galima įsivaizduoti tokių transformacijų pagalba:
metalas → bazinis oksidas → pieva → sil
pavyzdžiui, kalio K → K genetinė serija 2 O → KOH → KCl
b) Genetinės serijos, de jak pagrindas yra neaiškios bazės, tada seriją galima parodyti niūriai:
metalas → bazinis oksidas → stiprus → neskaidomas pagrindas → bazinis oksidas → metalas
pavyzdžiui: Cu → CuO → CuCl 2 → Cu(OH) 2 → CuO → Cu
Tarp nemetalų taip pat galite pamatyti dvi skirtingas eilutes:
a) Genetinė nemetalų serija, de yak lanka išsikišusių rūgščių skaičius. Lancetą galima pakeisti įžeidžiančia išvaizda: nemetalas → rūgšties oksidas → rožinė rūgštis → stipri.
Pavyzdžiui: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetinė nemetalų serija, de yaklanka į netvirtos rūgšties seriją: nemetalas → rūgštinis oksidas → sil → rūgštis → rūgštinis oksidas → nemetalas
Pavyzdžiui: Si→ SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Vikonanny zavdan dėl parinkčių:
1. Pasirinkite savo oksidų formulės variantą, paaiškinkite savo pasirinkimą, remdamiesi spoluko klasės sandėlio ženklo žiniomis. Pavadinkite juos.
2. Savo pasirinktose formulėse raskite rūgščių formules ir, remdamiesi šių mėginių atsargų analize, paaiškinkite savo pasirinkimą.
3. Rūgščių nuosėdų valentiškumo reikšmė rūgščių saugykloje.
4. Pasirinkite druskų formules ir įvardykite jas.
5. Laikykite druskų formules, kurios gali būti prisotintos magnio ir jūsų pasirinktomis rūgštimis. Užsirašykite juos, pavadinkite juos.
6. Savo pasirinkimo formulių aprašyme raskite pastočių formules ir savo pasirinkimą paaiškinkite šių spolukų sandėlio analizės pagrindimu.
7. Savo pasirinkimu pasirinkite kalbų formules, su kuriomis galite reaguoti į ortofosforo rūgšties skirtumus (vandenilio chlorido, sieros). Išsaugokite gyvybingas reakcijas.
9. Tarp savo varianto formulių įvyniokite kalbų formules, tarpusavyje statydami tarpusavyje. Išsaugokite gyvybingas reakcijas.
10. Sulenkite neorganinių klosčių genetinių grandžių žibintus į savotiškos kalbos sandėlį, kurios formulė jūsų pasirinkime sukelta pirmuoju numeriu.
1 variantas
2 variantas
CaO
HNO 3
Fe(OH) 3
N 2 O
Zn(NO 3 ) 2
Cr(OH) 3
H 2 TAIP 3
H 2 S
PbO
LiOH
Ag 3 PO 4
P 2 O 5
NaOH
ZnO
CO 2
BaCl 2
HCl
H 2 CO 3
H 2 TAIP 4
CuSO 4
Iš kalbų rinkinio saugoti genetinę seriją, vikoristovuyuchi visas formules. Parašykite vienodas reakcijas, kurių pagalba galite sukurti šį lanceto vertimą:
I variantas: ZnSO 4, Zn, ZnO, Zn, Zn(OH) 2 : IIvariantas:Na 2 TAIP 4, NaOH, Na, Na 2 O 2 , Na 2 O
4) Fiksuotas1.Al→ Al 2 O 3 → AlCl 3 → Al( Oi) 3 → Al 2 O 3
2. P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 2
3. Zn→ZnCl 2 →Zn(OH) 2 →ZnO→Zn(NO 3 ) 2
4.Cu→CuO→CuCl 2 → Cu(OH) 2 →CuO→Cu
5.N 2 O 5 → HNO 3 →Fe (NO) 3 ) 2 →Fe(OH) 2 →FeS→FeSO 4
5)Namų darbai: sulankstykite laipsniško perėjimo nuo kalcio prie kalcio karbonato schemą ir paruoškite informaciją apie Viktoriją medicinoje, ar tai būtų druska (vikoristinė papildoma literatūra).

Tarp metalų matomos dvi skirtingos eilės: 1. Genetinė eilutė, kurios pagrindas yra pieva. Šią seriją galima įsivaizduoti būsimų transformacijų pagalba: metalas - bazinis oksidas - pieva - stiprumas, pavyzdžiui, kalio K - K 2 O - KOH - KCl genetinė serija.

2. Genetinė serija, de jak pagrindas yra neryškus pagrindas, ta pati serija gali reikštis niekšiškai: metalas - bazinis oksidas - stiprumas - neryškus pagrindas - bazinis oksidas - metalas. Cu – CuO – CuCl 2 – Cu(OH) 2 – CuO –> Cu genetinės serijos midi "> Cu genetinė serija midi"> " title="2. Genetinė serija, kadangi pagrindas išsikišęs neapibrėžtu pagrindu, tai serija gali būti rodoma lansine transformacija: metalas - bazinis oksidas - stiprus - neapibrėžta bazė - pagrindinis metalo oksidas Cu - CuO - CuCl 2 - Cu(OH) 2 - CuO ->"> title="2. Genetinė serija, de jak pagrindas yra neryškus pagrindas, ta pati serija gali reikštis niekšiškai: metalas - bazinis oksidas - stiprumas - neryškus pagrindas - bazinis oksidas - metalas. Cu-- CuO-- CuCl 2 -- Cu(OH) 2 – CuO -->"> !}!}
Viduriniai nemetalai taip pat gali būti matomi dviem skirtingomis eilėmis: 1. Genetinė nemetalų eilė, de yak lanka į eilę, atsiranda pūva rūgštis. Lanceto transformaciją galima pateikti įžeidžiančia išvaizda: nemetalas – rūgštus oksidas – rausva rūgštis – stipri. P-- P 2 O 5 -- H 3 PO 4 -- Na 3 PO 4. fosforo genetinė serija

