Fizinės ir cheminės pasaulio galios. Sirka tse
Elektronų išsidėstymas ant išorinės sferos orbitų
Prie atomo yra 6 valentiniai elektronai, todėl SIERA gali sudaryti iki 6 valentinių ryšių. Sirkos atomas turi didesnį spindulį, todėl jis rodo mažesnį elektronegatyvumą, palyginti su rūgštu. Oksidacijos etapai, kuriuos galima pastebėti oksidacinėse-oksidacinėse reakcijose: S 0 , S -2 , S +4 , S +6 .
■ 68. Parašykite lygias sirkos reakcijas paprastomis kalbomis apie tai, kaip skaityti eilutę, Kokios yra oksido-vandens reakcijos? Duok man užuominą.
69. Koks sieros oksidacijos laipsnis laukuose su vandeniu ir metalais?
70. Kokio tipo z'ednannyah turi sirkus su metalais?
71. Kodėl cinko ir aliuminio negali paimti mainų reakcija intervaluose?
72. Kiek druskos (II) sulfido sunaudojama, jei imama 30 g druskos ir 16 g sirkos mažiau nei 90%?
Galimos kitos reakcijos, po kurių kai kurios iš jų padidina teigiamus oksidacijos etapus. Garsas tse bovaє tarpiniam sirkos ir rūgščio sąveikai - prie sirkos kalno:
S + O2 = SO2
Oskilki rūgštyje elektronegatyvumo reikšmė didesnė, sirka mažesnė, SO2 sirkos atveju rodo oksidacijos lygį +4 ir šioje reakcijoje esame kaip vedlys. Daugiau deguonies prisotinto vandens iki +6 oksidacijos lygio galima su patvirtintu sieros anhidridu. Esant katalizatoriui 400–500 ° temperatūroje, sieros dioksidas oksiduojamas rūgštimi, gesinant anhidridą:
2SO2 + O2 = 2SO3
Nepriklausomai nuo didelio cheminio aktyvumo, sirka yra plačiai sulaikoma atrodančio mineralo, kuris vadinamas vietine sirka. Tse mayzhe yra išskirtinai rombinė sirka. Kitos alotropinės sirkos rūšys gamtoje nėra paplitusios.
Sirka skamba įsiterpusi į įvairias kalnų uolas, nuo kurių lengvai išsilydo. dažniausiai vulkaninės kelionės. Bagatі ant Samorodnu sіrka Kavkaz, Kara-Kum dykumos, Kerčės Pivostrіv, Uzbekistanas.
Juostelė pastebima ir gryniausiuose metaluose g-sulfiduose (FeS2, cinko mišinyje ZnS, švino blisk PbS), esant sulfatams (Glauberio stiprumas Na2SO4 10H2O, CaSO4 2H2O). Sirka įeiti į deyakyh bіlkіv sandėlį. Norint išgauti sirku iš veislės, її ištirpsta autoklavuose. Diya perkaitinti vandens garai 150-160 °. Otriman išlydyta sirka rafinuojama (išgryninama) sublimacijos būdu. Yakscho її ištirpsta ir pilama ant medinių formelių, žiūrint pagaliukus atrodo kietesnis. Tokia sirka vadinama petiolate.
Mal. 52. Liga
Kartais jie vinguriuoja puikios formos, o paskui sukietėja į gabalus. Tokia sirka vadinama gumbuota. Nareshti, jūs galite paimti sirką iš pjautinių pjautinių miltelių - vadinamosios sirchan spalvos.
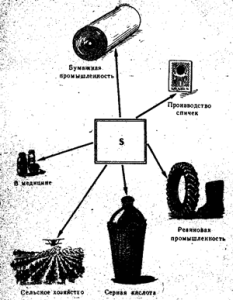
„Vilna sirka zastosovuetsya“ užima pirmaujančią vietą sieros rūgšties gamyboje, taip pat popieriaus pramonėje, gumos vulkanizavimui, barvnikų gamyboje, į kaimo valstybę vynuogėms ir bavovnik pjauti ir fumiguoti, sirnikiv skinti (52 pav.). Medicinoje sirka laimi žvelgdama į tepalus kartu su kitomis kalbomis prieš greitį ir kitas odos ligas. Gryna sirka nėra šiukšlinė.
■ 73. Nepaisyti Cheminė galia Aš jums pasakysiu, kodėl jis panašus ir kodėl skirtumas yra rūgštus ir rūgštus.
57 skyrius
Dvivalentė sirka pasisotina vandeniu (H2S) ir metalais (Na2S, FeS). Sulfidas gali būti vertinamas kaip gera diena, kaip ir dienos rūgšties druskos.
Aplinkplaukimas. Cirkuliuojanti vandens molekulė buvo įkvėpta polinio ryšio tipo:
Reikšmingas elektroninis paritetas yra stipriai pakreiptas ant antrojo atomo, kuris yra elektronegatyvus.
Sirkovoden-dujos yra svarbios pasikartojimui, turinčios aštrų, nepriimtiną supuvusių kiaušinių kvapą. Tsey dujos jau susprogdintos. Mūsų kvapo organai yra jautresni sirkovodnyu. Kad ateityje būtų 1/2000 sirkovodnyu dalies, gali tekti eikvoti savo kvapą. Dėl lėtinių kraujotakos sutrikimų mažomis dozėmis krenta svoris, skauda galvą. Turėkite daugiau laiko stiprios sėlenos po tam tikros valandos gali ateiti neramumas, o dar stipresnis susikaupimas iššaukia mirtį dėl kvėpavimo paralyžiaus. Esant kraujotakos sutrikimams, reikia kaltinti gaivaus vėjo vaidmenį ir duoti jam nedidelį kiekį chloro, taip pat gryno chloro. Didžiausia leistina cirkuliuojančio vandens koncentracija darbo aplinkoje yra 0,01 mg/l.
Aplinkplaukimas virsta reta stovykla –60° temperatūroje. Vіn geras skiriasi vandeniu, utvoryuyuchi su tsіmu sіrkovodnuyu vandeniu H2Saq arba, kaip її vis dar vadina, іїї sіrkovіvu rūgštimi.
Aplinkplaukimas yra vienas geriausių šaltinių. Vin lengvai paverčia bromo ir chloro vandenį į bromo vandenį arba druskos rūgštį:
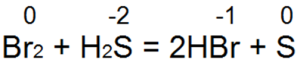
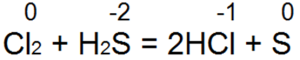
Šioje reakcijoje S(-2) oksiduojamas į neutralų S(0).
Aplinkybės liepsnoja. Turint pakankamai prieigos, pasikartojimai (53a pav.) matomi už ugnies lygūs:
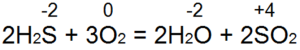
Tokiu būdu S(-2) oksiduojamas iki S(+4), atiduodami 6 elektronai, o s O(0) – į O(-2). Yakscho
Prieigos kartais neužtenka, o kitu atveju pusę dienos vidurnakčio atnešti šaltą daiktą (53.6 pav.), reikia perdegti už lygius:
2H2S + O2 = 2S + 2H2O
■ 74. Sutrikus kraujotakai, kviesti pirmąją pagalbą.
75. Kodėl dažnai vadinama sirkovodny rūgštis
dienos vanduo?
76. Kai jodinis vanduo bus netinkamai padėtas nuo šviesiojo paros valandos, atsiras tas drumstumas. Kam aiškinti?
77. Ką S(-2) gali parodyti oksido galias?
Laboratorijoje kraujotakos diena imama Kippa aparatu, sąveikaujant su druskos sulfidu (arba natrio sulfidu) ir praskiesta sieros rūgštimi:
FeS + H2SO4 = FeSO4 + H2S

Mal. 53. Kalnų karštas vanduo su pakartotiniu priėjimu (a) ir vėl ne visiškai (b).
Plaukiant aplinkui, kylant vandeniu, susidaro silpna kraujotakos rūgštis, kuri disocijuoja dviem etapais:
H2S ⇄ H + + HS - ⇄ 2H + + S 2-
Dar vienas žingsnis teka per nereikšmingą pasaulį.
Sieros rūgšties laboratorijoje ilgą laiką negalima išsaugoti dėl jos nestabilumo. Vaughn žingsnis po žingsnio kalamutnіє pamatęs vilnoї serką:
H2S=H2+S
Oksidacinėse-oksidacinėse reakcijose sulfonrūgštis naudojama kaip tipinis vadovas, pavyzdžiui:
H2S + K2Cr2O7 + H2SO4 → (S 0; Cr +3)
Nepriklausomai užbaikite oksidacijos-oksidacijos reakcijos išlyginimą.
Analitinėje chemijoje navigacija aplinkui sustingusi.
sirkovodny rūgštis rodo Aukšta įtampa rūgštys. Tiesa, apskritai rūgščių galia yra privaloma jo saugotis. Pvz., taip, jakai, nereaguok su juo, o aš, gerdamas į diuro rūgštį, reaguoju ne su ja, o su ten esančiu vandeniu, užpildančiu pievą, tai tada mes galime pradėti reakciją su diuro rūgštimi. Kadangi tai yra dvibazinė rūgštis, ji gali sudaryti dvi druskų serijas - sulfidą ir hidrosulfidą arba bisulfidą.
Vidurinės sieros rūgšties druskos yra sulfidinės – netirpios vandenyje, natrio ir kalio krimtosios druskos ir gali būti skirtingos: švino sulfidas ir druska – juodos, cinko – baltos, kadmis – geltonos. Hidrosulfidus gerai skiria vanduo.
Reagentas dvivalenčiam jonui S 2 є kadmio jonui Cd 2+, kuris, esant jonui, suteikia zhovty, nesiskiriantį nuo apgulties vandens, pavyzdžiui:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd 2+ + S 2- = CdS
Sulfidai lengvai hidrolizuojasi į silpnų rūgščių druskas, todėl išsiskiria tiesiogine sieros sąveika su metalu.
■ 78. Parašykite diuro rūgšties reakcijos su kaustine soda lygtį ir paaiškinkite reakcijos į druskos hidrolizę diapazone rezultatą.
79. Ekspozicijos sanitarinėmis ir higieninėmis sąlygomis Apytakinio vandens pasaulyje švinas jau susitraukė dėl jautrios rozchinnimi druskų reakcijos. Ko galima apsisaugoti šios reakcijos atveju šiuolaikinėje joninėje ir trumpojoje joninėje formoje?
§ 58
Z'ednannya chotirivalent ї s_rka - s_rka dioksidas (sirchisty dujos) SO2. Sirkos dioksidas yra svarbus pasikartojimui ir gali turėti aštrų, nepriimtiną kvapą. Sirka dioksido molekulę taip pat sukelia kovalentinis ryšys, її poliškumas yra silpnai ryškus. Esant -10° ir atmosferos slėgiui dioksidas pasisuka į tėvynę, o kietesnis -73°. Vaughn gerai valdo vandenį (1 tūriui vandens 40 tūrių sieros dioksido), šia tvarka santykis su vandeniu yra lygus:
SO2 + H2O H2SO3
Sieros rūgštis, kuri išeina, jau yra vokiška, todėl reakcija yra atvirkštinė.
Dvookis sіrka gali turėti didelę reikšmę. Її naudokite vipal su sirchan piritu FeS2 arba sirki:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 S + O2 = SO2
Laboratorijoje paimkite stiprių rūgščių dozę nuo sieros rūgšties druskos, pavyzdžiui, sieros rūgšties dozę:
Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2
Sieros dioksidas gali būti pašalintas iš sieros rūgšties druskų, pavyzdžiui, kalcio sulfito CaSO3, paskirstymo kaitinant;
CaSO3 = CaO + SO2
Dioksidas sirki otruyna. Kai jis sugenda, jis sukelia užkimimą, užpakalį, o kartais ir informacijos praradimą. Leidžiama SO2 koncentracija ore – 0,02 mg/l.
Sąveikos su organinėmis svirnelėmis atveju sieros dioksidas gali sukelti sukepinimą, apsaugoti šio kito priežastį, mažesnis apsinuodijus chloru: nevyksta oksidacija, bet dėl to, kad nėra SO2 inkorporacijos su tvartu, jakas su laiku suyra. ir barvnikos nevaisingumas atstatomas.
■ 80. Pasiūlykite kėdes su priedais, kurių pagalba galite išimti sieros dioksidą: a) iš natrio sulfito di rūgšties: b) skrudinti kalcio sulfitą.
81. Sirkos dioksidas, paimtas iš 40 g kalcio sulfito, buvo perleistas per 500 g barito vandens (OH) 2, ko pasekoje viskas, kas buvo roznі, buv mokesčiai. Kiek sunaudojama barito vandens, pvz., 20% sieros dioksido, pašalinto garinant?
82. Iki kokios oksidų grupės turėtų būti sieros dioksidas? Išvardykite oksidų grupių dominavimą, tipus. Patvirtinkite įrodymus vienodomis reakcijomis.
83. Kas sukelia drumstumą, kai CO2 praleidžiamas per garų vandenį, pvz., kai CO2 praeina?
84 Kaip jūs vadinate jogą iš savo namų?
85. Kokį anglies dioksido kiekį galima paimti iš 20 molių FeS2 esant 80% išeigai?
86. Po 200 ml 20 % natrio hidroksido tirpalo perleidžiamas sieros dioksidas iki visiško natrio hidroksido pavertimo sulfitu (hidrolizė neturi būti sunaikinta). Kokia natrio sulfito koncentracija, ką pataisėte?
Tačiau jungtyje sieros oksidacijos lygis sieros diokside yra didesnis nei + 4, todėl iš to paties sirkos atomo lygio mintyse duodami 4 elektronai, naujajam yra dvi galimybės: arba galite pridėti 2 elektroniką, kuri buvo palikta išorinėje sferoje, ir t
lyderio galia arba S(+4) gali užimti elektronų skaičių ir parodys oksidacinę galią.
Pavyzdžiui, stipraus oksidatoriaus S(+4) buvimas veikia kaip orientyras.
Br2 + H2O + SO2 → H2SO4 + HBr
KMnO4 + H2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
Savarankiškai žinoti šių reakcijų koeficientus.
V2O5 katalizatoriaus arba Pt buvimas 400–500 ° temperatūroje yra ypač svarbus sieros dioksido oksidacijai, po kurio anhidridas ištirpsta:
2SO2 + O2 = 2SO3
Šis procesas yra plačiai paplitęs sieros rūgšties gamyboje ir kontaktiniu būdu.
Esant stipriam vėjui, pavyzdžiui, šiltas vanduo, S (+4) turi būti traktuojamas kaip oksidatorius: H2SO3 + H2S → H2O + S
Sužinokite, pridėję elektroninį balansą, išlyginimo koeficientus.
■ 87. Užrašykite sieros dioksido fizikinę ir cheminę galią, nurodydami, kaip vyksta reakcija nekeičiant oksidacijos etapų, taigi tai yra oksidas-vanduo.
88. Koks yra sirka dioksido fiziologinis poveikis?
Kaip buvo sakoma, kai sieros dioksidas yra ištirpęs geriamajame vandenyje, sieros rūgštis ištirpsta.
Sieros rūgštis yra vidutinio stiprumo rūgštis. Disociacija vyksta dviem etapais:
H2SO3 ⇄ 2 H + + HSO 3 - ⇄ 2H + + SO 2 3 -
Sieros rūgštis nedažo, greitai plinta į sieros dioksidą ir vandenį:
H2SO3 ⇄ H2O + SO2
Todėl neįmanoma atlikti, pavyzdžiui, reakcijos su aktyvesniais metalais, mažesniais su sieros rūgštimi.
Būdama dvibazinė sieros rūgštis gali sudaryti dvi druskų serijas: vidurinę – sulfitinę ir rūgštinę – hidrosulfitą. Visi sulfitai yra netirpios druskos, su trupučiu metalų ir amonio sulfito. Hidrosulfitų turi mažiau. Qi druskos gali būti sulankstytos veikiant stiprioms rūgštims:
Na2SOs + H2S04 = Na2SO4 + H2O + SO2
2NaHSO3 + H2SO = Na2SO4 + 2H2O + 2SO2
Esant praskiestoms rūgštims, ant sulfito matomas sieros dioksidas, kuris gali turėti nepriimtiną kvapą. Ši reakcija yra ėsdinanti, siekiant nušveisti sieros rūgšties stiprumą esant karbonatams, kaip tai turėtų būti daroma panašiai, tačiau anglies dioksidas nekvepia.
Sulfitai lengvai hidrolizuojasi.
§ 59
Kaip buvo spėjama, oksiduojant sieros dioksidui, ištirpsta anhidridas SO3 – susidaro šešiavalenė siera. Apšviečiant sieros anhidrido molekulę apšviečiant valentinius ryšius, dalyvauja sirkos valentinių elektronų vaidmuo, kaip s- taigi aš R- orbitos. Oksidacijos stadija +6 maksimaliai teigiamai sirkai. Tom S + 6 negali būti traktuojamas kaip pasiuntinys.
Sirchaniy anhidridas – balto kristalo kalba. Lydymosi temperatūra yra 17 °, virimo temperatūra yra 45 °. Sirchany anhidridas yra higroskopiškas, todėl jogos nuo puikaus patiekalo išgelbėti neįmanoma. Jogas imamas iš sandarių stiklinių ampulių.
Sirchaniy anhidridas yra rūgšties oksidas, kuris kalbų grupėje gali turėti visų tipų galią. Zokrema, vin gali reaguoti su vandeniu, gesinant sieros rūgštį:
SO3 + H2O = H2SO4
■ 89. Parašykite nepriklausomai lygias sieros anhidrido reakcijas su bazėmis ir baziniais oksidais.
Sirchany anhidridas yra stiprus oksidatorius. Svarbiausias šešiavalenčios sieros panaudojimas yra H2SO4. Vaughn atsigulė į stiprias rūgštis. dvigubas ir disociatyvus dviejų etapų dažnai:
H2SO4 ⇄ H + + HSO 4 - ⇄ 2H + + SO 2 4 -

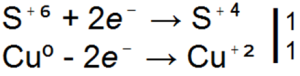
Koncentruota sieros rūgštis reaguoja su metalais, aktyviosiomis medžiagomis, žemesniu vandeniu, kitu atveju mažesniu atskiestu. pavyzdžiui, su koncentruota sieros rūgštimi ji nerūgsta vandens, bet paverčia sieros rūgštimi iki sieros dioksido, laisvos sieros arba sieros vandens:
H2SO4 + Zn → ZnSO4 + SO2
H2SO4 + Zn → ZnSO4 + S
H2SO4 + Zn → ZnSO4 + H2S
■ 91. Visos trys sieros rūgšties reakcijų su cinku indukcijos yra oksidacinės-oksidacinės. Rozstavte jų koeficientus elektroninio balanso gerinimui.
Bevandenė sieros rūgštis vadinama monohidratu. Monohidratas nekeršija jonams ir todėl nelaidžia elektros srovės. Monohidratas yra naudingas vologeriui. Sodrios sieros rūgšties reakcijos su joniniais metalais šukės, monohidratas su kitais metalais nereaguoja, aktyvus, mažai vandens, pvz., nuo potvynio, todėl gali būti gabenamas šaltuose rezervuaruose. , stabilus bet kokios koncentracijos sieros rūgščiai. Pavyzdžiui, koncentruota sieros rūgšties oksidatorius, nemetalas.
■ 93. Kodėl sieros rūgštis panaši į kitas rūgštis?
94. Kokios gali vykti reakcijos, kuriose dominuotų sirchano rūgštis?
95. Kaip sukurti tokią transformaciją:

Užsirašykite panašias reakcijas. Oksido-vandens saugojimui, elektroniniam balansui, joninių reakcijų išlyginimui rašyti jonine forma.
96. Viename buteliuke yra sieros rūgšties, kitame - azoto rūgšties, trečiame - druskos rūgšties. Kaip juos atskirti? 21
Sirka
SIERA-Ir; ir.
1. cheminis elementas (S); lengvai nusakoma geltona spalva (lieka pramonėje, kariniuose reikaluose, žemės ūkio valstybėje, medicinoje).
2. Zhovta riebalų kalba, kuri nusėda ant ausies kanalo sienelių. Išvalykite orą ore.
◁ Sirny (div.).
sieros(lot. siera), cheminis elementas Periodinės sistemos VI grupė. Gyvenk kristalais. St_yka dviejų modifikacijų - rombinis (plotis 2,07 g / cm 3, t pl 112,8 °C) ir monoklininis (kietumas 1,96 g / cm 3, t pl 119°C). Vanduo nėra skaidrus. Ant stovo paviršiaus; degant duodu SO 2 su metalais, tirpinu sulfidus. Gamtoje yra sieros, sulfido, sulfato. Sirka lydosi iš vietinių rūdų; otrimuyut taip pat oksiduojasi rūgštus po sirkovodnya, kuris gali būti pašalintas natūraliomis, pirminio benzino, kokso krosnies dujomis ir kitais metodais. Beveik 50% sieros naudojama sieros rūgšties kiekiui, 25% - sulfitų kiekiui (vikoris naudojamas popieriaus gaminiuose), reshta - kovai su roslino negalavimais, vulkanizavimui, barvnikų sintezei, gamybai. sirnikų ir kitų.
CIRASIERA (lot. Sieros), S, cheminis elementas, kurio atominis skaičius 16, atominė masė 32,066. Cheminis sirka S simbolis pakeistas į "eu". Natūralus serumas susideda iš kelių stabilių nuklidų. (div. NUKLIDAS): 32 S (nustatyta 95,084 % masės), 33 S (0,74 %), 34 S (4,16 %) ir 36 S (0,016 %). Sirkos atomo spindulys yra 0,104 nm. Jonų spinduliai: S 2 jonas - 0,170 nm (koordinacijos skaičius 6), S 4+ jonas 0,051 nm (koordinacijos skaičius 6) ir S 6+ jonas 0,026 nm (koordinacijos skaičius 4). Paskesnės neutralaus atomo maždaug S 0 iki S 6+ jonizacijos energija, matyt, yra lygi 10,36, 23,35, 34,8, 47,3, 72,5 ir 88,0 eV. Sirka yra paslėpta periodinės sistemos VIA grupėje D. I. Mendelijevas, 3-iame periode, ir atsigulti į chalkogenus. Išorinio rutulio konfigūracija 3 s 2
3p 4
. Būdingiausias yra oksidacijos laipsnis kolonose –2, +4, +6 (valentai skiriasi II, IV ir VI). Sirkos elektronegatyvumo reikšmė pagal Paulingą yra 2,6. Sirka guli prie nemetalų.
At į tinkamą išvaizdą sirka є zhovtі krikhkі kristalai arba zhovty milteliai.
Istorinis įrodymas
Sirka drybso gamtoje laisvoje (gimtojoje) stovykloje, kuri jau senais laikais buvo išėjusi iš žmonių namų. Sirka atkreipė dėmesį į būdingą zabarvlennyami, juoda spalva pusiau šviesus ir specifinis kvapas, kuris yra dėl kalno (sieros dujų kvapas). Svarbu, kad tai būtų sirka, kad ji degtų, išvarydama piktąsias dvasias. Biblijoje yra žodis apie pergalingus sirkus, skirtas nusidėjėlių apvalymui. Vidutinio amžiaus žmogui „sirkos“ kvapas asocijuojasi su pragaru. Zastosuvannya sіrks dezinfekcijai zgaduetsya Homer. Senovės Romoje sieros dujų pagalbai buvo dovanojami audiniai.
Sirka ilgą laiką buvo pergalinga medicinoje - pusmėnulyje rūkė negalavimus, її įtraukė iki įvairių tepalų odos ligoms gydyti. 11 val. Avicena (Ibn Sina (div. IBN SINA)), o tada Europos alchemikai įvertino, kad jie išmetė, įskaitant auksą ir sidabrą, yra sudaryti iš įvairių sieros ir gyvsidabrio įrodymų. Todėl sirka vaidino svarbų vaidmenį alchemikų bandymuose pažinti „filosofinį akmenį“ ir nebrangius metalus paversti brangiais. 16 str. Paracelsas (div. Paracelsus)įvedęs gyvsidabrio tvarką ir „kvailį“ vieną pagrindinių gamtos „ausų“, visų kūnų „sielą“.
Praktinė sirkos vertė smarkiai išaugo po to, kai buvo išgerta juoda pudra (sirka patenka į tokio bato sandėlį). 673 m. bizantiečiai, užkariavę Konstantinopolį, sudegino priešo laivyną vadinamąja graikų ugnimi - sumish selіtry, sіrka, dervu ir kitomis kalbomis - kurios pusiau šviesą užgesino vanduo. Viduramžiais Europoje juodieji milteliai buvo sustingę, o sandėlis buvo arti graikinių riešutų ugnies sumos. Nuo tos valandos kariniams tikslams pradėti naudoti įvairiausi pamokslai.
Nuo seno žinoma ir svarbiausia sirka – sieros rūgštis. Vienas iš jatrochemijos kūrėjų (div. iatrochemija), Chenets Vasyl Valentin, XV a. pranešama, kad aprašęs sieros rūgšties apdorojimą skrudinant fiziologinį vitriolį (senas sieros rūgšties pavadinimas yra vitriol oliya).
Nustačius elementarią sirkos prigimtį 1789 m. A. Lavoisier (div. Lavoisier Antoine'as Laurentas). Cheminių spolukų, keršančių už sirką, pavadinimuose priešdėlis „tio“ dažnai praleidžiamas (pavyzdžiui, fotografijoje randamas Na 2 S 2 O 3 reagentas gali būti vadinamas natrio tiosulfatu). Pokhodzhennya tsієї priešdėliai yra susiję su graikišku sirka pavadinimu - theion.
Sveikata gamtoje
Sirka išplatinta gamtos. Apskaičiuota, kad žemės plutoje kaina yra 0,05% masės. Gamtoje žymūs vietinių sirkų telkiniai dažnai įstringa (garsas prie ugnikalnių); Europoje dvokia roztashovani ant pivdni Italijoje, Sicilijoje. Dideli vietinės sirkos telkiniai yra JAV (Luizianos ir Teksaso valstijose), taip pat Centrinėje Azijoje, Japonijoje, Meksikoje. Gamtoje sirka dryžuota kaip rožės, o matant kristalinius sluoksnius kartais stebina savo grožiu, naivių permatomų kristalų grupės (draugų titulas).
Vulkaninėse vietovėse dažnai galima pamatyti žemės uždusimą karšto vandens dujomis H 2 S; šiuose regionuose sirkovodajus riaumojančiu žvilgsniu skuba į Sirchaniho vandenis. Vulkaninės dujos dažnai sugeria SO 2 rūgščias dujas.
Mūsų planetos paviršiuje įvairių sulfidų laukų gentys yra platesnės. Dažniausiai tarp jų yra dryžuoti: zalizninis piritas (piritas (div. PIRIT)) FeS 2 , vario piritas (chalkopiritas) CuFeS 2 , švino blisk (div. GALENITAS) PbS, cinoberas (div. KINOVAR) HgS, sfaleritas (div. sfaleritas) ZnS ir jogos kristalų modifikacijos wurtzitas (div. WURTZIT), antimonitas (div. ANTIMONITAS) Sb 2 S 3 ir kt. Taip pat yra daugybė įvairių sulfatų genčių, pavyzdžiui, kalcio sulfatas (gipso CaSO 4 2H 2 O ir bevandenis CaSO 4), magnio sulfatas MgSO 4 (girka sil), bario sulfatas BaSO 4 (baritas), stroncio sulfatas SrSO 4 (celestinas). ), natrio sulfatas Na 2 SO 4 10H 2 O (mirabilitas) ir in.
Kam'yane vugillya kerštas vidutiniškai 1,0-1,5% sirkos. Sirka gali patekti į naftos bazę. Gamtinių deginamų dujų rūšių (pavyzdžiui, Astrachanės) kaina yra maža.
Sirka atnešama į gyviems organizmams reikalingus elementus, šukės yra iš sandėlio baltymo esmės. Baltymai gali būti naudojami 0,8-2,4% (pagal svorį) chemiškai surištos sirkos. Roslini otrimuyut sіrk іz sulfaіv, scho mіstya і ґruntі. Nepriimtini kvapai, kuris kaltinamas dėl būtybių lavonų puvimo, paaiškinamas galvos laipsniu matant pusiau sirką (sirkovodnya ir merkaptanus) (div. TIOLI)), kurie nusėda dedant baltymus. At jūros vanduoє arti 8,7 10 -2% sirka.
Otrimannya
Svarbiau sirka paimama išlydant її iš žąsų porų, siekiant atkeršyti už gimtąją (elementarinę) sirką. Taigi geotechnologinio metodo titulas leidžia laimėti sirką neiškeliant į paviršių rūdos. Šis metodas buvo pasiūlytas remiantis 19 str. Amerikiečių chemikas G. Fraschas prieš jį susidūrė su užduotimi atskleisti žemę į žemės paviršių iš JAV pivdnya gimtinės vietos, kur dirvožemis buvo smarkiai paguldytas tradiciniu minų metodu.
Frash zaproponuvav vikoristovuvati už pіdёmu sirka ant paviršiaus perkaitintų vandens garų. Per vamzdžius perkaitinkite garą, kad tarnautumėte požeminiame rutulyje, atkeršytumėte sirkui. Sirka, kad ištirptų (її trocho lydymosi temperatūra žemesnė nei 120 ° С) ir per vamzdį roztashovanіy ієїї, kurių vandens garai pumpuojami po žeme, kyla į kalną. Siekiant užtikrinti retos sirkos tiekimą, vėjas išspaudžiamas per plonesnį vidinį vamzdį.
Skirtingam (terminiam) būdui, užpildant specialų plotį ant burbuolės 20 valg. Sicilijoje specialiose molinėse krosnyse iš apipjaustytos kalnų uolos lydė sirką, arba stingdavo.
Nustatykite kitus vietinės sirkos iš veislės matymo būdus, pavyzdžiui, ekstrahavimą sieros anglimi arba flotacijos metodus.
Atsižvelgiant į tai, kadangi meistriškumo poreikis sirtsі jau yra didelis, razroblenі metodai її otrimanna іz sirvodnju H 2 S ir sulfatai.
Didžiojoje Britanijoje pirmasis buvo suskaidytas sieros vandens oksidacijos iki elementinės sirkos metodas, o didelis sirkos kiekis buvo išmoktas pašalinti iš sodos Na 2 CO 3 po prancūzų chemiko N. Leblanc metodo, kuris yra prarado po pašalinimo. (div. Leblanc Nikola) kalcio sulfidas CaS. Leblanc metodas natrio sulfato buvimui nustatyti esant CaCO3 garuose.
Na 2 SO 4 + 2C \u003d Na 2 S + 2CO 2;
Na 2 S + CaCO 3 \u003d Na 2 CO 3 + CaS.
Sodą išprakaituojame vandeniu, o bjauraus mažmeninės prekybos kalcio sulfido vandeninė suspensija apdorojama anglies dioksidu:
CaS + CO 2 + H 2 O \u003d CaCO 3 + H 2 S
H 2 S apvažiavimas, kuris yra patvirtintas, viryklė perduodama per katalizatoriaus rutulį pakartojimų suma. Tuo pačiu metu, siekiant netobulos kraujotakos oksidacijos, sirka nustatoma:
2H 2 S + O 2 \u003d 2H 2 O + 2S
Panašus vikoristinis metodas naudojamas elementariai sirkai ir iš sirkovodnyai išgauti, susijusiai su gamtinėmis dujomis.
Taigi, kadangi šiuolaikinės technologijos pareikalaus aukšto lygio švaros, veiksmingi metodai rafinavimo sirka. Tuo pačiu metu vicoristas, zocrema, vіdmіnostі in khіmіchnіy elgesys sirka ir domіshok. Taigi, medus ir selenas pašalinami apdorojant azoto ir sieros rūgščių mišinį.
Vykoristannya metodai, zanovanakh dėl distiliavimo ir rektifikavimo, vdaetsya otrimat vysokochistu sіrku s vіstomі domіshok 10 -5 -10 -6% masės.
Fizinė ir cheminė galia
Sirkio atomai gali turėti unikalią savybę sukurti stabilias homograndes, tokias kaip lancetai, kurie susidaro tik iš S atomų (S–S jungties energija tampa apie 260 kJ/mol). Sirkos homograndinės turi zigzago formą, kuri jų šviesoje išgyvena elektronų likimą, roztashovani susidedant atomus p-orbitalėse, statmenose viena kitai. Qi lanceugs gali pasiekti puikią dožiną arba, priešingai, sukurti uždarus žiedus S 20, S 8, S 6, S 4.
Dėl šios priežasties sukuriama dešimtys tiek kristalinių, tiek amorfinių modifikacijų, kurias formuoja tiek molekulių ir polimerinių lantelių sandėlis, tiek jų pakavimo į vientisą plieną būdas.
Esant normaliam slėgiui ir temperatūrai iki 98,38 ° C, sirkos a-modifikacija yra stabili (taip pat vadinama rombine modifikacija), kuri užgesina citrinos geltonumo kristalus. Її kristalinė gardelė ortorombinis, elementariojo centro parametrai a = 1,04646, b = 1,28660, c = 2,4486 nm. Storis 2,07 kg/dm3. Daugiau nei 95,39 ° C yra stabili sirkos b modifikacija (vadinamoji monoklininė sirka). Kambario temperatūroje monoklininio b-S elementariojo vidurio parametrai yra a = 1,090, b = 1,096, c = 1,102 nm, t = 83,27 °C. Storis b-S 1,96 kg/dm3.
Tiek apskritimo a-, tiek b-modifikacijose aštuonių narių ciklinė molekulė S 8 nėra gera. Šios troch molekulės yra panašios į coroni.
Du ts abipusė orientacija S 8 molekulės kristalo tirpale.
Dar viena sirkos modifikacija - vadinamoji romboedrinė sirka - gali būti atskirta pagal skirtumą tarp natrio tiosulfato Na 2 S 2 O 3 ir koncentruotos druskos rūgšties 0 ° C temperatūroje, toliau ekstrahuojant sirką toluenu. (div. toluenas). Išgaravus mažmenininkui, kaltinami romboedriniai kristalai, kurie atkeršija už fotelio formos S 6 molekules.
Amorfinė siera (kietumas 1,92 g/cm saltas vanduo). Qi modifikacijos formuojamos iš netaisyklingų apvijų strypų S n . Esant trivialiam stiklakūniui 20–95 ° C temperatūroje, sirkos modifikacijos paverčiamos a-sirka.
Rombinio a apskritimo lydymosi temperatūra yra 112,8 °C, o monoklininio b apskritimo – 119,3 °C. Ir tą, ir kitą rudenį įsitvirtina šviesios spalvos gimtosios žemės geltonumas, kaip prie 160 C temperatūros tamsus; її klampumas didėja, o aukštesnėje nei 200 ° С temperatūroje sirka tampa tamsiai ruda ir klampi, kaip derva. Mes suprantame, kad S8 žiedinės molekulės atrajoja lydaloje. Fragmentai, kurie yra kaltinami, bus sujungti po vieną su senų pistoletų S µ rezoliucijomis iš dekilkoh šimtų tūkstančių atomų. Tolesnis išsilydžiusios sirkos (vyno 250 ° C temperatūroje) kaitinimas iš dalies supuvo, o tėvynė tapo vis sausesnė. Ant pav. parodytas retos sirkos klampumo temperatūros išlaikymas. Beveik 190 °C її klampumas maždaug 9000 kartų didesnis, žemesnis nei 160 °C.
444,6 °C temperatūroje sirka užverda. Priklausomai nuo temperatūros її garuose, galima aptikti S8, S6, S4 ir S2 molekules. Pasikeitus molekulių sandėliui, reikia keisti statymų skaičių nuo oranžinės geltonos iki šiaudų geltonos spalvos. Esant aukštesnei nei 1500 °C temperatūrai, S2 molekulės disocijuoja į atomus.
Molekulės S 2 yra paramagnetinės (div. PARAMAGNETINIS) ir paskatino panašiai kaip O2 molekulė. Visose kitose šalyse sirka yra diamagnetinė (div. DIAMAGNETINĖ).
Prie vandens sirka praktiškai nesimato. Deyakі її modifikatsії razchinyayutsya organinėse tėvynėse (toluenas, benzolis) ir ypač gerai - anglies CS 2 ir reto amoniako NH 3 .
Sirka - užbaigti aktyvų nemetalą. Sušilęs jis oksiduos gausiai paprastas kalbas, bet pats lengvai oksiduojasi rūgštus ir halogenus.
S + O 2 \u003d SO 2, S + 3F 2 \u003d SF 6
2S + Cl 2 \u003d S 2 Cl 2 (iš namo SCl 2)
Su vandeniu, pakaitinus, darau H 2 S i dieną nedideliame kiekyje sulfani (pusė sandėlio H 2 S n):
H2+S H2S.
Taikykite sirkos reakciją su metalais:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
sulfidai, kurie ištirpsta šiose reakcijose, pasižymi ne konstanta, o, kaip taisyklė, kintamu sandėliu. Taigi kalcio sulfido sandėlis gali be pertrūkių keistis ties CaS ir CaS 5 riba. CaS n arba Na 2 S n tipo polisulfidas, kai sąveikauja, pavyzdžiui, iš druskos rūgšties, ištirpina sulfani H 2 S n Be to, n reikšmė gali būti nuo 1 iki 10.
Kaitinant, sieros rūgštis koncentruojasi iki oksiduojančios sieros iki SO 2
S + 2H 2 SO 4 \u003d 2H 2 O + 3SO 2.
Royal Gorilka (azoto ir druskos rūgščių mišinys) oksiduoja sierą iki sieros rūgšties.
praskiesta azoto rūgštis, vandenilio chlorido rūgštis be oksidatorių ir sieros rūgštis šaltu oru tarpusavyje nesąveikauja. Kaitinant verdančiame vandenyje arba atvirose pievose, neproporcingai:
3S + 6NaOH 2Na 2S + Na2SO3 + 3H2O;
Sirka gali pakilti iki sulfidų
Na 2 S + (n-1) S \u003d Na 2 S n
ir į sulfitus:
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
Dėl šios reakcijos su natrio sulfitu Na 2 SO 3 natrio tiosulfatas Na 2 S 2 O 3 ištirpsta.
Kaitinamas oras reaguoja su įprastais elementais, grietinėle, inertinėmis dujomis, jodu, azotu, platina ir auksu.
Vіdomo kilka oksіv sirki. Kremas, atsparus sieros dioksidui SO 2 [kiti pavadinimai: sieros dujos, sieros anhidridas, sieros oksidas (IV)] ir sieros trioksidas SO 3 [kiti pavadinimai: sieros dujos, sieros anhidridas, sieros oksidas (VI)], pašalinant nestabilų oksidą S 2 O (praleidžiant SO 2 srovę per švytinčią iškrovą) і S 8 O ( su H 2 S sąveika su SOCl 2). Peroksidas SO 4 ir S 2 O 7 ištirpinami leidžiant SO 2 kartu su rūgštimi per lakiąsias iškrovas arba per SO 2 oksidaciją ozonu.
Rūgštinis sieros dioksidas SO 2 yra nestabili vidutinio stiprumo H 2 SO 3 rūgštis (sieros rūgštis):
H 2 Pro + SO 2 H 2 SO 3
o rūgštinis sieros trioksidas SO 3 yra stipri dvibazė sieros rūgštis (div. SIRCHANO RŪGŠTIS) H2SO4:
SO 3 + H 2 O \u003d H 2 SO 4
І sieros rūgštis H 2 SO 3 ir sieros rūgštis H 2 SO 4 pateikiamos dviem eilėmis druskų: rūgštinė [hidrosulfitas NaHSO 3 , Ca(HSO 3) 2 ir in. i hidrosulfatas КНSO 4, NaНSO 4 ir інші] ir vidurinis [sulfatas Na 2 SO 3 K 2 SO 3 i sulfatas CaSO 4 Fe 2 (SO 4) 3].
Sirka įeiti į turtingo ekologinio derliaus sandėlį (div. statti Thiofen (div. TIOFENAS), Tioli (div. TIOLI) ir kiti).
Zastosuvannya
Beveik pusė sirkos, kuri viroblyaetsya, vikoristovuetsya gaminant sieros rūgštį, beveik 25% yra sijojama sulfitų pašalinimui, 10-15% - kovai su stiprių dygstančių pasėlių eršketais (vynuogių galvų laipsnis) ir bavovnik) (svarbesnis skirtumas tarp vario vitriolio CuSO 4 5H 2 O ), beveik 10 % yra sugadinta gumos pramonėje dantenų vulkanizavimui. Cirku zastosovuyt kai virobnitstvі barvnikіv ir pіgmentіv, vybuhovyh rechovina (laimėjo dosі eiti į parako sandėlį), gabalas pluoštų, liuminoforų (div. Luminophori). Serka vikoristovuyut renkant sirnikiv, kad tas vienas eitų į sandėlį, iš kurio gaminamos sirnikivo galvutės. Sirku dosі mіstya deyakі tepalai, su kuriais jie džiaugiasi škіri liga. Norėdami suteikti plienams ypatingos galios, jie įveda nedidelius sirkos priedus (norint, kad sirkos namas būtų unbazhan).
Biologinis vaidmuo
Sirka nuolat yra visuose gyvuose organizmuose, nes yra svarbus biogeninis elementas (div. BIOGENINIAI ELEMENTAI). Її vietoj roslinų tapti 0,3-1,2%, būtybėms 0,5-2% ( jūrų organizmai atkeršyti daugiau sirka, Chim antžeminis). Biologinę sirkos reikšmę mes nustatome prieš jį, kad ji turėtų būti įtraukta į aminorūgščių metionino sandėlį (div. METIONINAS) kad cisteinas (div. cisteinas) i, vėliau į peptidų sandėlį (div. PEPTIDI) kad bіlkіv. Disulfidinės jungtys –S–S– polipeptidiniuose strypuose dalyvauja formuojant erdvinę baltymų struktūrą, o sulfhidrilo grupės (–SH) vaidina svarbų vaidmenį aktyviuose fermentų centruose. Be to, sirka patenka į hormonų molekules, svarbias kalbas. Daug sirkos randama keratininiuose plaukuose, šepečiuose, nerviniame audinyje. Neorganiniai sirkos daigai reikalingi roslino mineraliniam gyvenimui. Smarvės tarnauja kaip substratas oksidacinėms reakcijoms, kurios zdіysnyuyutsya pagal gamtos plačiausias sieros bakterijas. (div. SEROBAKTERIJOS).
Vidutinio žmogaus (kūno svoris 70 kg) organizme yra apie 1402 g sirkos. Papildomi suaugusių žmonių poreikiai širdyje yra arti 4.
Tačiau už jo neigiamo poveikio viduryje kad žmonės sirka (tiksliau, її z'єєєdnannya) stovi vienoje iš pirmųjų vietų. Pagrindinis dzherelo zabrudnennya syroj - spjaudymas iš akmens vugilio ir kitų rūšių ugnies, kurios keršija už sirką. Dėl to beveik 96% sirkos, kuri yra išsklaidyta ugnyje, patenka į atmosferą SO 2 rūgščių dujų pavidalu.
Sieros atmosferoje dujos palaipsniui oksiduojasi iki sieros oksido (VI). Obidva oksidas - i sieros oksidas (IV), i sieros oksidas (VI) - vzaєmod_yut іz vandens garų z utvorennyam rūgšties razinas. Potim tsі rozchini patenka kaip rūgštūs miškai. Atsirėmę į dirvą rūgštūs vandenys niekina dirvožemio faunos ir roslinų vystymąsi. Dėl to augant augimui sukuriami nedraugiški protai, ypač pivnіchnyh regionuose, kur prie atšiauraus klimato pridedama cheminė painiava. Po to žūva lapės, nulaužta žolės danga, vanduo apmirksta. Rūgštinės lentos ardomos iš marmuro ir kitų medžiagų, paminklai, be to, dėl smarvės griauna akmeninius pumpurus ir akmenis iš metalų. Prie to reikia priprasti prie įvairių įėjimų, kad nepatektų į atmosferą. Tam reikia išvalyti pirminį benziną ir naftos produktus iš žaliavų, išvalyti dujas, kurios nusėda deginant ugnį.
Pats sirka matydamas pamatė gleivines, kvėpavimo sistemos organus taip pat gali viklikati rimta liga. GDK sirki pakartojimas 0,07 mg / m 3.
Moterys. viena iš paprastų (nerišlių, nerišlių) kalbų, tirpstanti ir stipriai blyški ugnikalnių žmonių vikopna; kaip prekė, garsas її: sіrka paleva. Parako kovos iš salietros ir sirkos, nuo vugilių. Živcevo sirka, patiekiama su lazdelėmis. | Sirka, sirka... Tlumachny žodynas Dalia
CIRA- SIERA, siera, chem. elementas VI gr. Mendelio sistema, simbolis S, serijos numeris 16, at. V. 32.07 val. Naujausių valandų vaizdas. Gamtoje jis atrodo kaip vanduo (neptūninis) ir vulkaninės nuosėdos. žygis. Zustrichaetsya taip pat ... Puiki medicinos enciklopedija
CIRA- Chem. elementas, simbolis S (lot. Sieros), at. n. 16, val. m. 32.06 Ісnuє ir viglyadі kіlkoh alotropinės modifikacijos; tarp jų – eilė monoklininių modifikacijų (plotis 1960 kg/m3, tmelt = 119°С) ir rombinė sirka (plotis 2070 kg/m3, ίπι = 112,8… Didžioji politechnikos enciklopedija
- (žymimas S), PERIODINĖS LENTELĖS VI grupės cheminis elementas, nemetalas, senamadiškas. Zustrichaetsya gamtoje kaip apžvalgos aikštelė elementas, todėl žiūrint į sulfidinius mineralus, tokius kaip GALENIT ir PIRIT, ir sulfatinius mineralus, ... Mokslinis ir techninis enciklopedinis žodynas
Airijos keltų mitologijoje Sirka yra Partalono tėvas (6 skyrius). Zgіdno su deyakim dzherelami, pati Sirka, o ne Partalonas buvo Dilgneido vyras. (
