Sirkos dioksidas laikomas laboratorijoje. Sirki dioksidas (sirk dioksidas, sieros anhidridas)
Empirinė formulė. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .SO2
Molekulinė masė, kg/kmol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64.06
Agregatų malūnas. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . panašus į dujas
Zovnishhnіy išvaizda. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . dujos be statinės
Kvapas. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .būdingas, aštrus kvapas
Vikoristanija: virobnichestvo sieros rūgštis. Zavdyaki didelis garavimo karštis, taip pat lengvas reto SO2 kondensatas sustingsta šaldymo technologijoje. Būdamas stipriu vadovu prekyba vandeniu, SO2 daro daug ekologiškų tvartų, kurie vikoristovuetsya pridedant šiaudų, vynmedžių, siūlių, kukurūzų borošas kad tsukru. Retas SO2 taip pat sustingsta celiuliozės pramonėje, kai kuriose organinėse rūšyse, pvz., kalbai išsaugoti (pavyzdžiui, nuimant derlių, vežant vaisius ir vaisius).
FIZINĖ IR CHEMINĖ GALIA
Plotis prie 20 ° С statistika 101,3 kPa, kg/m3. . . . . . . . . . . . . . . . . . . . 2.926
Virimo temperatūra vienai gnybtai 101,3 kPa, °C. . . . . . . . . . . . minus 10.01
Lydymosi temperatūra už spaustukų yra 101,3 kPa, °C. . . . . . . . . . .minus 85,5
Temperatūra kritinė, °C. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 157.2
Kritinis slėgis, MPa. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.87
Šviesos šiluma, kcal/mol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . minus 70,96
Dujų šiluminė galia, cal/(m). . . . . . . . . . . . . . . . . . . . . . . . . . . 0,145
Šilumos laidumas esant 0°С, cal/(cm?sgrad). . . . . . . . . . . . . . . . . . . . . . . . . 0,0195
:* t – kieta kalba;
Razchinistas prie vandens 25 °C. . . . . . . . . . . . . . . . . . . . . . .gera mažmeninė prekyba
Reakcija zdatnіst: rozchinny etilo alkoholis, sieros rūgštis. Su vandens veislėmis pievos reaguoja su ištirpusiomis sieros rūgšties druskomis - sulfitais ir bisulfitais. Absoliučiai sausas sieros dioksidas normalioje temperatūroje nereaguoja su rūgščiu, vandeniu, halogenais ir sieros vandeniu. Aukštai katalizatoriaus temperatūrai vanduo naudojamas iki vidurdienio, anglies oksidas - iki vidurdienio. Vologii dioksid serki vzaєmodіє іz sіrkovodnym at zvichaynіy temperaturі z utvorennymi sirki. Įvairūs oksidatoriai oksiduojasi iki sieros trioksido ir sieros rūgšties. Su dujiniu amoniaku vandens garai reaguoja su ištirpusiu amonio sulfitu, o esant vandeniui – amidosulfono rūgštimi. Su dioksidu siera reaguoja vandeniniuose organinių aminų tirpaluose, kurie ištirpina sulfitus organinių bazių pavidalu, o bevandenėse – sulankstytus amidosulfonrūgšties esterius.
SANITARIJOS IR HIGIENINĖS CHARAKTERISTIKOS
CAS registracijos numeris. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7446-09-5
Nebezpeki klasė darbo zonos priekyje. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3
MPCm.r. visose darbo zonose, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10
Kalbos kodas, kuris yra paini atmosfera. . . . . . . . . . . . . . . . . 0330
Saugos klasėje atmosferos efektas. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3
MPCm.r./d.s. atmosferoje, mg/m3. . . . . . . . . . . . . . . . . . . . . . . . . . 0,5/0,05
Aptaškymas ant žmonių: verksmas laukiniai būdai, bronchų spazmas, pablogėja kvapas, susilpnėja skonis, vokai gali būti opiatai.
Ateikite pirmas padėti sužeistiesiems į kalbos antplūdį: kaltinkite gryname ore, kvieskite drabužius, kuriuos spaudžiate. Inhaliacijos rūgsta. Šiltai patalpose. Sunku kvėpuoti per nis - efedriną. Nadali - vіdharkuvalni; gerti šiltą pieną su soda, alyvuogių aliejumi ir medumi.
Prašome atvykti: neleidžiama matyti sieros dioksido darbo zonoje; vizitai į vėdinimo vikių valymą, siekiant išvalyti ore esantį dioksidą.
Zabobi zakhistu: protigaz žodžiai, kokie filtrai, su filtru. Zakhist akis, kad shkiri.
GALIMA NESAUGI GALIA
Degumo grupė: . . . . . . . . . . . . . . . .nedegios, nedegios kalbos
Daugiau apie temas DIOKSIDO SERIJOS (SIRI DIOXIDE, SULPHUR ANHYDRIDE):
- VANDENILIO SULFIDAS (VANDENILIO DISUFIDAS, VANDENILIO SIERA, DIHIDROSULFIDAS)
- Mish'yak ta yogo spoluki (mish'yakovist anhidridas, misch'yakovist rūgštis ir її druskos, mish'yakovist vanduo, osarsol)
4.doc
Sirka. Aplinkplaukimas, sulfidas, hidrosulfidas. Oksidas syrki (IV) ir (VI). Sieros rūgštis ir sieros rūgštis bei jų druskos. Sieros rūgšties eteriai. Natrio tiosulfatas
4.1. Sirka

Sirka yra vienas iš prastų cheminių elementų, kaip jau tūkstantis žmonių. Vaughn yra plačiai paplitęs gamtoje ir auga kaip laisva stovykla (vietinė sirka), taip pat ūkiuose. Mineralai, keršijantys už sirką, gali būti suskirstyti į dvi grupes – sulfidus (piritai, palaima, mišiniai) ir sulfatus. Italijoje (Sicilijos saloje) ir JAV auga daugybės žmonių vietinė sirka. SND vietinės sirkos kilmė yra Volgos regione, Centrinės Azijos, Krymo ir kitų regionų valstybėse.
Švino blizgesys PbS, vario blizgesys Cu 2 S, sidabro blizgesys – Ag 2 S, cinko mišinys – ZnS, kadmio mišinys – CdS, piritas arba lietinis kilis – FeS 2, chalkopiritas – CuFeS 2 – HgS.
Gipsas CaSO 4 2H 2 O, mirabiletas (Glauberio stiprumas) - Na 2 SO 4 10H 2 O, kі-zeritas - MgSO 4 H 2 O gali būti dedamas į kitos grupės mineralus.
Sirka randama būtybių ir roslino organizmuose, šukės patenka į baltymų molekulių sandėlį. Organinius sirkos daigus nuplauna pirminis benzinas.
Otrimannya
1. Kai otrimani sirki iš natūralaus spoluko, pavyzdžiui, iš sirchan pirito, yogo kaitinamas iki aukštos temperatūros. Sieros piritai paskirstomi su salės (II) sulfido ir sirkių tirpalais:
2. Galima pašalinti kraujotakos dienos oksidaciją trumpu rūgštumu reakcijai:
2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Šiuo metu anglies dioksido panaudojimas sieros dioksidui SO 2, šalutiniam metalų lydymosi iš sieros rūdų produktui, yra platesnis:
SO 2 + C \u003d CO 2 + S
4. Dujų vėjai ir metalurgijos bei kokso krosnys atkeršyti už sieros dioksido ir sirkovodnya sumą. Praleiskite Qiu sumish aukštos temperatūros virš katalizatoriaus:
H 2 S + SO 2 \u003d 2H 2 O + 3S
Sirka yra tvirtas citrinos geltonos spalvos traškėjimas. Vandenyje jis praktiškai neišspręstas, tačiau gerai, kad jį galima išskirti sirkovogletsyu CS 2 anilino ir kai kurių kitų avižų.
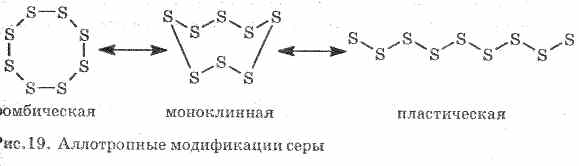
Blogai praleidžia šilumą ir elektrą. Sirka utvoru šprotas alotropinių modifikacijų:
1 . ^ Rombinė Sirka (Naystіykіsha), kristalai atrodo kaip oktaedrai.
Kaitinamas oras, keičiasi її spalva ir klampumas: ant burbuolės jis tampa šviesiai geltonas, o tada pasaulyje pakyla temperatūra, tampa tamsesnė ir grindų danga yra klampi, kuri neišsisunkia iš mėgintuvėlio, su nedidele apkrova Ivannі in'klampumas vėl krenta, o 444 , 6 °C temperatūroje kurį laiką užverda.
2. ^ Sirkos monoklinika - tamsiai atrodančių golchastih kristalų modifikacija, išeina visiškai atvėsus lydytam sūriui.
3. Plastikinė sirka nusistovėti, tarsi pakaitintas iki užvirimo saltas vanduo. Jį lengva ištempti kaip gumi (div. 19 pav.).
Natūrali sirka susidaro iš kelių stabilių izotopų sumos: 32 16 S, 33 16 S, 34 16 S, 36 16 S.
Pasaulio atomas, apšviesdamas esamo energijos lygio netobulumus, gali prijungti du elektronus ir parodyti žingsnius
Oksidacija -2. Toks sieros oksidacijos laipsnis stebimas esant metalams ir vandeniui (Na 2 S, H 2 S). Elektronų perkėlimo ar perkėlimo į elektronneigiamo elemento atomą atveju ciklo oksidacijos pakopos gali būti +2, +4, +6.
Šaltyje oras gana inertiškas, tačiau kylant temperatūrai reakcingas pastatas juda. 1. Su metalais sirka rodo galios oksidus. Šių reakcijų metu ištirpsta sulfidai (iš aukso nereaguoja platina ir iridis): Fe + S \u003d FeS
2. Su vandeniu normaliomis sąlygomis ciklas nesąveikauja, tačiau esant 150-200 °C temperatūrai, vyksta atvirkštinė reakcija:
3. Reakcijoje su metalais ir vandeniu jis elgiasi kaip tipiškas oksidatorius, o esant stipriai oksiduojančiai medžiagai, turi dominuojančią galią.
S + 3F 2 \u003d SF 6 (nereaguoja su jodu)
4. Židinio sirka rūgstant 280°С, ale pakartotinai 360°С. Kokia SO 2 ir SO 3 suma nusistovėjusi:
S + O 2 \u003d SO 2 2S + 3O 2 \u003d 2SO 3
5. Kaitinamas be prieigos, oras iš karto sumaišomas su fosforu, anglimi, rodo oksido galią:
2P + 3S \u003d P 2 S 3 2S + C \u003d CS 2
6. Bendraujant su sutraukiamomis kalbomis svarbu elgtis kaip lyderiui:
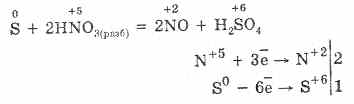
7. Sirka zdatna prieš neproporcingumo reakcijas. Taigi, verdant sirkos miltelius su pievomis, sulfitai ir sulfidai nusėda:
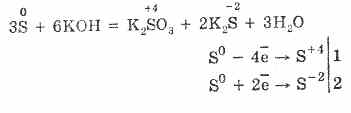
Zastosuvannya
Sirka yra plačiai užimta pramone ir stipria valstybe. Beveik pusė vidobutkos yra nudažyti dėl sieros rūgšties. Vykorivuyut sirka gumai vulkanizuoti: su kuria guma paverčiama huma.
Pamačius sirchano spalvą (smulkius miltelius), reikia pasodinti sirką, kuri kovotų su vynuogyno ir bavovniko negalavimais. Її gyvena parako, sіrnikіv, sandėlių pašalinimui, kurie šviečia. Medicina gamina sirchani tepalus odos ligoms gydyti.
4.2. Aplinkplaukimas, sulfidas, hidrosulfidas
Aplinkoji navigacija yra vandens analogas. Jogo elektroninė formulė
Parodykite, kas yra pasaulyje zv'azkіv H-S-H priimti dviejų p-elektronų likimą to paties lygaus atomo maždaug. H2S molekulė turi gaubto formą, todėl yra polinė.
^ Sveikata gamtoje
Aplinkplaukimas banguoja gamtoje šalia vulkaninių dujų ir prie kai kurių mineralinių angų vandenų, pavyzdžiui, P'yatigorsk, Matsesti. Vіn utvoryuєtsya kai pūva sirkovmіsnyh organinės kalbos įvairių būtybių ir rasotų įlankų. Cym paaiškinama charakteristika įžeidžiantis kvapas nuotekų vandenys, grybų duobės ir kapinės.
Otrimannya
1. Aplinką galima atšaukti be tarpininko sirka su vandeniu šildymo metu:
2. Ale zvuchay yogo otrimuyut diyu rozmarino druskos arba sieros rūgštis ant sulfido druskos (III):
2HCl+FeS=FeCl 2 +H 2 S 2H + +FeS=Fe 2+ +H 2 S Ši reakcija dažnai atliekama Kippa aparate.
^ Fizinė galia
Įprastomis mintimis kraujotakos diena yra dujos be statinės, turinčios stiprų būdingą supuvusių kiaušinių kvapą. Dar stipriau įkvėptas susijungia su hemoglobinu, sukeldamas paralyžių, kurio nėra
Kad būtų pasiektas mirtinas rezultatas. Esant mažoms koncentracijoms, mažiau nesaugu. Pratsyuvati su juo reikalinga megztose spintose arba su priedais, kurie yra hermetiškai sandarūs. Leidžiamas H 2 S kiekis aplikacijos mėginiuose yra 0,01 mg 1 litrui pakartojimo.
Aplinkplaukimą vidutiniškai subalansuoja vanduo (20°C temperatūroje 2,5 tūrio cirkuliuojančio vandens pasiskirsto 1 tūryje vandens).
Rozchin s_rvodnyu šalia vandens vadinamas sirkovodny vandeniu arba sirkovodny rūgštimi (tai rodo silpnos rūgšties galią).
^ Cheminė galia
1, Esant stipriam dienos įkaitimui, diena gali būti pertvarkyta dienos ir vandens priėmimui.
2. Į dujas panašus vasaros vanduo, skirtas sudeginti juodųjų pusžiebių paviršiuje su ištirpusiu sieros oksidu (IV) ir vandeniu:
2H 2 S + 3O 2 \u003d 2SO 2 + 2H 2 Pro
Esant rūgštingumui, rūgštus vanduo nusėda: 2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Sirkovoden – pribaigti stiprų lyderį. Visą šią svarbią cheminę galią galima paaiškinti taip. Esant skirtingam H 2 S lygiui, lengva pamatyti elektronus rūgštingumo molekulėse:
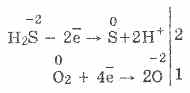
Tuo pačiu metu oras vėl oksiduos vasaros vandenį iki oro, tarsi nelaimės užmuštų dienos vandenį:
2H 2 S + O 2 \u003d 2S + 2H 2 O
Tie, kurie gamtoje nesikaupia dideliais kiekiais, tai aiškina organinių kalbų nykimu – rūgsta po oksidacijos ore.
4, Navigacija aplinkui energingai reaguoja su halogenais, pavyzdžiui:
H 2 S + I 2 \u003d 2HI + S
5. Su cirkuliaciniu vandeniu reaguoja skirtinga oksidacinė energija: su praskiesta azoto rūgštimi susidaro laisva sirka.

6. Sirkovodnyu priežastis gali būti rūgšti reakcija per disociaciją:
H 2 SH + +HS - HS - H + +S -2
Garsas virš pirmosios rūgštynės. Vіn є jau silpna rūgštis: silpna ugіlnu, kaip H 2 S s sulfidų garsas.
Sulfidas ir hidrosulfidas
Sieros rūgštis, kaip dvibazinė rūgštis, patenkina dvi eiles druskų:
Vidurinis - sulfidas (Na 2 S);
Rūgštis – hidrosulfidas (NaHS).
Qi druskos gali būti pašalintos: - kartu su hidroksidais iš cirkuliuojančio vandens: 2NaOH + H 2 S \u003d Na 2 S + 2H 2 Pro
Netarpinė sirkos sąveika su metalais:
Druskų mainų reakcija su H2S arba tarp druskų:
Pb(NO 3) 2 + Na 2 S \u003d PbS + 2NaNO 3
CuSO 4 +H 2 S=CuS+H2SO4 Cu 2+ +H 2 S=CuS+2H +
Hidrosulfidai gali būti rūšiuojami pagal vandenį.
Sulfidai pievų žemės metalai juos taip pat nesunkiai skiria vanduo, bezbarvni.
Svarbių metalų sulfidai vandenyje praktiškai nesiskiria arba nesiskiria (FeS, MnS, ZnS); deakі nuo jų nesiskiria praskiestomis rūgštimis (CuS, PbS, HgS).
Kaip silpnos rūgšties druska, sulfidas stipriai hidrolizuojasi vandens veislėse. Pavyzdžiui, balos metalo sulfidai, atskirti nuo vandens, gali sukelti balos reakciją:
Na 2 S+HOHNaHS+NaOH
Ūsų sulfidai, kaip ir pati diena, yra energijos šaltiniai:
3PbS -2 + 8HN +5 O 3 (rozb.) \u003d 3PbS +6 O 4 + 4H 2 O + 8N + 2 O
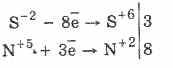
Deyakі sulfidi gali būti būdingesni: CuS і PbS - juoda, CdS - geltona, ZnS - balta, MnS - rožinė, SnS - ruda, Al 2 S 3 - oranžinė. Dėl skirtingos sulfidų įvairovės ir įvairaus jų turtingumo – tikslios katijonų analizės pagrindai.
^ 4.3. Sieros oksidas (IV) ir sieros rūgštis
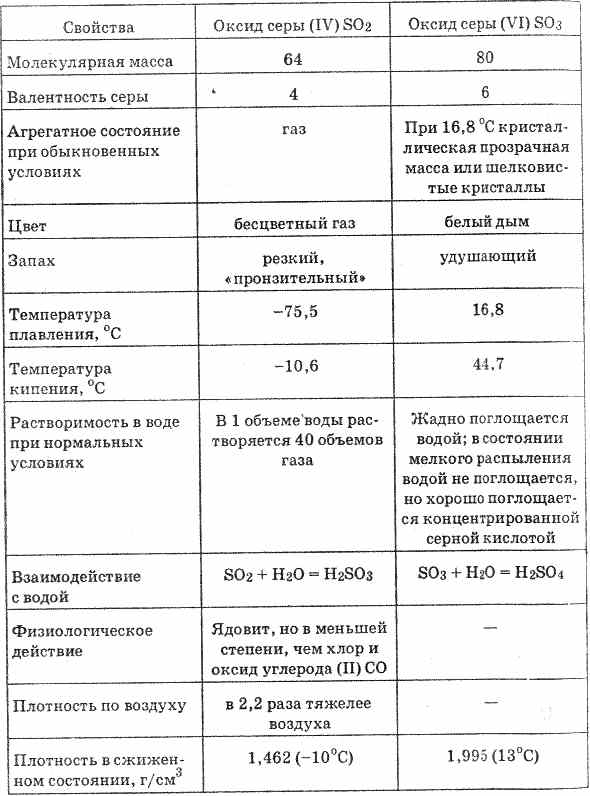
Sirkos (IV) oksidas, arba sirchistinės dujos, didžiausiems protams yra bebarės dujos, turinčios aštrų, dusinantį kvapą. Atvėsęs iki -10 °C, išauga į nederlingą tėvynę.
Otrimannya
1. Laboratorijoje sieros oksidas (IV) gaunamas iš sieros rūgšties druskų ir apdorojamas stipriomis rūgštimis:
Na 2 SO 3 + H 2 SO 4 \u003d Na 2 SO 4 + S0 2 + H 2 O 2NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + 2SO 2 + 2H 2 O 2HSO + 2HSO + 3 + \u003d 2SO 2 + 2H 2 O
2. Taip pat sieros dujos ištirpsta sąveikaujant koncentruotai sieros rūgščiai, kai kaitinamos su mažai aktyviais metalais:
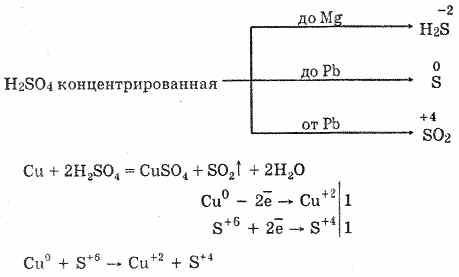
Cu + 2H 2 SO 4 \u003d CuSO 4 + SO 2 + 2H 2 Pro
Cu + 4Н + + 2SO 2-4 \u003d Cu 2+ + SO 2-4 + SO 2 + 2H 2 O
3. Sirkos oksidas (IV) taip pat ištirpsta, kai sirka išsibarsčiusi ore:
4. Pramoniniu požiūriu SO 2 pašalinamas išgarinant piritą FeS 2 arba spalvotų metalų sieros rūdas (cinko mišinį ZnS, švino blisk PbS ir kt.):
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
SO 2 molekulės struktūrinė formulė:
Apšviečiant ryšius su SO 2 molekule, paimkite dviejų elektronų ir dviejų deguonies atomų dalį. Abipusiai elektroninių porų ir nesidalintų elektroninių porų sujungimas į viršų suteikia molekulinę formą.
Cheminė galia
1. Sieros oksidas (IV) parodo visą rūgščių oksidų galią:
Sąveika su vandeniu
Sąveika su pievomis,
Sąveika su baziniais oksidais.
2. Sieros oksidui (IV) būdingas vіdnovluvalnі dominavimas:
S +4 O 2 +O 0 2 2S +6 O -2 3 (esant katalizatoriui, kaitinant)
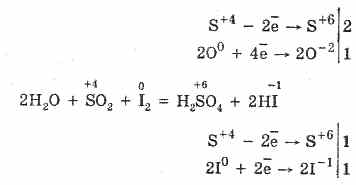
Alus, esant stipriems SO 2 šaltiniams, elgiasi kaip oksidatorius:
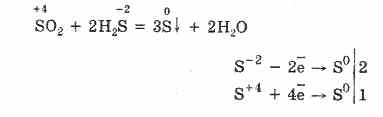
Sieros oksido (IV) oksidinis dvilypumas paaiškinamas tuo, kad siera gali būti naujos oksidacijos būsenos +4 ir, suteikus 2 elektronus, gali būti oksiduota iki S +6, o paėmus 4 elektronus gali būti oksiduojamas iki S °. Parodęs, kad tsikh chi іnshih valdingas, atsispindi reaguojančio komponento prigimtyje.
Sieros oksidas (IV) yra geras vandenyje (1 tūryje, esant 20°С, pasiskirsto 40 tūrių SO 2). Tokiu būdu sieros rūgštį galima ištirpinti vandenyje:
SO 2 + H 2 OH 2 SO 3
Reakcija atvirkštinė. Vandeniniame tirpale sieros oksido (IV) ir sieros rūgšties yra cheminėje fazėje, todėl jas galima slopinti. Sujungiant H 2 SO 3 (rūgšties neutralizavimas
Ti) reakcija vyksta su sieros rūgšties tirpalu; pašalinus SO 2 (pučiant azotu arba kaitinant), reakcija vyksta kalbos pabaigoje. Sieros rūgšties atveju yra sieros oksido (IV), kuris suteikia aštrų kvapą.
Sieros rūgštis turi visą rūgščių galią. Įvairiose disociacijos stadijose dažnai:
H 2 SO 3 H + + HSO - 3 HSO - 3 H + + SO 2-3
Termiškai nestabilus, skraidantis. Sieros rūgštis, būdama dvibazinė, sudaro dviejų tipų druskas:
Terpė – sulfitas (Na 2 SO 3);
Rūgštys – hidrosulfitai (NaHSO 3).
Sulfitai yra utvoryutsya su nauju rūgšties ir pievos neutralizavimu:
H 2 SO 3 + 2 NaOH \u003d Na 2 SO 3 + 2H 2 Pro
Hidrosulfitai atsiranda nestiebalų pievoje:
H 2 SO 3 + NaOH \u003d NaHSO 3 + H 2 Pro
Sieros rūgštis ir її druskos gali būti ir oksiduojančios, ir galingos, tai priklauso nuo reakcijos partnerio pobūdžio.
1. Taigi, kai rūgštis yra rūgšti, sulfitai oksiduojasi į sulfatus:
2Na 2S +4 O 3 + O 0 2 \u003d 2Na 2 S + 6 O -2 4
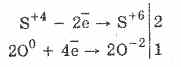
Sieros rūgštį lengviau oksiduoti bromu ir kalio permanganatu:
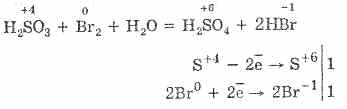
5H 2 S + 4 O 3 + 2 KMn + 7 O 4 \u003d 2H 2 S + 6 O 4 + 2 Mn + 2 S + 6 O 4 + K 2 S + 6 O 4 + 3 H 2 O
2. Esant daugiau sulfito energijos šaltinių, galios oksidai rodo:
Iš sieros rūgšties druskų skiriasi visi balų metalų hidrosulfitai ir sulfitai.
3. Oskilki H 2 SO 3 yra silpna rūgštis, esant dirūgštims ant sulfito ir hidrosulfito, stebimas SO 2. Šis metodas vadinamas vikoristu pašalinant SO 2 laboratorijoje:
NaHSO 3 + H 2 SO 4 \u003d Na 2 SO 4 + SO 2 + H 2 O
4. Vandens sulfito kitimas lengvai hidrolizuojamas, dėl to mažmeninėje prekyboje didėja OH - -jonų koncentracija:
Na 2 SO 3 + NOHNaHSO 3 + NaOH
Zastosuvannya
Oksidas sieros (IV) ir sieros rūgšties znebarvlyuyut gausiai barvnikiv, utvoryuyuchi su jais be barvnі spoluki. Likusią dalį galima atrasti iš naujo kaitinant arba šviesoje, dėl ko ji atgimsta. Otzhe, d_ya, scho beat, SO 2 ir H 2 SO 3 v_drіznyaєtsya v_d bіlit dії chloro. Skambinkite sirki (IV) rxid, kad įveiktumėte vilną, šovką ir šiaudus.
Serkos oksidas (IV) varo daug mikroorganizmų. Štai kodėl, siekdami nuslopinti pelėsinius grybus, jie rūko našlaičių namus, rūsius, vyno statines ir kt. Vykoristovuєtsya taip pat vežant, kad nuskintų vaisių ir yagid. Dideliais kiekiais sieros oksidas IV) sustingsta dėl sieros rūgšties.
Svarbu žinoti kalcio hidrosulfito CaHSO 3 (sulfitinės pievos), kuriuo auginamas medis ir popieriaus masa, kilmę.
^ 4.4. Sirka(VI) oksidas. Sirchano rūgštis
Sieros oksidas (VI) (skyr. 20 lent.) yra bebaretė tėvynė, kuri kietoje kristalinėje masėje yra kietesnė 16,8 ° C temperatūroje. Vіn jau prisiekia vologeriui, nustatydamas sieros rūgštį: SO 3 + H 2 O \u003d H 2 SO 4
20 lentelė
Sieros (VI) oksidaciją vandenyje lydi didelis šilumos kiekis.
Sieros oksidas (VI) plačiau prieinamas koncentruotoje sieros rūgštyje. Skirtumas tarp SO 3 bevandenėje rūgštyje vadinamas oleumu. Oleumyje gali būti iki 70 % SO3.
Otrimannya
1. Sieros oksidas (VI) 450°C temperatūroje vėl priešinasi besierių dujų oksidacijai rūgstant esant katalizatoriams. Sieros rūgšties kiekis):
2SO 2 +O 2 \u003d 2SO 3
2. Geriausias būdas oksiduoti SO 2 į SO 3 yra naudoti jį kaip oksidatorių iki azoto oksido (IV):
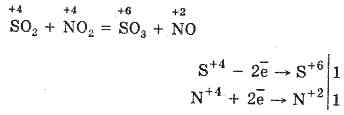
Azoto oksidas (II) ištirpsta sąveikaujant su rūgščiu oru, lengvai ir greitai virsta azoto oksidu (IV): 2NO + O 2 \u003d 2NO 2
Kuris gali būti perdirbamas oksiduojant SO2. Be to, NO 2 atlieka rūgštaus nešiklio vaidmenį. Toks SO 2 oksidavimo į SO 3 būdas vadinamas nereikšmingu. SO 3 molekulė turi trikotažo formą, netoli centro
Norėdami sužinoti sirkos atomą:
Tokia budova yra sujungta su abipusiais elektroninių porų ryšiais. Ant їхнє gyvatės atomas paspaudė šešis zvnіshnіх ехtronіv.
Cheminė galia
1. SO 3 – tipiškas rūgšties oksidas.
2. Sieros oksidas (VI) gali turėti stipraus oksidatoriaus galią.
Zastosuvannya
Sieros oksidas (VI), skirtas sieros rūgščiai gaminti. Svarbiausias kontakto būdas
Sieros rūgšties. Šiam metodui galite pasiimti H2SO4, bet kokios koncentracijos, taip pat oleumą. Procesas susideda iš trijų etapų: SO 2 ekstrahavimas; SO 2 oksidacija į SO 3; H 2 SO 4 kiekis.
SO 2 pašalinamas vipal piritu FeS 2 specialiose krosnyse: 4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2
Greitesniam vipalui priekyje reiktų dėti pirito, o didesniam energingumui reikia įvesti žymiai daugiau oro (rūgštumo), žemiau pagal reakciją. Iš vipalu krosnies išeinančias dujas sudaro sieros oksidas (IV), rūgštus, azotas, pusė mišjaku (iš namo netoli piritų) ir vanduo. Vin vadinamas vipaluvial dujomis.
Vipaluvalny dujos yra skiriamos relės valymui, kad sukeltų nedidelį kiekį dulkių burnoje, taip pat pjūklas ir vologer atidaro katalizatorių. Vіd spoluk mish'yaku ir vіd gėrė dujos išvalomos, praleidžiant jas per specialius elektrinius filtrus ir promivnu; džiovykloje vologa užliejama koncentruota sieros rūgštimi. Valymo dujos, skirtos atkeršyti už rūgštį, šilumokaityje įkaitinamos iki 450°C ir turi būti dedamos šalia kontaktinio įtaiso. Kontaktinio įrenginio vidurys yra policijos dalis, užpildyta katalizatoriumi.
Anksčiau, kaip katalizatorius, pergalinga metalinė platina. Bėgant metams vanadis buvo pakeistas pusiau vanadžio – vanadžio (V) oksidu V 2 O 5 arba vanadilo sulfatu VOSO 4, kuris yra pigesnis už platiną ir yra efektyvesnis.
SO 2 oksidacijos reakcija SO 3 yra atvirkštinė:
2SO 2 + O 2 2SO 3
Padidėjęs rūgštingumas vipalyuval dujose, skatinantis sieros oksido (VI) išsiskyrimą: esant 450 ° C temperatūrai, garsas pasiekia 95% ir daugiau.
Nusodinus sieros oksidą (VI), jis toliau tekėjimo būdu buvo paduodamas į molio kamerą, molio molis koncentruota sieros rūgštimi. Pirmiausia pasaulyje įsitvirtina bevandenė sieros rūgštis, o vėliau – oleumas. Nadali oleumas skiedžiamas iki 98% sieros rūgšties ir pristatomas vyresnio amžiaus žmonėms.
Sieros rūgšties struktūrinė formulė:
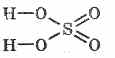
^ Fizinė galia
Sieros rūgštis yra aliejinė terpė be aliejaus, kuri kristalizuojasi esant +10,4°C, gali būti vdvich ( \u003d 1,83 g / cm 3) svarbiau vandeniui, be kvapo, nelakus. Labai gigantiškas-roskopinis. Anot vologerio, matant didelį šilumos kiekį į koncentruotą sieros rūgštį negalima pilti vandens – rūgštis apsitaškys. Laikas -
Veisimui reikia sieros rūgšties mažomis porcijomis pilti į vandenį.
Bevandenėje sieros rūgštyje yra iki 70 % sieros oksido (VI). Kaitinamas tirpina SO 3 iki tylios eglės, kol nusėda su H 2 SO 4 masės dalimi 98,3%. Bevandenis H2SO4 negali praleisti elektros srovės.
^ Cheminė galia
1. Su vandeniu susikaupkite bet kokiame spіvvіdnannyah i utvoryuє dіrati razny sandėlyje:
H 2 SO 4 H 2 O, H 2 SO 4 2H 2 O, H 2 SO 4 3H 2 O, H 2 SO 4 4 H 2 O, H 2 SO 4 6,5 H 2 O
2. Koncentruota sieros rūgštis užlieja organinę kalbą – tsukorą, papirą, medieną, pluoštą, paimdama iš jų vandens elementus:
Z 12 H 22 Pro 11 + H 2 SO 4 \u003d 12C + H 2 SO 4 11 H 2 O
Apsigyvenusi Vougillya dažnai sąveikauja su rūgštimi:
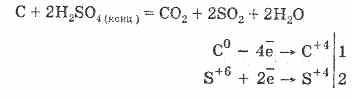
Dujų džiovinimas buvo pastatytas ant molio vandens su sieros rūgštimi.
Kiek stipri yra nelakioji rūgštis H 2 SO 4 klampios kitos rūgštys iš sausų druskų:
NaNO 3 + H 2 SO 4 \u003d NaHSO 4 + HNO 3
Tačiau jei į druskų atskyrimą pridėsite H 2 SO 4, rūgščių rūgštingumas nebus pašalintas.
H 2 SO 4 - stipri dvibazinė rūgštis: H 2 SO 4 H + + HSO - 4 HSO - 4 H + + SO 2- 4
Gali turėti visą nelakiųjų stiprių rūgščių galią.
Rožinė sieros rūgštis pasižymi visa neoksiduojančių rūgščių galia. Ir sau: sąveikaujant su metalais, stovėti metalų įtampos elektrocheminėje serijoje iki paros:
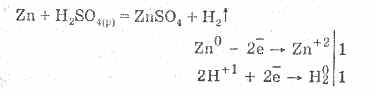
Sąveika su metalais atsižvelgiama į jonų atsinaujinimą vandenyje.
6. Koncentruota sieros rūgštis yra energingas oksidatorius. Kaitinant daugiau metalų oksiduojasi, be to, stovi elektrocheminėje serijoje, slėgis lygus vandeniui, Nereaguoja net su platina ir auksu. Pūdymas metalo, kaip atsinaujinimo produkto, veikloje gali būti S -2, S°і S+4.
Šaltyje koncentruota sieros rūgštis nesąveikauja su tokiais stipriais metalais kaip aliuminis, auksas, chromas. Tai paaiškinama metalų pasyvavimu. Qiu osoblivіst plačiai vikoristovuyut ne її transportirovannі į zaliznіy tarą.
Tačiau kaitinant:
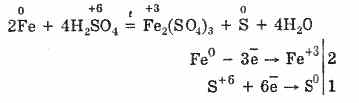
Tokiu būdu sieros rūgštis koncentruojama sąveikaudama su metalais, kad pasikeistų rūgštį sudarančio agento atomai.
Rūgšti reakcija į sulfato joną SO 2-4 yra baltų kristalinių BaSO 4 nuosėdų, netirpių vandenyje ir rūgštyse, tirpalas:
SO 2- 4 + Ba +2 BaSO 4
Zastosuvannya
Sieros rūgštis yra svarbiausias pagrindinis produktas chemijos pramonė kuris užsiima gamyba ne
Organinės rūgštys, pievos, druskos, mineraliniai priedai ir chloras.
Dėl zastosuvannya kintamumo sieros rūgštis yra pirmoji tarp rūgščių. Svarbiausia gauti fosforo ir azoto priedų. Būdama nelaki, sieros rūgštis padeda pašalinti kitas rūgštis – vandenilio chlorido, fluoro, fosforo ir spalį.
Bagato її ide skirtas naftos produktų – benzino, žibalo, aliejaus – valymui shkіdlivih domіshok. Atliekant mechaninį apdirbimą sieros rūgštimi, metalo paviršius prieš dengimą nuvalomas oksidais (nikeliavimas, chromavimas ir kt.). Syrchanu rūgšties zastosovuyut ir vibronitstvі vibukhovih rechovina, gabalas pluoštai, barvnikіv, plastikai ir turtai іnshih. Її vikoristas akumuliatorių užpildymui.
Sieros rūgšties druskos yra svarbios.
^ Natrio sulfatas Na 2 SO 4 kristalizuojasi dėl vandens skirtumų, panašių į Na 2 SO 4 10H 2 Pro hidratą, kuris vadinamas Glauberio slenksčiu. Zastosovuєtsya medicinoje kaip auskarų vėrimas. Bevandenis natrio sulfatas zastosovuyut sodos pelenų gamyboje.
^ Amonio sulfatas(NH 4) 2 SO 4 - azotas nėra geras.
Kalio sulfatas K 2 SO 4 - kalio rūšis.
Kalcio sulfatas CaSO 4 gamtoje yra jautrus, atrodo kaip mineralinis-lu gipsas CaSO 4 2H 2 O. Kaitinamas iki 150 °C, jis sunaudoja dalį vandens ir iš hidrato pereina į sandėlį 2CaSO 4 H 2 O, pavadinimai yra degintas gipsas arba alebastras. Alebastras, sumaišytas su vandeniu į histo tipo masę, po tam tikros valandos vėl sukietėja, virsdamas CaSO 4 2H 2 O. Gipsas plačiai fiksuojamas kasdieniame gyvenime (gipsas).
^ Magnio sulfatas MgSO 4 m_statsya jūros vandenyje, pribloškiantis її karštu pasimėgavimu. Krystologidrat, iš girkoy slenksčio pavadinimų, zastosovuyut kaip klestėti.
vitriolis- metalų kristalinių sulfatų Fe, Cu, Zn, Ni, Co techninis pavadinimas Midniy vitriolis CuSO 4 5H 2 Pro - mėlynos spalvos mėlynių kalba. Rozvedenimu uždengiame roslinus ir nuvalome dieną prieš sėją. Zalizny vitriol FeSO 4 7H 2 Pro – šviesiai žalia kalba. Zastosovuyt kovai su zі shkіdniki roslin, rašalo paruošimas, mineralinis farb toshcho. Cinko vitriolis ZnSO 4 7H 2 O vicory naudojamas mineralinių farbų gamyboje, chintzėje, medicinoje.
^ 4.5. Sieros rūgšties eteriai. Natrio tiosulfatas
Į sieros rūgšties esterius dedama dialkilsulfatų (RO 2)SO 2. Tse aukštai verdantis rіdini; apatinis rozchinnі prie vandens; esant pievoms, naudojamas spiritas ir sieros rūgšties druskos. Žemesnysis dialkilsulfatas – alkilinančios medžiagos.
Dietilo sulfatas(C2H5)2SO4. Lydymosi temperatūra -26 °C, virimo temperatūra 210 °C, tirpsta alkoholiuose, netirpsta vandenyje. Vartojamas kartu su sieros rūgštimi ir etanoliu. Etіlyuyuchim agentas organinėje sintezėje. Prasiskverbia per odą.
dimetilo sulfatas(CH3)2SO4. Lydymosi temperatūra -26,8°C, virimo temperatūra 188,5°C. Rozchinny alkoholiuose, bjaurus - vandenyje. Reaguoja su amoniaku be pardavėjo (su vibracija); sieros deyakі aromatiniai spoluki, pavyzdžiui, efіri phenolіv. Pašalinkite 60% oleumo su metanoliu 150 °C temperatūroje, kaip metilinimo agentą organinėje sintezėje. Kancerogenas pažeidžia akis, odą, kvėpavimo sistemos organus.
^ Natrio tiosulfatas Na2S2O3
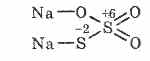
Tiosieros rūgšties stiprumas dviejų sieros atomų pavidalu gali skirtis priklausomai nuo oksidacijos laipsnio: +6 ir -2. Kristalinė kalba, gerumas prie vandens. Jis gaminamas Na 2 S 2 O 3 5H 2 O kristalohidrato pavidalu hiposulfito vardu. Otrimuyut kartu su natrio sulfitu su siera verdant:
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
Jakas ir tiosieros rūgštis, stiprus agentas, lengvai oksiduojamas chloru į sieros rūgštį:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O \u003d 2H 2 SO 4 + 2 NaCl + 6HCl
Šioje reakcijoje natrio tiosulfatas buvo pagrįstas natrio tiosulfato pridėjimu molio prie chloro (pirmosiose antidujose).
Kitaip tariant, natrio tiosulfatas oksiduojamas silpnais oksidatoriais. Taip ištirpinamos tetrationinės rūgšties druskos, pavyzdžiui:
2Na 2S 2 O 3 + I 2 \u003d Na 2 S 4 O 6 + 2 NaI
Natrio tiosulfatas yra šalutinis produktas gaminant NaHSO 3, besierius tvartus, valant pramonines dujas iš sieros. Zastosovuєtsya vydalennya slidіv chloras po vіdbіlyuvannya audinių, Srіbla z rūdų tyrimui; є fiksavimas fotografijoje, reagentas jodometrijoje, trynimas esant užterštumui mish'yaku, gyvsidabriu, antikvapų metodas.
1 skaidrė
Sirka(IV) oksidas. Sieros rūgšties. Tatarstano Respublikos Almetjevsko savivaldybės rajono MBOU „Yelhovska ZOSH“ chemijos mokytojas Gafarova A.Z.

2 skaidrė
Meta pamoka: Pakartokite ir įtvirtinkite žinias apie rūgščių oksidų ir rūgščių galią. Pažvelkite į galią iš sirkos pusės – sieros dujos ir sieros rūgštis bei jogo druskos. Pažvelkite į sieros dujų įpurškimą dovkіllya, kad sveiki žmonės. vmіti pridėti lygias reakcijas molekuliniu požiūriu ir oksido-vandens procesų požiūriu. Moraliai ir estetiškai mokantis per daug vidurio.

3 skaidrė
Otrimanya oksidіv 1. Kalbų gavyba (rūgšties oksidavimas) a) paprastos kalbos Mg +O2=2MgO S+O2=SO2 b) lankstymo kalbos 2H2S+3O2=2H2O+2SO2 2. Lankstymo kalbų klojimas a) CaCO3=CaO+CO2 druskos b) bazės Cu (OH)2=CuO+H2O c) rūgštinės rūgštys H2SO3=H2O+SO2

4 skaidrė
1) Diena dega juodųjų pusmėnulių paviršiuje, kai ištirpsta sieros dujos arba sieros oksidas (IV) SO2 ir dažnai sieros oksidas (VI) SO3: S + O2 \u003d SO2 sieros oksidas (IV)

5 skaidrė
Sieros oksidas (IV) (grynos dujos) molekulinė formulė SO2 sieros oksidacijos stadijos (+4). Kovalentinis polinis ryšys Molekulinis kristalinė gardelė

6 skaidrė
Elektroninis svarstyklės 1) S-2 -6e → S+4 Oksidatorius O2+4e → 2O -2 Oksidatorius 2) S0 -4e → S+4 Oksidatorius O2+4e → 2O -2 Oksidatorius

7 skaidrė
Paskirta galia bus pakartota. D kartoti -? M (kartojimas) = 29 g/mol M (H2S) = 64 g/mol D rep = 64:29 = 2,21 D rep = 2,21

8 skaidrė
Sieros dujų pramonės manija. nuplikymas sirka arba sulfidai, daugiausia piritas: 4FeS2+ 11O2 = 2Fe2O3 + 8SO2 ZnS + O2 = ZnO + SO2

9 skaidrė
Sieros oksido (IV) gavimas laboratorinėse žievėse, įpurškiant stiprias rūgštis ant sulfito ir hidrosulfito. Sieros rūgštis, kuri ištirpsta - H2SO3 greitai skyla į SO2 ir H2O: Na2SO3 + H2SO4 = Na2SO4 + H2SO3 Taip pat koncentruota sieros rūgštis veikia mažai aktyvų metalą kaitinant Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O

10 skaidrės
Fizinė galia. Sieros oksidas (IV) arba sieros dujos normaliam protui yra bebarės dujos, turinčios būdingą aštrų kvapą (syrniko kvapas, kuris yra geras miegui), mažesnis nei 2 kartus svarbesnis kartojimui, skiriasi vandens. Otruyny. Atvėsęs iki -10 °C, išauga į nederlingą tėvynę. Disperguota vandenyje su sieros nestabilia rūgštimi, pasiskirstymas 11,5 g/100 g vandens esant 20 °C, mažėja didėjant temperatūrai. Taip pat yra etanolio, sieros rūgšties.

11 skaidrė

12 skaidrė
Cheminis rūgščių oksidų dominavimas CHEMINĖ RŪGŠČIŲ OKSIDŲ POLITIKA 1. Rūgšties oksidas + vanduo \u003d Rūgštis (p. z'ednannya) CO2 + H2O \u003d H2CO3, SiO2 - nereaguoja 2. Rūgšties oksidas + Bazė \u002O3 Silu0 + 3H2O 3. Bazinis oksidas + Rūgštinis oksidas \u003d Sil (p. z'єdnannya) CaO + SO2 \u003d CaSO3

13 skaidrė
Cheminė sieros oksido galia (IV) 1. Rūgšties oksidas + Vanduo = Rūgštis SO2 + H2O = H2SO3 2. Rūgšties oksidas + Luga = Sil + H2O SO2 + 2KOH = K2SO3 + H2O SO2 + 2OH - = SO3 2- + H2 oksidas + Rūgšties oksidas \u003d Sil CaO + SO2 \u003d CaSO3

14 skaidrė
Cheminis rūgščių dominavimas 1. Pakeiskite indikatoriaus paruošimą. 2. Reaguoti su metalais aktyvumo eilėje iki H2 (vikl. HNO3 -azoto rūgštis) Me + RŪGŠTIS = CIL + H2 (r. pakeitimas) 3. Su baziniais (amfoteriniais) oksidais MexOy + RŪGŠTIS = CIL + H2O (r. keitimas) 4. Reaguokite su bazėmis - neutralizacijos reakcija RŪGŠTIS + PIDSTAVI = CIL + H2O (ret. mainai) vaє eilėje: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 > H2CO3 > H2S > H2SiO3 . Priekinė odos rūgštis gali būti pašalinta nuo druskos atakos

15 skaidrė
Vienoda sieros rūgšties disociacija. H2SO3 → H+ + HSO3 - HSO3 - ↔ H+ + SO3 2- Vidutinio stiprumo Ce rūgštis, kuri randama tik vandens šaltiniuose. Vaughn pateikia 2 rūšių druskas: HSO3 – SO3 2-hidrosulfito sulfitą

16 skaidrė
Jakisnos reakcija ant sulfito. Druskos sąveika su stipria rūgštimi, su kuria matomos stipraus kvapo dujos Na2SO3+H2SO4=Na2SO4+S02 +H2O

17 skaidrė
Sieros oksido galios oksidacija (IV). 2H2S-2 + S +4O2 → 2H2O + 3S 0 S+4 +4е→ S0 Oksidatorius S-2 -2е→ S0 Vidnovnik

18 skaidrė
Darantis įtaką sieros oksido (IV) dominavimui 2SO2+ O2 = 2SO2 SO2 + Br2 + 2H2O = H2 SO4 + 2HBr 5 SO2 + 2KMn SO4 + 2H2O = 2H2SO4 + 2Mn SO4 + K2 SO4 S+4 -

19 skaidrė
Zastosuvannya sieros oksidas (IV). Didžioji dalis sieros oksido (IV) yra vijoklis sieros rūgšties gamybai. Vykoristovuєtsya taip pat kaip konservantas (charchovos priedas E220). Taigi, kadangi šias dujas varo mikroorganizmai, jomis rūkomos daržovės ir sandėliai. Sirkos oksidas (IV) yra vijoklis šiaudams, siūlėms ir pūkams apdoroti, todėl medžiagų negalima apdoroti chloru. Vynas taip pat registruotas kaip mažmenininkas laboratorijose. Sieros oksidas (IV) taip pat naudojamas įvairioms sieros rūgšties druskoms laikyti.

20 skaidrė
Fiziologinis aktyvumas ant organizmo. SO2 taip pat yra toksiškas. Apsinuodijimo sieros dujomis simptomai yra negyvas, kosulys, užkimimas, stiprus kutenimas gerklėje ir savotiškas atodūsis. Įkvepiant sieros dujas, didelė koncentracija - nuodai, judėjimo nesantaikos, sunkus kalimas, vėmimas ir priešiškos nabryak kojos sugebėjimas. Trumpai įkvėpdami stipriai paerzinkite, išgirskite kosulį ir kutenimą gerklėje. Tsіkavo, scho jautrumas SO2 taip pat skiriasi okremih žmonių, būtybių ir roslin. Taigi, vidutinė rožė yra didžiausias stiebas, atsižvelgiant į sieros dujų poveikį, beržas ir ąžuolas, mažiausiai - troyanda, pušis ir jalina.

21 skaidrė
Įtaka atmosferai. Įsikūrus didiesiems miestams, kaip viena iš pagrindinių atmosferą teršiančių dujų, buvo išleistas sieros dioksidas. Didžiausia problema – užterštumas pusėjimo periodu siera, kuri patenka į atmosferą degant anglims, pirminiam benzinui ir gamtinėms dujoms, taip pat verdant metalams ir susidaro sieros rūgštis. Antropogeninis zabrudnennya sirkoy vdvіchі perevishuyu natūralus. Sieros anhidridas rūgštėja laipsniškai oksiduojant sieros anhidridą, kai dalyvauja šviesa. Galutinis reakcijos produktas yra sieros rūgšties aerozolis povitrijoje, rozchin - medienos vandenyje (niūriame). Nukrenta su rudenį, jis rūgsta dirvožemio, zagostryu zahvoryuvannya laukinių būdų, pridedamas prie sveikų žmonių. Sieros rūgšties aerozolio iš dūmų dervų naudojimas chemijos pramonėje dažnai nurodomas esant mažam niūrumui ir dideliam vandens kiekiui. Tokių įmonių ataugos tankiai skamba varvančiomis nekrozinėmis liepsnomis, kurios nusėdo sieros rūgšties lašų kritulių vietose, kad būtų užtikrintas її buvimas reikiamoje terpėje istotnyh kіlkosti. Spalvotosios ir juodosios metalurgijos pirometalurgijos įmonės, taip pat šiluminė elektrinė plačiai išmeta į atmosferą dešimtis milijonų tonų sieros anhidrido. Didžiausios sieros dujų koncentracijos yra Pivnichny pivkul, ypač JAV, Europos, Kinijos, Rusijos europinėje dalyje ir Ukrainoje. Be pivdenniy pivkulі vmіst jogas yra žymiai mažesnis.

22 skaidrė
§12 p34 Nr. 5 pateikia vienodas jonines ir trumpalaikes jonines reakcijas. Dyakuyu už pamoką. Pamoka baigta.
Oksidacijos stadija +4 sirkai yra stabili ir pasireiškia tetrahalogenidais SHal 4, oksodihalogenidais SOHal 2, dioksidu SO 2 ir panašiais anijonais. Mes žinome sieros dioksido ir sieros rūgšties galią.
1.11.1. Sirka(IV) oksido Budovo molekules so2
Budovo molekulė SO 2 yra panaši į Budovo molekulę į ozoną. Apskritimo atomas persipirko sp 2 -hibridizacijos stotyje, orbitalių sukimosi forma yra teisinga trikotažas, molekulės forma yra viršūnė. Prie sirkos atomų nėra prijungta elektronų pora. Dovzhina jungtis S - O yra 0143 nm, valentinis pjūvis yra 119,5 °.
Budova patvirtina rezonansinių struktūrų atsiradimą:
Tuo pačiu metu kaip ir ozonas, S-O jungties dauginys yra lygus 2, taigi pagrindinis indėlis į pirmąją rezonansinę struktūrą. Molekulė įkvepia dėl didelio terminio stabilumo.
Fizinė galia
Išskirtiniams protams sieros dioksidas ir sieros dujos yra dujos be statinės, turinčios aštrų kvapą, lydymosi temperatūra -75 °С, virimo temperatūra -10 °С. Geras pasiskirstymas vandenyje, esant 20 ° C temperatūrai 1 tūryje vandens, pasiskirsto 40 tūrių rūgščių dujų. Toksiškos dujos.
Cheminis sieros oksido dominavimas (IV)
Sirchisty dujos yra labai reaktyvios. Sirkos dioksidas yra rūgštinis oksidas. Vіn dosit geras rozchinny šalia vandens su hydrativ patvirtinimo. Be to, vynai dažnai sąveikauja su vandeniu, patenkindami silpną sieros rūgštį, kuri nėra matoma individualiai:
SO 2 + H 2 O \u003d H 2 SO 3 \u003d H + + HSO 3 - \u003d 2H + + SO 3 2-.
Dėl disociacijos susidaro protonai, todėl vidurys yra rūgštus.
Kai į dujas panašus sieros dioksidas praleidžiamas per natrio hidroksidą, natrio sulfitas ištirpsta. Natrio sulfitas reaguoja su sieros dioksido pertekliumi ir ištirpdo natrio hidrosulfitą:
2NaOH + SO 2 = Na 2 SO 3 + H 2 O;
Na 2 SO 3 + SO 2 \u003d 2 NaHSO 3.
Sieringoms dujoms būdingas oksiduojančio vandens dvilypumas, pavyzdžiui, vin, įtakojanti galią, ignoruojant bromo vandenį:
SO 2 + Br 2 + 2H 2 O \u003d H 2 SO 4 + 2HBr
ir rozchino kalio permanganatas:
5SO 2 + 2 KMnO 4 + 2H 2 O \u003d 2KНSO 4 + 2 MnSO 4 + H 2 SO 4.
Oksiduotas rūgštus bevandenėje bevandenėje:
2SO 2 + O 2 \u003d 2SO 3.
Jėgos oksidai pasireiškia bendraujant su stipriais lyderiais, pavyzdžiui:
SO 2 + 2CO \u003d S + 2CO 2 (500 ° C temperatūroje, esant Al 2 O 3);
SO 2 + 2H 2 \u003d S + 2H 2 O.
Sieros oksido (ІV) gavimas
Spalyuvannya sirka ant grindų
S + O2 = SO2.
Sulfidų oksidacija
4FeS 2 + 11O 2 \u003d 2Fe 2 O 3 + 8SO 2.
Stiprių rūgščių diagnozė ant sulfitinių metalų
Na 2 SO 3 + 2H 2 SO 4 \u003d 2 NaHSO 4 + H 2 O + SO 2.
1.11.2. Sieros rūgštis ir її druskos
Kai sieros dioksidas ištirpsta vandenyje, ištirpsta silpna sieros rūgštis, pagrindinė ištirpusio SO 2 masė randama tariamai hidratuota forma SO 2 H 2 O, atvėsus taip pat matosi kristalohidratas, tik nedidelė dalis sieros rūgšties molekulės disocijuoja ant sulf t-i hidrosulfito-jonų. Laisvojoje stotyje rūgšties nematė.
Būdamas dvibazis, jis sudaro dviejų tipų druskas: vidurines - sulfitą ir rūgštines - hidrosulfitą. Vandenyje yra daugiau balų metalų sulfitų ir balų bei balų-žemės metalų hidrosulfitų.
