Sirka. Aplinkplaukimas. Sulfidas. Puslapis. Sieros oksidacijos etapai augaluose. Pusės dienos formulės
Kambario temperatūroje siera reaguoja tik su gyvsidabriu. Kylant temperatūrai, aktyvumas gerokai pakyla. Kaitinamas sirka beatodairiškai reaguoja su paprastų kalbų bagatma, su trupučiu inertinių dujų, azoto, seleno, telūro, aukso, platinos, iridžio ir jodo vyno. Sulfidas į azotą ir auksą pašalinamas netiesioginiu keliu.
Sąveika su metalais
Sirka rodo galios oksidus, todėl sąveikoje susidaro sulfidai:
Sąveika su vandeniu vіdbuvaetsya esant 150-200 ° С:
H 2 + S = H 2 S.
Sąveika su Kisnem
Deginti rūgstant 280 ° C temperatūroje, ugnyje 360 ° C temperatūroje, kuriai esant nustatoma oksidų suma:
S + O 2 \u003d SO 2;
2S + 3O 2 \u003d 2SO 3.
Sąveika su fosforu ir anglimi
Kaitinamas be prieigos, sirka reaguoja su fosforu, anglimi, parodydama oksido galią:
2P + 3S = P2S3;
Sąveika su fluoru
Stiprių oksidatorių buvimas rodo didelę galią:
S + 3F 2 = SF 6.
Sąveika su lankstymo kalbomis
Sąsajoje su lankstymo kalbomis sirka naudojama kaip vadovas:
S + 2HNO 3 \u003d 2NO + H 2 SO 4.
disproporcijos reakcija
Sirka zdatna prieš disproporcijos reakciją, sąveikaujant su pieva, nusėda sulfidai ir sulfitai:
3S + 6KOH \u003d K2S +4O3 + 2K2S-2 + 3H2O.
1.7. otrimannya sirki
Z vietinės rūdos
Kai šildomas piritas be oro prieigos
FeS 2 \u003d FeS + S.
Oksiduota sirvodnya su nedažyta rūgšta
2H 2 S + O 2 \u003d 2S + 2H 2 O.
3 dujos, patenkančios į metalurgijos ir kokso krosnis, kai kaitinamos esant katalizatoriui
H 2 S + SO 2 \u003d 2H 2 O + 3S.
1.8. cirko diena
Vodnev z'ednanya sirka - cirko diena H 2 S . Aplinkplaukimas yra kovalentinis ryšys. Vandens molekulė panaši į vandens molekulę, sirkos atomas yra sp 3-hibridizacijos būsenoje, vandens molekulė vandens molekulėje nesudaro tarp savęs vandens ryšių. Sirkos atomas mažiau elektronegatyvus, kuo žemesnis atomas rūgštus, tuo didesnis plėtimasis ir dėl to mažesnis krūvis. HSH valentinis pjūvis tampa 91,1 °, jungties H - S ilgis siekia 0,133 nm.
Fizinė galia
Esant normaliam protui, kraujotakos diena yra be statinės dujos, turinčios stiprų būdingą supuvusių kiaušinių kvapą. T pl \u003d -86 ° C, T kip \u003d -60 ° C, supuvęs vandenyje, 20 ° C temperatūroje 2,58 ml H 2 S paskirstoma 100 g vandens. Gamtoje jis matomas vulkaninių dujų sandėliuose, nusėda pūstant augantiems ir gyviems organizmams. Maloniai paskleisk prie vandens, sklaidydama darau silpną sirkovodny rūgštį.
Cheminė galia
Vandenyje vandens ciklas gali turėti silpnos dvibazės rūgšties galią:
H 2 S \u003d HS - + H +;
HS - \u003d S 2 + H +.
Sirkovoden dega danguje blakytnym polum'yam. Su tarpine prieiga ji vėl bus įsteigta nemokamai:
2H 2 S + O 2 \u003d 2H 2 O + 2S.
Jei pasiekiamas pasaulis, Sirkovodnya kalną reikia atnešti, kol jis ištirps sieros oksidu (IV):
2H 2 S + 3O 2 \u003d 2H 2 O + 2SO 2.
Aplinkplaukimas gali atnešti galios. Pūdymo vanduo gali oksiduotis vandens paskirstymasį sierą, sieros dujas ir sieros rūgštį.
Pavyzdžiui, vyne nėra bromo vandens:
H 2 S + Br 2 \u003d 2HBr + S.
sąveika su chloro vandeniu:
H 2 S + 4Cl 2 + 4H 2 O \u003d H 2 SO 4 + 8HCl.
Struminą galima kūrenti vietiniu švino dioksidu, nes reakciją lydi dideli karščio regėjimai:
3PbO 2 + 4H 2S \u003d 3PbS + SO 2 + 4H 2 O.
Abipusis bendradarbiavimas su sieros dujomis vikoristovuetsya sieros dujų gavybai, kuri apima metalurgijos ir sieros rūgšties gamybą:
SO 2 + 2H 2 S \u003d 3S + 2H 2 O.
Su šiuo procesu jis buvo susijęs su vietinės sirkos apšvietimu vulkaninių procesų metu.
Vieną valandą praleidžiant sieros dujas ir cirkuliuojantį vandenį, per pievos angą susidaro tiosulfatas:
4SO 2 + 2H 2S + 6NaOH \u003d 3Na 2S2O3 + 5H2O.
Sirka, її fizinės ir Cheminė galia. Biologinė sirka reikšmė, її zastosuvannya (demerkurizacija).
Siera gamtoje
gimtoji sirka
PbS - švino blisk
Cu 2S- vidutinis mirksėjimas
ZnS - cinko mišinys
FeS 2 - piritas, sirchani piritai, kačių auksas
H 2S- cirkuliuojantis vanduo (mineraliniame vandenyje ir gamtinėse dujose)
CaSO 4*2H2O- gipsas
MgSO 4*7H2O- gіrka sіl (anglų k.)
Na2SO4*10H2O- Glauberio stiprumas (mirabilitas)
Fizinė galia
Tvirta kristalinė geltonos spalvos kalba, vandenyje neryški, vanduo nesišlapina (plūduriuoja paviršiuje), t ° kip = 445 ° С.
Vienas iš ypatingų fiziniai autoritetai Sirki -flotacija, Sirkos granuliuotų miltelių pastatas išsisklaido, tada kaip її puikūs kristalai skęsta vandenyje. Dešinėje, tai, kad sirka nesišlapina vandeniu, o її dalelės yra apkarpytos vandens paviršiuje, kad rahunka priliptų prie jų sausų svogūnėlių.Tse vlastivist vikoristovuyut ne vіddіlennі gimtoji іrki vіd domіshok. Rūda susmulkinama, užpilama vandeniu ir iš apačios kas kart prapučiama, sirka nusausinama, namai paliekami parai.alotropija
Sirkai būdingas alotropinių modifikacijų šprotas, ir dažniausiai pasitaikantys vaizdai:rombinis (Krištolinis) , monoklinika(Golchasta)і plastmasinis .
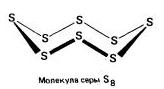
Rombas (a - sirka) - S8
t ° pl. = 113 °C; p \u003d 2,07 g / cm 3. Didžiausia modifikacija.
Monoklinika (b - sіrka) - S8
tamsiai geltonos galvos, t ° pl. = 119 °C; p = 1,96 g/cm3. stovėti aukštesnėje nei 96 °C temperatūroje; su laukiniais protais virsta rombu.
Plastmasinis S n
ruda humanoidinė (amorfinė) masė. Nestle, kai sukietėja, virsta rombu.
PLASTIKINIO CIRKO PAŠALINIMAS
Budovos atomas Sirki
Elektronikos pasiskirstymas pagal lygius ir polygius
pagrindinis malūnas
1s 2 2s 2 2p 6 3s 2 3p 4
Elektronikos platinimas pagal
orbitos (likęs rutulys)žingsniai
oksidacijavalentingumas
Daugiausia
Pirmoji pabudimo stovykla
Dar viena pabudimo stovykla
otrimannya sirki
1. Įsakomasis būdas – rūdos lydymas papildomam vandens garui.
2. Nevisiškai oksiduotas sіrkovodnya (kai nepakankamai rūgštus).
2H 2 S + O 2 \u003d 2S + 2H 2 O
3. Wakenroderio reakcija
2H 2 S + SO 2 \u003d 3S + 2H 2 O
Pasaulio galios chemija
Sirka – oksidatorius S 0 + 2→S-2 | Sirka - vadovas: S - 4g→ S+4; S - 6g→ S+6 |
1. Abipusis bendradarbiavimas zіusima su alavu ir luzhnozemelnym metalai, medus, gyvsidabris, sidabrasbe šildymo: 2 Na+S→ Na 2 S DOSVID S + Hg = HgS Gyvsidabris yra labai nepastovus. Nestatykite. Ši reakcija grindžiama gyvsidabrio naudojimu, pavyzdžiui, iš sugedusio medicininio termometro. Vieta, iš kurios neįmanoma ištraukti gyvsidabrio lašų, čiulbėti su sūkurine pudra. Sirka ir gyvsidabris reaguoja, kai jie uždaromi. Dėl to susidaro chemiškai inertiška ir netaupi kalba. Šis procesas vadinamas demerkurizacija 2. Abipusis bendradarbiavimasc kiti metalai (krim Au, Pt) judant t °: 2Al + 3S t → Al2S3 Zn+S t
°
→
ZnS DOSVID Cu+S t
→
CuS DOSVID 3. Sirkio sąveika susu tikrais nemetalais dvejetainis spolukas: H2+S→ H2S 2P+3S→ P 2 S 3 C+2S→ CS2 | 1. Sirkos sąveika su rūgštimi: S+O2 t ° → S +4 O 2 2 S + 3 O 2 t°; pt → 2 S +6 O 3 2. Abipusis bendradarbiavimasc halogenai (grietinėlė iki jodo): S + Cl2→ S +2 Cl 2 ** Abipusis bendradarbiavimasrūgštys - oksidatoriai: S + 2H 2 SO 4 (konc.)→ 3S +4 O2 + 2H2O S + 6HNO 3 (konc.)→ H2S +6O4 + 6NO2 + 2H2O ** Disproporcingumo reakcijos: 4. 3S0 + 6KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
zastosuvannya
Gumos vulkanizavimas, ebonito šalinimas, sieros rūgšties apdorojimas, parakas, kovojant su žemės ūkio valstybės shkidnikomis, medicininiais tikslais (sirchani tepalai odos ligoms gydyti), sieros rūgšties gydymui ir kt.
Namų darbai21 dalis; dešinė 1, 3, 4 pusės. 99-100.
papildoma konstrukcija
Užbaikite reakcijų išlyginimą, r Elektroninio balanso metodu nustatykite koeficientus, nurodykite oksidą, vandenį.
Nr. 2. Sukurkite schemos transformaciją:
Tse tsikavo...
- Pieno kiekis 70 kg sveriančio žmogaus organizme – 140 g.
- Dobu žmonėms reikia 1 g sirkos.
- Siroy turtingi žirniai, gira, baltas plastikas, kviečiai, mėsa, žuvis, vaisiai ir mangai.
- Sirka patekti į hormonų, vitaminų, baltymų, vandens sandėlį kremzliniame audinyje, plaukuose, naguose. Kai organizme pritrūksta sirkos, verkia nagai ir šepečiai, slenka plaukai.
Rūpinkitės savo sveikata!Tu žinai..
- Pusė sirkos gali būti gydomieji preparatai;
- Sirka – tepalo pagrindas grybelinėms odos ligoms gydyti, kovai su šašais. Natrio tiosulfatas Na 2S2O3 kovoti prieš ją.
- Turtingos sieros rūgšties druskos ir sulėtinantis kristalizacijos vanduo: ZnSO 4 × 7H 2 O ir CuSO 4 × 5H 2 O. Їх zastosovuyt kaip antiseptinis zasobi obraskuvannya roslin ir grūdų išsikišimas kovojant su kaimo valstybės skіdnik.
- Žieminis vitriolis FeSO 4×7H2 O vikoristas su anemija.
- BaSO4 zastosovuyt su latako ir žarnyno radiografiniais radiniais.
- Aliuminio kalio galonas KAI (SO 4) 2×12H2 O - kraujagyslės zasibas poringumu.
- Mineralas Na 2 SO 4 × 10H 2 O dėvėkite pavadinimą „Glauberio stiprybė“, pagerbdami vokiečių chemiko Glauberio I.R.Glaberio atradimą VIII amžiuje. Neturėjau nė akimirkos nieko valgyti; Vienas iš miesto gyventojų rodo jogą į dzherelį. Kaip tik kelis vynus, išgėręs girką sūraus vandens, iškart pasodinau. Glauberis baigė vandenį, iš jo išsikristalizavo Na stiprumas 2 SO 4 × 10H 2 O. Infekcija її zastosovuyut kaip rankinis bagažas medicinoje, prikimšant medvilninio popieriaus audinius. Taip pat stiprus žinojimas apie sąstingį sandėlio sandėlyje.
- Medis gali pakelti pastatą nuo žemės iki žemės ir paskatinti elemento molio susidarymą iš sausų ataugų.
- Laikrodininkas pamatė kalbą – albucid, їdke z'єdnanny sirki. Tsya kalba kovoja su vėžinėmis ligomis, pakelia seną, lenkia širdies ligas.
Sirka- Periodinės sistemos 3-iojo periodo ir VIA grupės elementas, serijos numeris 16, bus pristatytas iki chalkogenai. Atomo elektroninė formulė [10 Ne] 3s 2 3p 4, būdingos oksidacijos pakopos 0, -II, + IV i + VI, būsena S VI laikoma stabilia.
Sieros oksidacijos etapų skalė:
Sirkos elektronegatyvumas yra 2,60, jam būdinga nemetalinė galia. Vandeniniuose ir rūgščiuosiuose augaluose jų randama įvairių anijonų sandėliuose, rūgstant rūgščius ir jų druskas, dvinarius šliužus.
Gamtoje - penkiolika pagal cheminį elemento plotį (somis tarp nemetalų). Zustrichaetsya ne nemokamai (gimtoji) ir pov'yazanom išvaizdą. Gyvybė yra svarbus elementas kitiems organizmams.
Sirka S. Tik kalba. Zhovta kristalinė (α-rombinė ir β-monoklininė,
95,5 °C temperatūroje) arba amorfinis (plastikas). Kristalinės gardelės mazguose yra S 8 molekulės (neplokštieji „karūnos“ tipo žiedai), iš lancetų S n susidaro amorfinis ratas. Mažai tirpstanti kalba, skysčio klampumas maksimaliai praleidžiamas esant 200 ° C temperatūrai (atsidaro molekulės S 8, susipynusios lansai S n). Pora turi molekules S 8, S 6, S 4, S 2. 1500 ° C temperatūroje tai yra monatominė sirka (cheminiuose palyginimuose, kad būtų paprasčiau, sirka vaizduojama kaip S).
„Sirka“ nesiskiria vandeniu ir, esant kraštutiniam protui, su juo nereaguoja, gerai pasiskirsto anglies disulfide CS 2.
Sirka, ypač panaši į miltelius, gali turėti didelį aktyvumą kaitinant. Reaguoja kaip oksidatorius su metalais ir nemetalais:
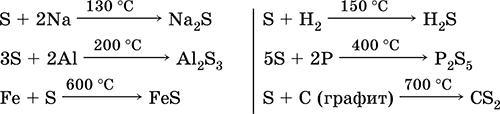
jakas vadovas- su fluoru, rūgštimi ir rūgštimis (verdant):
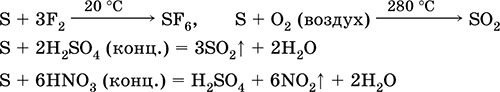
Pievose yra keletas dismutacijų:
3S 0 + 6KOH (konc.) \u003d 2K 2S -II + K 2 S IV O 3 + 3H 2 O
adresu aukštos temperatūros(400 °C) balkšvas jodas su vandenilio jodidu:
S + 2HI (g) \u003d I 2 + H 2 S,
ale skirtingose reakcijose
I 2 + H 2 S (p) = 2 HI + S ↓
otrimannya: V palaidumas išsilydo iš natūralių vietinės sieros telkinių (papildomam vandens garui), matomas desulfuruojant vougilio dujofikavimo produktus.
Sirka zastosovuєtsya sieros anglies, sieros rūgšties, sieros (vatos) barniki sintezei, gumos vulkanizavimo metu, kaip zasіb zahistu roslin pelkės rasoje, pūkuotų ligų gydymui.
Aplinkplaukimas H 2 S. rūgštinė rūgštis. Bezbarvny dujos su dusinančiu kvapu, svarbios pasikartojimui. Molekulė maє budovu dvіchі nebaigtas tetraedras [:: S (H) 2]
(Sp 3-hibridizacija, valet kut H - S-H tolimas tetraedro vaizdas). Nestabilus kaitinant iki 400 ° C. Šiek tiek tirpsta vandenyje (2,6 l / 1 l H 2 O esant 20 ° C), dešimtainių diapazonų diapazonas (0,1, "kasdienis vanduo"). Tai taip pat silpna rūgštis, praktiškai nesiskiria kitai stadijai iki S 2- jonų (didžiausia S 2 koncentracija lygi 1 10 -13 mol/l). Stovint ant drumstumo paviršiaus (inhibitorius – sacharozė). Jį neutralizuoja pievos, apskritai amoniako hidratas. Stiprus vadovas. Įeina į jonų mainų reakciją. Sulfidinanti medžiaga, apipjaustyta įvairiomis sulfido spalvomis, net ir nedidelėmis spalvomis.
yakіsnі reakcijos - sulfidų nusėdimas, taip pat netolygus H 2 S degimas geltonos sirkos infuzijos tirpalu ant šalto daikto, patraukto į pusžievę (porceliano mentele). Šalutinis pirminio benzino, gamtinių ir kokso krosnių dujų valymo produktas.
Jis sustingsta įvairiose sirkose, neorganinėse ir organinėse sirkovmsnyh kaip analitinis reagentas. Paviršutiniškai sumuštas. Svarbiausių reakcijų išlyginimas:
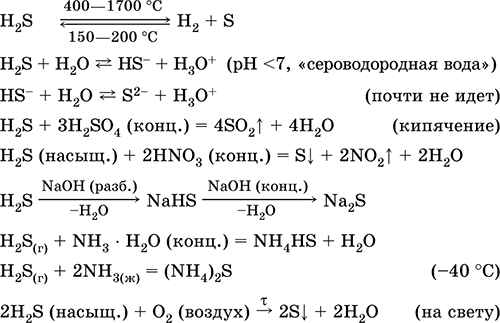

otrimannya: V palaidumas- tiesioginė sintezė:
H2 + S = H2S(150-200°C)
arba kaitinamas parafinu;
V laboratorijos- sulfidų virinimas stipriomis rūgštimis
FeS + 2НCl (konc.) = FeCl 2 + H2S
arba pakartotinai hidrolizuojant dvinarės plokštes:
Al 2 S 3 + 6H 2 O \u003d 2Al (OH) 3 ↓ + 3 H2S
Natrio sulfidas Na2S. Bezkisneva stiprybė. Baltas, higroskopiškesnis. Ištirpsta be plitimo, termiškai stabilus. Geras pasiskirstymas vandenyje, hidrolizuojamas anijonų, sukuriant stiprią terpę pasiskirstyme. Stovint ant paviršiaus drumstumo (stulpelis sirka) ir geltonas (polisulfido užterštumas). Tipiškas vadovas. Aš netrukus ateisiu. Įeina į jonų mainų reakciją.
yakіsnі reakcijos ant S 2- jono - skirtingų spalvų metalų sulfidų nusodinimas, iš kurių MnS, FeS, ZnS suskaidomi į HCl (iššifruojami).
Naudojamas sirchisto barvnikovo ir celiuliozės gamyboje, plaukų linijai šalinti, odos rauginamos, kaip analitinės chemijos reagentas.
Svarbiausių reakcijų išlyginimas:
Na 2 S + 2НCl (razb.) \u003d 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (konc.) \u003d SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (iki 50 ° C)
Na 2 S + 4HNO 3 (konc.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (akumuliacija.) = 2NaHS
Na 2S (t) + 2O 2 \u003d Na 2 SO 4 (aukštesnė nei 400 °C)
Na 2 S + 4H 2 O 2 (konc.) = Na 2 SO 4 + 4H 2 O
S 2+ M 2+ = MnS (thіlesnі.) ↓; FeS (juodas) ↓; ZnS (balta) ↓
S 2 + 2Ag + = Ag 2 S (juoda) ↓
S 2+ M 2+ \u003d CdS (zhovt.) ↓; PbS, CuS, HgS (juoda) ↓
3S 2 + 2Bi 3+ \u003d Bi 2 S 3 (trumpas – juodas) ↓
3S 2 + 6H 2 O + 2M 3+ = 3H 2S + 2M (OH) 3 ↓ (M = Al, Cr)
otrimannya V palaidumas- mineralo skrudinimas mirabilitas Na 2 SO 4 10Н 2 O dalyvaujant vodnovnikovui:
Na 2 SO 4 + 4H 2 \u003d Na 2 S + 4H 2 O (500 ° C, kat. Fe 2 O 3)
Na 2 SO 4 + 4C (koksas) \u003d Na 2 S + 4CO (800-1000 ° C)
Na 2 SO 4 + 4CO \u003d Na 2 S + 4CO 2 (600-700 ° C)
Aliuminio sulfidas Al 2 S 3. Bezkisneva stiprybė. Balta, nuoroda Al - S yra svarbesnė kovalentinė. Ištirpinkite neskleisdami po nereikalingu spaustuku N 2, jį lengva apversti. Skrudinant paviršius oksiduojasi. Povnistyu hidrolizuojamas vandeniu, nenusėskite dėl priežasties. Suyra su stipriomis rūgštimis. Zastosovuєtsya kaip įmonė dzherelo švarus sіrkovodnyu. Svarbiausių reakcijų išlyginimas:
Al 2 S 3 + 6H 2 O \u003d 2Al (OH) 3 ↓ + 3H 2 S (grynas)
Al 2 S 3 + 6НCl (razb.) \u003d 2AlCl 3 + 3H 2 S
Al 2S 3 + 24HNO 3 (konc.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (pakartokite) = 2Al 2 O 3 + 6SO 2 (700–800 ° C)
otrimannya: Aliuminio sąveika su išlydyta siera per kelias valandas kasdienio deguonies ir vandens gyvenimo:
2Al + 3S = AL 2 S 3(150-200°C)
Halės sulfidas (II) FeS. Bezkisneva stiprybė. Juoda-Sirija žalia spalva, ugniai atspari, plečiasi kaitinant vakuume. Vologomu tampa jautrus rūgštingumo taškui. Neatsiskiria vandenyje. Či nepatenka į apgultį, kai įlankoje (II) per dieną yra daug druskų. Suyra su rūgštimis. Ji sustingsta kaip syrovina prie čavuno virobnicos, tvirtos dzherelo sirkovodnya.
Z'ednannya (III) Fe 2 S 3 saugykla nežinoma (niekas nejautė).
Svarbiausių reakcijų išlyginimas:
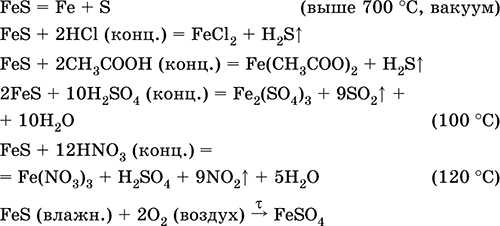
otrimanna:
Fe+S= FeS(600°C)
Fe2O3 + H2 + 2H2S \u003d 9 FeS+ 3H2O (700-1000°C)
FeCl 2 + 2NH 4 HS (skrybėl.) = FeS↓ + 2NH 4 Cl + H 2 S
Druskos disulfidas FeS 2. Dvejetainė pusė. Gegužės ionnu budova Fe 2+ (-S - S-) 2. Tamsiai geltona, atspari karščiui, skrudinant plečiasi. Netirpsta vandenyje, nereaguoja su atskiestomis rūgštimis, pievose. Suyra su oksiduojančiomis rūgštimis, piddaetsya vipalu ant paviršiaus. Jis sustingsta kaip sirovinas chavune, siera ir sieros rūgštis, organinės sintezės katalizatorius. Gamtoje – rūdos mineralai piritasі markazitas.
Svarbiausių reakcijų išlyginimas:
FeS 2 = FeS + S (aukštesnė 1170 °C, vakuumas)
2FeS 2 + 14H 2 SO 4 (konc., Gir.) \u003d Fe 2 (SO 4) 3 + 15SO 2 + 14H 2 O
FeS 2 + 18HNO 3 (konc.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (kartokite) = 8SO 2 + 2Fe 2 O 3 (800 ° C, vipal)
Amonio hidrosulfidas NH 4 HS. Kisneva rūgštus stiprumas. Balta, ištirpsta po nereikalinga yda. Velmy skraidantis, termiškai neatsparus. Paviršiuje jis oksiduojasi. Gerai pasiskirsto prie vandens, hidrolizuojasi katijonais ir anijonais (transportuoja), susidaro vidurio bala. Rozchin Zhovtіє ekrane. Plečiasi rūgštimis, plačiame diapazone ateina gurkšnis. Pievos NEneutralizuokite, vidutinio stiprumo (NH 4) 2 S asortimente nėra (išplaukite vidurinę druską, žr. antraštę "H 2 S"). Zastosovuєtsya kaip fotoryškiklių komponentas, kaip analitinis reagentas (sulfidų nusodintuvas).
Svarbiausių reakcijų išlyginimas:
NH 4 HS = NH 3 + H 2 S (aukštesnė nei 20 ° C)
NH 4 HS + HCl (diff.) \u003d NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (konc.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (rinkinys. H 2 S) + 2CuSO 4 \u003d (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
otrimannya: neklaužada koncentruotas NH 3 aplinkkelio navigacija:
NH 3 H 2 O (konc.) + H 2 S (g) = NH4HS+ H2O
Analitinėje chemijoje, norėdami subalansuoti vienodus NH 4 HS ir NH 3 H 2 O kiekius, protiškai įleiskite (NH 4) 2 S ir vikorato vidurinės druskos formulę į vienodų reakcijų įrašą, nors amonio sulfidas yra Pridedama hidrolizuojasi vandenyje iki NH 4 HS i NH 3 H 2 O.
Sirka yra geltonos spalvos kieta krištolinė kalba. Lydymosi temperatūra - 119C o, virimo temperatūra - 444,6C o.
Sirka yra alotropinių modifikacijų šprotas. Kristalinė sirka susidaro iš ciklinių molekulių S 8, kad susidarytų rombo forma. Ši modifikacija yra stabiliausia. Sirkos kristalizacijos metu iš lydalo iškyla pagrindinės kristalo dalys (vadinamoji monoklininė sirka). Esant maždaug 100 ° C temperatūrai, pro-monoklininė sirka virsta rombiniu (kristaliniu). Kai ištirpusi sirka supilama į šaltą vandenį, sirka yra plastikinė. Po slogios valandos plastikinė sirka persikristalizuoja ir vėl tampa kieta bei traški.
1800 C temperatūroje garai yra vienaatominiai. Sirka yra visiškai neiššifruojama vandenyje, pėdsakai neapibrėžti etilo alkoholyje ir benzene, o laipsnis neapibrėžtas anglies disulfide CS 2.
Taigi, kaip pastato sirkos atomas, jis atskleidžia daugybę oksidacijos etapų, tada į cheminės reakcijos sirka rodo dvilypumą, oksidaciją ir vіdnovnі, viešpatavimą. Taip pat gali būti neproporcingų reakcijų.

Sirkos kalnas
Kylant temperatūrai, didėja sirkos cheminis aktyvumas.
- Sąveika su Kisnem
Sirka atmosferoje lengvai rūgsta patvirtintu sirka 2 oksidu (sirchisty gas).
- Sąveika su vandeniu
Kai tik jis ištirpsta, jis lengvai pradeda sąveikauti su vandeniu, ištirpindamas dvokiančias dujas - H 2 S vandenį.
- Sąveika su kitais nemetalais
Sirka sureagavo su chloru su patvirtintu sirka chloridu 1 (sirka chloridu) buvo ištirpintas.

sirka chloridas
2S + Cl 2 \u003d S 2 Cl 2
Galima naudoti ir kitus sirki su chloru būdus: SCl 2, SCl 4.
Sirkos chloridai plinta vandeniu su rūgščių tirpalais.

Sąveikaujant su metalais, sirka rodo galios oksidus. Šiose reakcijose ištirpsta sulfidai.
2Al + 3S = Al 2S 3
- Sąveika su pievomis
Sirka lengvai reaguoja su pievomis
3S + 6KOH = K 2 SO 4 + 2K 2 S + 3H 2 O