Фізичні та хімічні властивості сірки. Сірка це
Розміщення електронів на орбіталях зовнішнього шару
Валентних електронів у атома сірки 6. Тому, СЕРА може утворювати до 6 валентних зв'язків. Атом сірки має більший радіус і тому виявляє меншу електронегативність порівняно з киснем. Ступені окислення, які може виявляти в окислювально-відновних реакціях: S 0 , S -2 , S +4 , S +6 .
■ 68. Напишіть рівняння реакцій сірки з простими речовинами, про які йдеться у прочитаному уривку, Чи є ці реакції окисно-відновними? Дайте відповідь.
69. Який ступінь окислення сірки у сполуках з воднем та металами?
70. Якого типу у з'єднаннях сірки з металами?
71. Чому цинку та алюмінію не можна отримати реакцією обміну в розчинах?
72. Скільки сульфіду заліза (II) вийде, якщо взято 30 г заліза та 16 г сірки та якщо взяте використовується лише на 90%?
Можливі й інші реакцій, внаслідок яких сірка набуває позитивних ступенів окислення. Зазвичай це буває за безпосередньої взаємодії сірки з киснем - при горінні сірки:
S + О2 = SO2
Оскільки у кисню величина електронегативності більша, ніж у сірки, у поєднанні SО2 сірка виявляє ступінь окислення +4 і в даній реакції веде себе як відновник. Більш глибоке окиснення води до ступеня окиснення +6 можливе при утворенні сірчаного ангідриду. У присутності каталізатора при температурі 400-500° двоокис сірки окислюється киснем, утворюючи сірчаний ангідрид:
2SО2 + О2 = 2SО3
Незважаючи на високу хімічну активність, сірка досить широко трапляється у вигляді мінералу, який називається самородною сіркою. Це майже виключно ромбічна сірка. Інші алотропні видозміни сірки у природі не зустрічаються.
Сірка зазвичай вкраплена в різні гірські породи, з яких легко може бути виплавлена. найчастіше має вулканічне походження. Багаті на Самородну сірку Кавказ, пустеля Кара-Кум, Керченський півострів, Узбекистан.
Сірка зустрічається також у вигляді сірчистих металів г-сульфідів (FeS2, цинкова обманка ZnS, свинцевий блиск PbS), у вигляді сульфатів (глауберова сіль Na2SO4 · 10H2O, CaSО4 · 2H2О). Сірка входить до складу деяких білків. Для того щоб витягти сірку з породи, її виплавляють в автоклавах. Дія перегрітої водяної пари при 150-160°. Отриману розплавлену сірку рафінують (очищають) сублімацією. Якщо її розплавити і розлити по дерев'яних формах, вона твердне у вигляді паличок. Таку сірку називають черешковою.
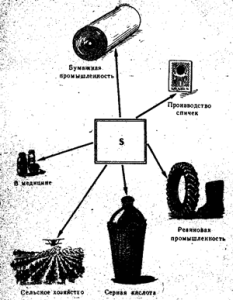
Мал. 52. Застосування сірки
Іноді сірку виливають у велику форму, а після затвердіння розколюють на дрібні шматочки. Така сірка називається комовою. Нарешті, сірку можна отримати у вигляді дрібного порошку розпиленого - так званого сірчаного кольору.
Вільна сірка застосовується головним чином у виробництві сірчаної кислоти, а також у паперовій промисловості, для вулканізації каучуку, у виробництві барвників, сільському господарствідля запилення та обкурювання винограду та бавовнику, у виробництві сірників (рис. 52). У медицині сірка використовується у вигляді мазей разом з іншими речовинами проти корости та інших захворювань шкіри. Чиста сірка не отруйна.
■ 73. Перерахуйте Хімічні властивостісірки я вкажіть, у чому подібність і в чому різниця сірки та кисню.
57. З'єднання двовалентної сірки
Двовалентна сірка утворює сполуки з воднем (H2S) та металами (Na2S, FeS). Сульфіди можна розглядати як похідні сірководню, тобто солі сірководневої кислоти.
Сірководень. Молекула сірководню побудована за полярним типом зв'язку:
Загальні електронні пари сильно зміщені у бік атома, сірки як електронегативного.
Сірководень-газ важчий за повітря, з різким неприємним запахом тухлих яєць. Цей газ дуже отруйний. Наші органи нюху дуже чутливі до сірководню. За наявності 1/2000 частини сірководню у повітрі може настати втрата нюху. Хронічне отруєння сірководнем у малих дозах викликає схуднення, головні болі. У разі більше сильних отруєньчерез деякий час може настати непритомність, а дуже сильні концентрації викликають смерть від паралічу дихання. При отруєннях сірководнем необхідно винести роль свіжого повітря і дати йому вдихати невеликі кількості хлору, а також чистий. Гранично допустима концентрація сірководню в робочому приміщенні 0,01 мг/л.
Сірководень перетворюється на рідкий стан при температурі -60°. Він добре розчиняється у воді, утворюючи при цьому сірководневу воду H2Saq або, як її ще називають, сірководневу кислоту.
Сірководень - один із найкращих відновників. Він легко відновлює бромну та хлорну воду вбромисто водневу або соляну кислоту:
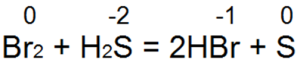
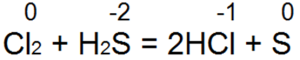
При цій реакції S(-2) окислюється до нейтральної сірки S(0).
Сірководень горить. При достатньому доступі повітря (рис. 53а) відбувається повне згоряння за рівнянням:
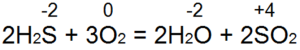
У цьому випадку S(-2) окислюється до S(+4), відбувається віддача 6 електронів), а відновлюється з О(0) до О(-2). Якщо
доступ повітря недостатній або якщо в полум'я сірководню внести холодний предмет (рис. 53,6), відбувається неповне згоряння за рівнянням:
2H2S + О2 = 2S + 2H2O
■ 74. Назвіть заходи першої допомоги при отруєннях сірководнем.
75. Чому сірководневу кислоту часто називають
сірководневою водою?
76. При змішуванні йодної води із сірководневою відбувається знебарвлення та помутніння розчину. Чим це пояснити?
77. Чи можливий для S(-2) прояв окисних властивостей?
У лабораторії сірководень отримують в апараті Кіппа при взаємодії сульфіду заліза (або сульфіду натрію) з розведеною сірчаною кислотою:
FeS + H2SO4 = FeSО4 + H2S

Мал. 53. Горіння сірководню при повному доступі повітря (а) та при неповному доступі повітря (б).
Сірководень, розчиняючись у воді, утворює слабку сірководневу кислоту, що дисоціює двоступінчасто:
H2S ⇄ Н + + HS - ⇄ 2Н + + S 2-
Другий ступінь протікає незначною мірою.
Сірководнева кислота не може зберігатися в лабораторії тривалий час через свою нестійкість. Вона поступово каламутніє внаслідок виділення вільної сірки:
H2S = H2 + S
В окислювально-відновних реакціях сірководнева кислота Поводиться як типовий відновник, наприклад:
H2S + К2Cr2O7 + H2SO4 → (S 0 ; Cr +3)
Рівняння цієї окислювально-відновної реакції закінчите самостійно.
Сірководень застосовується в аналітичній хімії.
Сірководнева кислота виявляє загальні властивостікислот. Щоправда, в повному обсязі властивості кислот вдається спостерігати у ньому. Наприклад, такі , як , з нею не реагують, а і , потрапляючи в сірководневу кислоту, реагують не з нею, а з наявною там водою, утворюючи луг, яка потім може вступити в реакцію з сірководневою кислотою. Так як це двоосновна кислота, вона може утворювати два ряди солей - сульфіди і гідросульфіди, або бісульфіди.
Середні солі сірководневої кислоти - сульфіди - нерозчинні у воді, крім солей натрію та калію, і мають різне забарвлення: сульфід свинцю та заліза - чорне, цинку - біле, кадмію - жовте. Гідросульфіди добре розчиняються у воді.
Реактивом на іон двовалентної сірки S 2 є іон кадмію Cd 2+ , який у з'єднанні з іоном дає жовтий, нерозчинний у воді осад, наприклад:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd 2+ + S 2- = CdS
Сульфіди досить легко гідролізуються на кшталт солей слабких кислот, тому зазвичай їх отримують прямою взаємодією сірки з металом.
■ 78. Напишіть рівняння реакції сірководневої кислоти з їдким натром і поясніть результат реакції з огляду на гідроліз солі в розчині.
79. У санітарно-гігієнічних дослідженнях для виявлення У повітрі сірководню користуються дуже чутливою реакцією із розчинними солями свинцю. Що можна спостерігати при цій реакції у повній іонній та скороченій іонній формах?
§ 58. З'єднання чотиривалентної сірки
З'єднання чотиривалентної сірки - двоокис сірки (сірчистий газ) SО2. Двоокис сірки важчий за повітря і має різкий неприємний запах. Молекула двоокису сірки побудована також за ковалентним типом зв'язку, полярність її слабо виражена. При -10° та атмосферному тиску двоокис сірки перетворюється на рідину, а твердне при -73°. Вона добре розчинна у воді (на 1 об'єм води 40 об'ємів двоокису сірки), при цьому поряд з розчиненням відбувається взаємодія з водою за рівнянням:
SO2 + Н2О H2SО3
Сірчиста кислота, що виходить, є дуже неміцною, тому реакція оборотна.
Двоокис сірки має велике промислове значення. Її отримують випалом сірчаного колчедану FeS2 або сірки:
4FeS2 + 11О2 = 2Fe2О3 + 8SО2 S + О2 = SО2
У лабораторії її отримують дією сильних кислот на солі сірчистої кислоти, наприклад дією сірчаної кислоти на:
Na2SO3 + H2SO4 = Na2SО4 + Н2О + SO2
Двоокис сірки можна отримати розкладанням солей сірчистої кислоти, наприклад, сульфіту кальцію CaSО3, при нагріванні;
CaSО3 = СаО + SO2
Двоокис сірки отруйна. При отруєння нею з'являються хрипоту, задишка, іноді втрата свідомості. Допустима концентрація SО2 у повітрі дорівнює 0,02 мг/л.
При взаємодії з органічними барвниками двоокис сірки може викликати їхнє знебарвлення, проте причина цього інша, ніж при знебарвленні хлором: не відбувається окислення, а виникає безбарвне з'єднання SО2 з барвником, яке з часом руйнується і забарвлення барвника відновлюється.
■ 80. Запропонуйте креслення приладів, за допомогою яких можна отримати двоокис сірки: а) із сульфіту натрію дією кислоти: б) прожарюванням сульфіту кальцію.
81. Двоокис сірки, отриману при розкладанні 40 г сульфіту кальцію, пропустили через 500 г розчину баритової води (ОН)2, в результаті чого весь , що знаходився в розчині, був обложений. Яка відсоткова баритова вода, якщо 20% двоокису сірки, отриманої при випаленні, втрачається?
82. До якої групи оксидів належить двоокис сірки? Перелічіть її властивості, типові цієї групи окислів. Підтвердьте відповідь рівняннями реакцій.
83. Чому при пропусканні СО2 через вапняну воду виникає помутніння, як і при пропусканні СО2?
84. Повітря має домішок двоокису сірки. Як звільнити його від цієї домішки?
85. Який обсяг двоокису сірки можна отримати з 20 молів FeS2 при 80% виході?
86. Через 200 мл 20% розчину їдкого натру було пропущено двоокис сірки до повного перетворення їдкого натру на сульфіт (гідроліз не враховувати). Яка концентрація розчину сульфіту натрію, що утворився?
У зв'язку з тим що ступінь окислення сірки в двоокисі сірки дорівнює + 4, тобто умовно із зовнішнього рівня атома сірки віддано 4 електрони, для нього існують дві можливості: або він може додатково віддати 2 електрони, що залишилися на зовнішньому шарі, і тоді проявить
властивості відновника, або S(+4) може прийняти деяку кількість електронів і буде проявляти окислювальні властивості.
Наприклад, у присутності сильного окислювача S(+4) поводиться як відновник.
Вr2 + Н2О + SO2 → H2SO4 + НВr
КМnO4 + Н2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
Коефіцієнти цих реакцій знайдіть самостійно.
Особливе значення має окислення двоокису сірки киснем у присутності каталізатора V2O5 або Pt при температурі 400-500°, внаслідок чого утворюється сірчаний ангідрид:
2SO2 + О2 = 2SO3
Цей процес широко використовується у виробництві сірчаної кислоти контактним способом.
У присутності сильних відновників, наприклад сірководню, S (+4) поводиться як окислювач: H2SO3+ H2S → Н2O + S
Знайдіть, склавши електронний баланс, коефіцієнти для рівняння.
■ 87. Запишіть у зошит фізичні та хімічні властивості двоокису сірки, відзначивши як реакції, що протікають без зміни ступенів окислення, так і окисно-відновні.
88. Яка фізіологічна дія двоокису сірки?
Як було сказано, при розчиненні двоокису сірки у питній воді утворюється сірчиста кислота.
Сірчиста кислота - кислота середньої сили. Вона дисоціює двоступінчасто:
H2SO3 ⇄ 2 Н + + HSO 3 - ⇄ 2Н + + SO 2 3 -
Сірчиста кислота нестійка, швидко розкладається на двоокис сірки та воду:
H2SO3 ⇄ H2O + SO2
Тому провести, наприклад, реакцію з металами більш активними, ніж з сірчистою кислотою не можна.
Будучи двоосновною, сірчиста кислота може утворювати два ряди солей: середні – сульфіти та кислі – гідросульфіти. Всі сульфіти є нерозчинними солями, за винятком сульфітів лужних металів та амонію. У гідросульфітів дещо вище. Ці солі можуть розкладатися під дією сильніших кислот:
Na2SOs + H2S04 = Na2SО4 + Н2О + SO2
2NaHSО3 + H2SO = Na2SО4 + 2H2О + 2SO2
При дії кислот на сульфіти виділяється двоокис сірки, що має неприємний запах. Цією реакцією користуються для того, щоб відрізнити сіль сірчистої кислоти від карбонатів, які поводяться аналогічно, але двоокис вуглецю запаху не має.
Сульфіти легко піддаються гідролізу.
§ 59. З'єднання шестивалентної сірки
Як згадувалося, при окисленні двоокису сірки утворюється сірчаний ангідрид SО3- з'єднання шестивалентної сірки. При освіті молекули сірчаного ангідриду в освіті валентних зв'язків беруть участь усі валентні електрони сірки, як s-,так і р-орбіталей. Ступінь окислення +6 для сірки є максимальною позитивною. Тому S+6 ніколи не може поводитися як відновник.
Сірчаний ангідрид - біла кристалічна речовина. Температура його плавлення 17°, температура кипіння 45°. Сірчаний ангідрид настільки гігроскопічний, що зберігати його у звичайному посуді не можна. Його зберігають у запаяних скляних ампулах.
Сірчаний ангідрид - кислотний оксид, що має всі типові властивості цієї групи речовин. Зокрема, він може реагувати з водою, утворюючи сірчану кислоту:
SО3 + Н2О = H2SО4
■ 89. Напишіть самостійно рівняння реакцій сірчаного ангідриду з основами та основними оксидами.
Сірчаний ангідрид є сильним окислювачем. Найбільш важливим з'єднанням шестивалентної сірки є H2SO4. Вона належить до сильних кислот. двоосновна та дисоціює двоступінчасто:
H2SО4 ⇄ Н + + HSО 4 - ⇄ 2Н + + SO 2 4 -

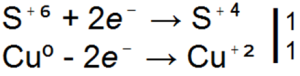
Концентрована сірчана кислота реагує з металами, активнішими, ніж водень, інакше, ніж розбавлена. наприклад, з концентрованої сірчаної кислоти не витісняє водень, а відновлює сірчану кислоту до двоокису сірки, вільної сірки або сірководню:
H2SO4 + Zn → ZnSO4 + SO2
H2SO4 + Zn → ZnSO4 + S
H2SO4 + Zn → ZnSO4 + H2S
■ 91. Усі три наведені рівняння реакцій сірчаної кислоти з цинком є окислювально-відновними. Розставте у них коефіцієнти з урахуванням електронного балансу.
Безводна сірчана кислота називається моногідрат. Моногідрат не містить іонів і тому не проводить електричний струм. Моногідрат добре поглинає вологу. Оскільки багато реакцій сірчаної кислоти з металами є іонними, моногідрат не вступає в реакцію з деякими металами, активнішими, ніж водень, наприклад із залізом, тому його можна перевозити в залізних цистернах. , стійкі до сірчаної кислоти у будь-яких концентраціях. Концентрована сірчана кислота окислює деякі неметали, наприклад .
■ 93. У чому подібність І відмінність сірчаної кислоти з іншими кислотами?
94. Чи можуть здійснюватися реакції, у яких сірчана кислота виявляла б відновлювальні властивості?
95. Як здійснити такі перетворення:

Напишіть рівняння відповідних реакцій. Для окисно-відновних складіть електронний баланс, рівняння іонних реакцій напишіть в іонній формі.
96. В одній склянці знаходиться розчин сірчаної кислоти, в іншій – азотної, у третій – соляної. Як їх розрізнити? 21
Сірка
СЕРА-и; ж.
1. хімічний елемент (S); легкозаймиста речовина жовтого кольору (застосовується в промисловості, військовій справі, сільському господарстві, медицині).
2. Жовта жирна речовина, що утворюється на стінках вушного каналу. Прочистити вуха від сірки.
◁ Сірний (див.).
сера(Лат. Sulfur), хімічний елемент VI групи періодичної системи. Жовті кристали. Стійка у двох модифікаціях - ромбічній (щільність 2,07 г/см 3 , tпл 112,8°C) і моноклинної (щільність 1,96 г/см 3 , tпл 119°C). У воді нерозчинна. На повітрі стійка; при горінні дає SO 2 з металами утворює сульфіди. У природі – самородна сірка, сульфіди, сульфати. Сірку виплавляють із самородних руд; отримують також окисленням киснем повітря сірководню, що міститься в природному, нафтовому, коксовому газах та іншими методами. Близько 50% сірки йде на одержання сірчаної кислоти, 25% - на одержання сульфітів (використовуються в паперовій промисловості), решта - для боротьби з хворобами рослин, вулканізації, синтезу барвників, виробництва сірників та ін.
СІРАСЕРА (лат. Sulfur), S, хімічний елемент з атомним номером 16, атомна маса 32,066. Хімічний символ сірки S вимовляється "ес". Природна сірка складається із чотирьох стабільних нуклідів. (див.НУКЛІД): 32 S (зміст 95,084% за масою), 33 S (0,74 %), 34 S (4,16%) та 36 S (0,016 %). Радіус атома сірки 0,104 нм. Радіуси іонів: іона S 2 – 0,170 нм (координаційне число 6), іона S 4+ 0,051 нм (координаційне число 6) та іона S 6+ 0,026 нм (координаційне число 4). Енергії послідовної іонізації нейтрального атома сірки від S 0 до S 6+ рівні, відповідно, 10,36, 23,35, 34,8, 47,3, 72,5 та 88,0 еВ. Сірка розташована в VIA групі періодичної системи Д. І. Менделєєва, в 3-му періоді, і належить до халькогенів. Конфігурація зовнішнього електронного шару 3 s 2
3p 4
. Найбільш характерними є ступеня окислення в сполуках –2, +4, +6 (валентності відповідно II, IV та VI). Значення електронегативності сірки за Полінгом 2,6. Сірка належить до неметалів.
У вільному виглядісірка є жовті крихкі кристали або жовтий порошок.
Історична довідка
Сірка зустрічається в природі у вільному (самородному) стані, тому вона була відома людині вже в давнину. Сірка привертала увагу характерним забарвленням, блакитним кольоромполум'я та специфічним запахом, що виникає при горінні (запах сірчистого газу). Вважалося, що сірка, що горить, відганяє нечисту силу. У Біблії йдеться про використання сірки для очищення грішників. У людини середньовіччя запах «сірки» асоціювався з пеклою. Застосування сірки для дезінфекції згадується Гомером. У Стародавньому Римі за допомогою сірчистого газу відбілювали тканини.
Здавна використовувалася сірка в медицині - її полум'ям обкурювали хворих, її включали до різних мазей для лікування шкірних захворювань. У 11 ст. Авіценна (Ібн Сіна (див.ІБН СИНА)), а потім і європейські алхіміки вважали, що метали, у тому числі золото і срібло, складаються з різних свідоцтв сірки і ртуті. Тому сірка відігравала важливу роль у спробах алхіміків знайти «філософський камінь» і перетворити недорогоцінні метали на дорогоцінні. У 16 ст. Парацельс (див.Парацельс)вважав сірку поряд із ртуттю та «сіллю» одним з основних «початків» природи, «душею» всіх тіл.
Практичне значення сірки різко зросло після того, як винайшли чорний порох (до складу якого обов'язково входить сірка). Візантійці 673 р., захищаючи Константинополь, спалили флот ворога з допомогою так званого грецького вогню - суміші селітри, сірки, смоли та інших речовин - полум'я якого гасилося водою. У середні віки у Європі застосовувався чорний порох, складом близький до суміші грецького вогню. З того часу почалося широке використання сірки для військових цілей.
Здавна було відоме і найважливіше з'єднання сірки - сірчана кислота. Один із творців ятрохімії (див.Ятрохімія), ченець Василь Валентин, 15 ст. докладно описав отримання сірчаної кислоти шляхом прожарювання залізного купоросу (стародавня назва сірчаної кислоти - купоросна олія).
Елементарну природу сірки встановив у 1789 р. А. Лавуазьє (див.Лавуазье Антуан Лоран). У назвах хімічних сполук, що містять сірку, часто міститься приставка «тіо» (наприклад, реактив Na 2 S 2 O 3, що застосовується у фотографії, має назву тіосульфат натрію). Походження цієї приставки пов'язане з грецькою назвою сірки – theion.
Знаходження у природі
Сірка досить поширена у природі. У земній корі її зміст оцінюється 0,05% за масою. У природі часто трапляються значні поклади самородної сірки (зазвичай поблизу вулканів); у Європі вони розташовані на півдні Італії, у Сицилії. Великі поклади самородної сірки є у США (в штатах Луїзіана та Техас), а також у Середній Азії, Японії, Мексиці. У природі сірка зустрічається як розсипами, і у вигляді кристалічних пластів, іноді утворюючи дивовижні по красі групи напівпрозорих жовтих кристалів (звані друзи).
У вулканічних місцевостях часто спостерігається виділення з-під землі сірководню газу H 2 S; у цих регіонах сірководень зустрічається в розчиненому вигляді в сірчаних водах. Вулканічні гази часто містять сірчистий газ SO 2 .
На поверхні нашої планети поширені родовища різних сульфідних сполук. Найчастіше серед них зустрічаються: залізний колчедан (пірит (див.ПІРИТ)) FeS 2 , мідний колчедан (халькопірит) CuFeS 2 , свинцевий блиск (див.ГАЛЕНІТ) PbS, кіновар (див.КІНОВАР) HgS, сфалерит (див.СФАЛЕРИТ) ZnS та його кристалічна модифікація вюртцит (див.ВЮРТЦИТ), антимоніт (див.АНТИМОНІТ) Sb 2 S 3 та інші. Відомі також численні родовища різних сульфатів, наприклад, сульфату кальцію (гіпс CaSO 4 ·2H 2 O та ангідрит CaSO 4), сульфату магнію MgSO 4 (гірка сіль), сульфату барію BaSO 4 (барит), сульфату стронцію SrSO 4 (целестин), сульфату натрію Na 2 SO 4 ·10H 2 O (мірабіліт) та ін.
Кам'яне вугілля містить у середньому 1,0-1,5% сірки. Сірка може входити до складу нафти. Ціла низка родовищ природного пального газу (наприклад, Астраханське) містять як домішок сірководень.
Сірка відноситься до елементів, які необхідні для живих організмів, оскільки вона є суттєвою складовою білків. Білки містять 0,8-2,4% (за масою) хімічно зв'язаної сірки. Рослини отримують сірку із сульфатів, що містяться у ґрунті. Неприємні запахи, що виникають при гниття трупів тварин, пояснюються головним чином виділенням сполук сірки (сірководню та меркаптанів) (див.ТІОЛИ)), що утворюються при розкладанні білків. У морській водіє близько 8,7·10 -2 % сірки.
Отримання
Сірку отримують переважно виплавляючи її з гірських порід, що містять самородну (елементарну) сірку. Так званий геотехнологічний спосіб дозволяє одержувати сірку без підйому руди на поверхню. Цей спосіб було запропоновано наприкінці 19 ст. американським хіміком Г. Фрашем, перед яким постало завдання вилучення на поверхню землі сірки з родовищ півдня США, де піщаний ґрунт різко ускладнював її видобуток традиційним шахтним методом.
Фраш запропонував використовувати для підйому сірки на поверхню перегріту водяну пару. Перегріту пару по трубі подають у підземний шар, що містить сірку. Сірка плавиться (її температура плавлення трохи нижче 120°С) і по трубі, розташованій усередині тієї, якою під землю закачують водяну пару, піднімається нагору. Для того щоб забезпечити підйом рідкої сірки, через найтоншу внутрішню трубу нагнітають стиснене повітря.
За іншим (термічним) методом, що набув особливого поширення на початку 20 ст. на Сицилії, сірку виплавляють, або виганяють, з подрібненої гірської породи у спеціальних глиняних печах.
Існують інші методи виділення самородної сірки з породи, наприклад, екстракцією сірковуглецем або флотаційними методами.
У зв'язку з тим, що потреба промисловості в сірці дуже велика, розроблені методи її отримання із сірководню H 2 S та сульфатів.
Метод окислення сірководню до елементарної сірки був вперше розроблений у Великобританії, де значні кількості сірки навчилися отримувати з соди Na 2 CO 3 за методом французького хіміка Н. Леблана, що залишається після отримання. (див.ЛЕБЛАН Нікола)сульфіду кальцію CaS. Метод Леблана заснований на відновленні сульфату натрію вугіллям у присутності вапняку CaCO3.
Na 2 SO 4 + 2C = Na 2 S + 2CO 2;
Na 2 S + CaCO 3 = Na 2 CO 3 + CaS.
Соду потім вилуговують водою, а водну суспензію погано розчинного сульфіду кальцію обробляють діоксидом вуглецю:
CaS + CO 2 + H 2 O = CaCO 3 + H 2 S
Сірководень H 2 S, що утворюється, в суміші з повітрям пропускають у печі над шаром каталізатора. При цьому за рахунок неповного окислення сірководню утворюється сірка:
2H 2 S + O 2 = 2H 2 O +2S
Аналогічний метод використовують для отримання елементарної сірки та із сірководню, супутнього природним газам.
Так як сучасна техніка потребує сірки високої чистоти, розроблені ефективні методирафінування сірки. При цьому використовують, зокрема, відмінності в хімічній поведінці сірки та домішок. Так, миш'як і селен видаляють, обробивши сірку сумішшю азотної та сірчаної кислот.
Використання методів, заснованих на дистиляції та ректифікації, вдається отримати високочисту сірку з вмістом домішок 10 -5 -10 -6 % за масою.
Фізичні та хімічні властивості
Атоми сірки мають унікальну здатність утворювати стійкі гомоцепи, тобто ланцюги, що складаються тільки з атомів S (енергія зв'язку S–S становить близько 260 кДж/моль). Гомоцепи сірки мають зигзагоподібну форму, тому що в їх освіті беруть участь електрони, розташовані в сусідніх атомах на перпендикулярних взаємно р-орбіталях. Ці ланцюги можуть досягати великої довжини, або, навпаки, утворювати замкнуті кільця S 20 , S 8 , S 6 , S 4 .
Тому сірка утворює кілька десятків як кристалічних, так і аморфних модифікацій, які відрізняються як складом молекул і полімерних ланцюгів, так і способом їх упаковки в твердому стані.
При нормальному тиску та температурах до 98,38 ° C стабільна a-модифікація сірки (інакше цю модифікацію називають ромбічної), що утворює лимонно-жовті кристали. Її кристалічна решіткаорторомбічна, параметри елементарного осередку a = 1,04646, b = 1,28660, c = 2,4486 нм. Щільність 2,07 кг/дм3. Вище 95,39 ° C стабільна b-модифікація сірки (так звана моноклінна сірка). При кімнатній температурі параметри елементарного осередку моноклинного b-S a = 1.090, b = 1.096, c = 1,102 нм, t = 83,27 °С. Щільність b-S 1,96 кг/дм3.
У структурах як a-, так і b-модифікацій сірки є непогані восьмичлен циклічні молекули S 8 . Такі молекули трохи схожі на корони.
Дві ці модифікації сірки відрізняються взаємною орієнтацієюмолекул S 8 у кристалічній решітці.
Ще одну модифікацію сірки - так звану ромбоедрическую сірку - можна отримати виливанням розчину тіосульфату натрію Na 2 S 2 O 3 концентровану соляну кислоту при 0 °C з подальшою екстракцією сірки толуолом (див.Толуол). Після випаровування розчинника виникають ромбоедричні кристали, що містять молекули S 6 у формі крісла.
Аморфну сірку (щільність 1,92 г/см 3) і гумоподібну пластичну сірку отримують при різкому охолодженні сірки розплавленої (виливаючи розплав в холодну воду). Ці модифікації складаються з нерегулярних звивистих ланцюгів S n . При тривалому витримуванні при температурах 20-95 ° C усі модифікації сірки перетворюються на a-сірку.
Температура плавлення ромбічної a-сірки 112,8 °С, а моноклинної b-сірки 119,3 °С. І в тому, і в іншому випадку утворюється легкорухлива жовта рідина, яка при температурі близько 160 С темніє; її в'язкість підвищується, і при температурі вище 200 ° С розплавлена сірка стає темно-коричневою та в'язкою, як смола. Це тим, що спочатку в розплаві руйнуються кільцеві молекули S 8 . Фрагменти, що виникають, поєднуються один з одним з утворенням довгих ланцюгів S µ з декількох сотень тисяч атомів. Подальше нагрівання розплавленої сірки (вища за температуру 250 °C) веде до часткового розриву ланцюгів, і рідина знову стає більш рухомою. На рис. показано температурну залежність в'язкості рідкої сірки. Близько 190 °C її в'язкість приблизно 9000 разів більше, ніж за 160 °C.
За температури 444,6 °C розплавлена сірка закипає. Залежно від температури в її парах можна виявити молекули S8, S6, S4 та S2. Зміна складу молекул викликає зміну забарвлення пари сірки від оранжево-жовтого до солом'яно-жовтого кольору. При температурі вище 1500 °C молекули S2 дисоціюють на атоми.
Молекули S 2 парамагнітні (див.ПАРАМАГНЕТИК)і побудовані аналогічно молекулі O2. У всіх інших станах сірка діамагнітна (див.ДІАМАГНЕТИК).
У воді сірка практично нерозчинна. Деякі її модифікації розчиняються в органічних рідинах (толуолі, бензолі) і особливо добре - в сірковуглецю CS 2 і рідкому аміаку NH 3 .
Сірка – досить активний неметал. Навіть при помірному нагріванні вона окислює багато простих речовин, але й сама досить легко окислюється киснем і галогенами.
S + O 2 = SO 2 , S + 3F 2 = SF 6
2S + Cl 2 = S 2 Cl 2 (з домішкою SCl 2)
З воднем при нагріванні сірка утворює сірководень H 2 S і в невеликій кількості сульфани (сполуки складу H 2 S n):
H2+S H2S.
Приклади реакцій сірки з металами:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
сульфіди, що утворюються в цих реакціях, характеризуються не постійним, а, як правило, змінним складом. Так, склад сульфіду кальцію може безперервно змінюватись у межах від CaS до CaS 5 . Полісульфіди типу СаS n або Na 2 S n при взаємодії, наприклад, із соляною кислотою утворюють сульфани H 2 S n, Причому значення n може становити від 1 до 10.
Концентрована сірчана кислота при нагріванні окислює сірку до SO 2
S + 2H 2 SO 4 = 2H 2 O + 3SO 2 .
Царська горілка (суміш азотної та соляної кислот) окислює сірку до сірчаної кислоти.
Розведена азотна кислота, соляна кислотабез окислювачів і сірчана кислота на холоді із сіркою у взаємодію не вступають. При нагріванні в киплячій воді або розчинах лугів сірка диспропорціонує:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Сірка може приєднуватися до сульфідів
Na 2 S + (n-1) S = Na 2 S n
і до сульфітів:
Na 2 SO 3 + S = Na 2 S 2 O 3
В результаті перебігу даної реакції з сульфіту натрію Na 2 SO 3 утворюється тіосульфат натрію Na 2 S 2 O 3 .
При нагріванні сірка реагує майже з усіма елементами, крім інертних газів, йоду, азоту, платини та золота.
Відомо кілька оксидів сірки. Крім стійких діоксиду сірки SO 2 [інші назви: сірчистий газ, сірчистий ангідрид, оксид сірки (IV)] і триоксиду сірки SO 3 [інші назви: сірчаний газ, сірчаний ангідрид, оксид сірки (VI)], отримані нестійкі оксиди S 2 O (при пропусканні струму SO 2 через тліючий розряд) і S 8 O ( при взаємодії H 2 S c SOCl 2). Пероксиди SO 4 і S 2 O 7 утворюються при пропусканні SO 2 суміші з киснем через тліючий розряд або за рахунок окислення SO 2 озоном.
Кислотному діоксиду сірки SO 2 відповідає нестійка кислота середньої сили H 2 SO 3 (сірчиста кислота):
Н 2 Про + SO 2 H 2 SO 3
а кислотного триоксиду сірки SO 3 - сильна двоосновна сірчана кислота (див.СІРЧАНА КИСЛОТА) H 2 SO 4:
SO 3 + H 2 O = H 2 SO 4
І сірчистої кислоти H 2 SO 3 і сірчаної H 2 SO 4 відповідають по два ряди солей: кислі [відповідно гідросульфіти NaHSO 3 , Ca(HSO 3) 2 та ін. і гідросульфати КНSO 4 , NaНSO 4 та інші] та середні [сульфіти Na 2 SO 3 K 2 SO 3 і сульфати CaSO 4 Fe 2 (SO 4) 3 ].
Сірка входить до складу багатьох органічних сполук (див. статті Тіофен (див.ТІОФЕН), Тіоли (див.ТІОЛИ)та інші).
Застосування
Близько половини сірки, що виробляється, використовується на виробництво сірчаної кислоти, близько 25% витрачається для отримання сульфітів, 10-15% - для боротьби зі шкідниками сільськогосподарських культур (головним чином винограду та бавовнику) (найбільше значення тут має розчин мідного купоросу CuSO 4 ·5H 2 O ), близько 10% використовується гумовою промисловістю для вулканізації гуми. Сірку застосовують при виробництві барвників та пігментів, вибухових речовин (вона досі входить до складу пороху), штучних волокон, люмінофорів (див.Люмінофори). Сірку використовують при виробництві сірників, тому що вона входить до складу, з якого виготовляють головки сірників. Сірку досі містять деякі мазі, якими лікують захворювання шкіри. Для надання сталям особливих властивостей у них вводять невеликі добавки сірки (хоча, як правило, домішка сірки небажана).
Біологічна роль
Сірка постійно присутня у всіх живих організмах, будучи важливим біогенним елементом (див.БІОГЕННІ ЕЛЕМЕНТИ). Її вміст у рослинах становить 0,3-1,2%, у тварин 0,5-2% ( морські організмимістять більше сірки, Чим наземні). Біологічне значення сірки визначається насамперед тим, що вона входить до складу амінокислот метіоніну (див.МЕТІОНІН)та цистеїну (див.Цистеїн)і, отже, до складу пептидів (див.ПЕПТИДИ)та білків. Дисульфідні зв'язки –S–S– у поліпетидних ланцюгах беруть участь у формуванні просторової структури білків, а сульфгідрильні групи (–SH) відіграють важливу роль в активних центрах ферментів. Крім того, сірка входить до молекул гормонів, важливих речовин. Багато сірки міститься в кератині волосся, кістках, нервовій тканині. Неорганічні сполуки сірки потрібні для мінерального живлення рослин. Вони служать субстратами окисних реакцій, що здійснюються поширеними у природі серобактеріями. (див.СЕРОБАКТЕРІЇ).
В організмі середньої людини (маса тіла 70 кг) міститься близько 1402 г сірки. Добова потреба дорослої людини у сірці – близько 4.
Однак за своїм негативним впливом на навколишнє середовищета людини сірка (точніше, її з'єднання) стоїть на одному з перших місць. Основне джерело забруднення сірої - спалювання кам'яного вугілля та інших видів палива, що містять сірку. При цьому близько 96% сірки, що міститься в паливі, потрапляє в атмосферу у вигляді сірчистого газу SO 2 .
У атмосфері сірчистий газ поступово окислюється до оксиду сірки (VI). Обидва оксиди - і оксид сірки (IV), і оксид сірки (VI) - взаємодіють із парами води з утворенням кислотного розчину. Потім ці розчини випадають як кислотних дощів. Опинившись у ґрунті, кислотні води пригнічують розвиток ґрунтової фауни та рослин. У результаті створюються несприятливі умови у розвиток рослинності, особливо у північних регіонах, де до суворого клімату додається хімічне забруднення. Внаслідок цього гинуть ліси, порушується трав'яний покрив, погіршується стан водойм. Кислотні дощі руйнують виготовлені з мармуру та інших матеріалів пам'ятники, більше того, вони спричиняють руйнування навіть кам'яних будівель та виробів із металів. Тому доводиться вживати різноманітних заходів щодо запобігання попаданню сполук сірки з палива в атмосферу. Для цього піддають очищенню від сполук сірки нафту і нафтопродукти, очищають гази, що утворюються при спалюванні палива.
Сама по собі сірка у вигляді пилу дратує слизові оболонки, органи дихання та може викликати серйозні захворювання. ГДК сірки повітря 0,07 мг/м 3 .
Жінки. одна з простих (нескладних, нерозкладних) речовин, плавка і сильно палива викопна вулканічного народження; як товар, звуть її: сірка палива. Порох робиться із селітри та сірки, з вугіллям. Живцева сірка, відлита паличками. | Сірка, сірка... Тлумачний словникДаля
СІРА- СЕРА, Sulfur, хім. елемент VІ гр. Менделєєвської системи, символ S, порядковий номер 16, ат. в. 32,07. Відома з найдавніших часів. У природі зустрічається у вигляді покладів водного (нептунічного) та вулканічного. походження. Зустрічається також у … Велика медична енциклопедія
СІРА- Хім. елемент, символ S (лат. Sulfur), ат. н. 16, ат. м. 32,06. Існує у вигляді кількох алотропних модифікацій; серед них сірка моноклинної модифікації (щільність 1960 кг/м3, tпл = 119°С) та ромбічна сірка (щільність 2070 кг/м3, ίπι = 112,8… Велика політехнічна енциклопедія
- (позначається S), хімічний елемент VI групи ПЕРІОДИЧНОЇ ТАБЛИЦІ, неметал, відомий з давніх-давен. Зустрічається у природі як у вигляді окремого елемента, так і у вигляді сульфідних мінералів, таких як ГАЛЕНІТ і ПІРИТ, і сульфатних мінералів, … Науково-технічний енциклопедичний словник
У міфології ірландських кельтів Сірка отець Парталона (див. розділ 6). Згідно з деякими джерелами, саме Сірка, а не Парталон був чоловіком Ділгнейд. (
