Сірка. Сірководень. Сульфіди. Сполуки сірки. Ступені окислення сірки в з'єднаннях. Формули сполуки сірки
При кімнатній температурі сірка вступає в реакції тільки з ртуттю. З підвищенням температури її активність значно підвищується. При нагріванні сірка безпосередньо реагує з багатьма простими речовинами, за винятком інертних газів, азоту, селену, телуру, золота, платини, іридію і йоду. Сульфіди азоту і золота отримані непрямим шляхом.
Взаємодія з металами
Сірка виявляє окисні властивості, в результаті взаємодії утворюються сульфіди:
Взаємодія з воднем відбувається при 150-200 ° С:
H 2 + S = H 2 S.
Взаємодія з киснем
Сірка горить у кисні при 280 ° С, на повітрі при 360 ° С, при цьому утворюється суміш оксидів:
S + O 2 = SO 2;
2S + 3O 2 = 2SO 3.
Взаємодія з фосфором і вуглецем
При нагріванні без доступу повітря сірка реагує з фосфором, вуглецем, проявляючи окисні властивості:
2P + 3S = P 2 S 3;
Взаємодія з фтором
У присутності сильних окислювачів проявляє відновні властивості:
S + 3F 2 = SF 6.
Взаємодія зі складними речовинами
При взаємодії зі складними речовинами сірка поводиться як відновник:
S + 2HNO 3 = 2NO + H 2 SO 4.
реакція диспропорціонування
Сірка здатна до реакцій диспропорціонування, при взаємодії з лугом утворюються сульфіди і сульфіти:
3S + 6KOH = K 2 S +4 O 3 + 2K 2 S -2 + 3H 2 O.
1.7. отримання сірки
З самородні руд
При нагріванні піриту без доступу повітря
FeS 2 = FeS + S.
Окисленням сірководню при нестачі кисню
2H 2 S + O 2 = 2S + 2H 2 O.
З газів, що відходять металургійних і коксових печей, при нагріванні в присутності каталізатора
H 2 S + SO 2 = 2H 2 O + 3S.
1.8. сірководень
Водневе з'єднання сірки - сірководень H 2 S . Сірководень - ковалентное з'єднання. Будова молекули аналогічна будові молекули води, атом сірки знаходиться в стані sp 3-гібридизації, проте на відміну від води молекули сірководню не утворюють між собою водневих зв'язків. Атом сірки менш електронегативний, ніж атом кисню, має більший розмір і, як наслідок, меншу щільність заряду. Валентний кут HSH становить 91,1 °, довжина зв'язку H - S дорівнює 0,133 нм.
Фізичні властивості
При звичайних умовах сірководень - безбарвний газ, з сильним характерним запахом тухлих яєць. Тпл = -86 ° С, Ткип = -60 ° С, погано розчинний у воді, при 20 ° С в 100 г води розчиняється 2,58 мл H 2 S. Дуже отруйний, при вдиханні викликає параліч, що може привести до смертельного результату. У природі виділяється в складі вулканічних газів, утворюється при гнитті рослинних і тваринних організмів. Добре розчинний у воді, при розчиненні утворює слабку сірководневу кислоту.
Хімічні властивості
У водному розчині сірководень має властивості слабкої двухосновной кислоти:
H 2 S = HS - + H +;
HS - = S 2 + H +.
Сірководень горить в повітрі блакитним полум'ям. При обмеженому доступі повітря утворюється вільна сірка:
2H 2 S + O 2 = 2H 2 O + 2S.
При надмірному доступі повітря горіння сірководню призводить до утворення оксиду сірки (IV):
2H 2 S + 3O 2 = 2H 2 O + 2SО 2.
Сірководень має відновлювальні властивості. Залежно від умов сірководень може окислюватися в водному розчинідо сірки, сірчистого газу та сірчаної кислоти.
Наприклад, він знебарвлює бромную воду:
H 2 S + Br 2 = 2HBr + S.
взаємодіє з хлорним водою:
H 2 S + 4Cl 2 + 4H 2 O = H 2 SO 4 + 8HCl.
Струмінь сірководню можна підпалити, використовуючи діоксид свинцю, так як реакція супроводжується великим виділенням тепла:
3PbO 2 + 4H 2 S = 3PbS + SO 2 + 4H 2 O.
Взаємодія сірководню з сірчистим газом використовується для отримання сірки з газів, що відходять металургійного і сірчанокислого виробництва:
SO 2 + 2H 2 S = 3S + 2H 2 O.
З цим процесом пов'язано освіту самородної сірки при вулканічних процесах.
При одночасному пропущенні сірчистого газу і сірководню через розчин лугу утворюється тіосульфат:
4SO 2 + 2H 2 S + 6NaOH = 3Na 2 S 2 O 3 + 5H 2 O.
Сірка, її фізичні і Хімічні властивості. Біологічне значення сірки, її застосування (демеркуризацію).
Cера в природі
самородна сірка
PbS - свинцевий блиск
Cu 2 S- мідний блиск
ZnS - цинкова обманка
FeS 2 - пірит, сірчаний колчедан, котяче золото
H 2 S- сірководень (в мінеральних джерелах і природному газі)
CaSO 4 * 2H2 O- гіпс
MgSO 4 * 7H2 O- гірка сіль (англійська)
Na 2 SO 4 * 10 H 2 O- глауберової сіль (мирабилит)
Фізичні властивості
Тверда кристалічна речовина жовтого кольору, нерозчинні у воді, водою не змочується (плаває на поверхні), t ° кип = 445 ° С.
Одне з особливих фізичних властивостейсірки -флотация, Здатність дрібного порошку сірки спливати, тоді, як її великі кристали тонуть у воді. Справа в тому, що сірка не змочується водою, і її частинки тримаються на поверхні води за рахунок прилипли до них дрібних бульбашок повітря.Це властивість використовують при відділенні самородної сірки від домішок. Руду розмелюють, заливають водою, а знизу продувають повітрям, сірка спливає, а домішки залишаються на дні.аллотропия
Для сірки характерні кілька аллотропних модифікацій, але найбільш відомі видозміни:ромбическая (Кристалічна) , моноклінна(Голчаста)і пластична .
Ромбическая (a - сірка) - S 8
t ° пл. = 113 ° C; ρ = 2,07 г / см 3. Найбільш стійка модифікація.
Моноклінна (b - сірка) - S 8
темно-жовті голки, t ° пл. = 119 ° C; ρ = 1,96 г / см3. Стійка при температурі понад 96 ° С; при звичайних умовах перетворюється на ромбічну.
Пластична S n
коричнева гумоподібний (аморфна) маса. Нестійка, при затвердінні перетворюється на ромбічну.
ОТРИМАННЯ ПЛАСТИЧНОЇ сірки
Будова атома сірки
Розміщення електронів по рівням і подуровням
основний стан
1s 2 2s 2 2p 6 3s 2 3p 4
Розміщення електронів по
орбиталям (останній шар)ступінь
окисленнявалентність
В основному стані
Перше збуджений стан
Друге збуджений стан
отримання сірки
1. Промисловий метод - виплавлення з руди за допомогою водяної пари.
2. Неповне окислення сірководню (при нестачі кисню).
2H 2 S + O 2 = 2S + 2H 2 O
3. Реакція Вакенродера
2H 2 S + SO 2 = 3S + 2H 2 O
Хімічні властивості сірки
Сірка - окислювач S 0 + 2ē→ S -2 | сірка - відновник: S - 4ē→ S +4; S - 6ē→ S +6 |
1. Взаємодія сіркизіусіма лужними і лужноземельними металами, міддю, ртуттю, срібломбез нагрівання: 2 Na + S→ Na 2 S ДОСВІД S + Hg = HgS Ртуть має високу летючість. Її пари отруйні. Ця реакція лежить в основі видалення та знешкодження ртуті, наприклад з розбитого медичного термометра. Місця, з яких не можна витягти крапельки ртуті, засипають порошком сірки. Сірка і ртуть вступають в реакцію при зіткненні. В результаті утворюється хімічно інертне і нешкідливу речовину. Цей процес називається демеркуризації 2. Взаємодія сіркиc іншими металами (крім Au, Pt) при підвищеній t °: 2Al + 3S t → Al 2 S 3 Zn + S t
°
→
ZnS ДОСВІД Cu + S t
→
CuS ДОСВІД 3. Взаємодія сірки здеякими неметалами з утворенням бінарних сполук: H 2 + S→ H 2 S 2P + 3S→ P 2 S 3 C + 2S→ CS 2 | 1. Взаємодія сірки c киснем: S + O 2 t ° → S +4 O 2 2 S + 3 O 2 t °; pt → 2 S +6 O 3 2. Взаємодія сіркиc галогенами (крім йоду): S + Cl 2→ S +2 Cl 2 ** Взаємодія сірки зкислотами - окислювачами: S + 2H 2 SO 4 (конц)→ 3S +4 O 2 + 2H 2 O S + 6HNO 3 (конц)→ H 2 S +6 O 4 + 6NO 2 + 2H 2 O ** Реакції диспропорціонування: 4. 3 S 0 + 6 KOH→ K 2 S +4 O 3 + 2 K 2 S -2 + 3 H 2 O |
застосування
Вулканізація каучуку, отримання ебоніту, виробництво сірників, пороху, в боротьбі з шкідниками сільського господарства, для медичних цілей (сірчані мазі для лікування шкірних захворювань), для отримання сірчаної кислоти і т.д.
Домашнє завданняпараграф 21; вправи 1, 3, 4 стор. 99-100.
додаткові зхаданія
Закінчите рівняння реакцій, р асставьте коефіцієнти методом електронного балансу, вкажіть окисник, відновник.
№2. Здійсніть перетворення за схемою:
Це цікаво...
- Вміст сірки в організмі людини масою 70 кг - 140 г.
- У добу людині необхідно 1 г сірки.
- Сірої багаті горох, квасоля, вівсяні пластівці, пшениця, м'ясо, риба, плоди і сік манго.
- Сірка входить до складу гормонів, вітамінів, білків, вона є в хрящової тканини, в волоссі, нігтях. При нестачі сірки в організмі спостерігається крихкість нігтів і кісток, випадання волосся.
Слідкуйте за своїм здоров'ям!Чи знаєте ви..
- Сполуки сірки можуть служити лікарськими препаратами;
- Сірка - основа мазі для лікування грибкових захворювань шкіри, для боротьби з коростою. Тіосульфат натрію Na 2 S 2 O 3 використовується для боротьби з нею.
- Багато солі сірчаної кислоти містять кристалізаційну воду: ZnSO 4 × 7H 2 O і CuSO 4 × 5H 2 O. Їх застосовують як антисептичні засоби для обприскування рослин і протруєння зерна в боротьбі з шкідниками сільського господарства.
- Залізний купорос FeSO 4 × 7H 2 O використовують при анемії.
- BaSO 4 застосовують при рентгенографічних досліджень шлунка і кишечника.
- Алюмокалієві галун KAI (SO 4) 2 × 12H 2 O - кровоспинний засіб при порізах.
- Мінерал Na 2 SO 4 × 10H 2 O носить назву «глауберової сіль» на честь відкрив його в VIII столітті німецького хіміка Глаубера І.Р.Глаубер під час своєї подорожі раптово захворів. Він нічого не міг їсти, шлунок відмовлявся приймати їжу. Один з місцевих жителів направив його до джерела. Як тільки він випив гірку солону воду, відразу почав їсти. Глаубер досліджував цю воду, з неї викристалізувалася сіль Na 2 SO 4 × 10H 2 O. Зараз її застосовують як проносне в медицині, при фарбуванні хлопчато- паперових тканин. Сіль також знаходить застосування у виробництві скла.
- Деревій має підвищену здатність витягувати з грунту сірку і стимулювати поглинання цього елемента з сусідніми рослинами.
- Часник виділяє речовину - альбуцид, їдке з'єднання сірки. Ця речовина запобігає ракові захворювання, уповільнює старіння, попереджає серцеві захворювання.
сірка- елемент 3-го періоду і VIA-групи Періодичної системи, порядковий номер 16, відноситься до халькогенам.Електронна формула атома [10 Ne] 3s 2 3p 4, характерні ступені окислення 0, -II, + IV і + VI, стан S VI вважається стійким.
Шкала ступенів окислення сірки:
Електронегативність сірки дорівнює 2,60, для неї характерні неметалеві властивості. У водневих і кисневих з'єднаннях знаходиться в складі різних аніонів, утворює кисень кислоти і їх солі, бінарні сполуки.
В природі - п'ятнадцятийпо хімічній поширеності елемент (сьомий серед неметалів). Зустрічається у вільному (самородному) і пов'язаному вигляді. Життєво важливий елемент для вищих організмів.
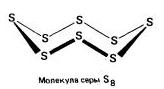
Сірка S.Проста речовина. Жовта кристалічна (α-ромбічна і β-моноклінна,
при 95,5 ° C) або аморфна (пластична). У вузлах кристалічної решітки знаходяться молекули S 8 (неплоскі цикли типу «корона»), аморфна сірка складається з ланцюгів S n. Низькоплавких речовина, в'язкість рідини проходить через максимум при 200 ° C (розрив молекул S 8, переплетення ланцюгів S n). У парі - молекули S 8, S 6, S 4, S 2. При 1500 ° C з'являється одноатомна сірка (в хімічних рівняннях для простоти будь-яка сірка зображується як S).
Сірка не розчиняється у воді і при звичайних умовах не реагує з нею, добре розчинна в сероуглероде CS 2.
Сірка, особливо порошкоподібна, має високу активність при нагріванні. Реагує як окислювач з металами і неметалами:
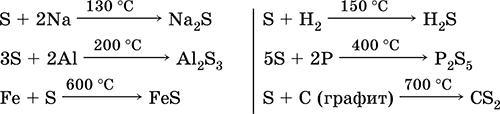
а як відновник- з фтором, киснем і кислотами (при кип'ятінні):
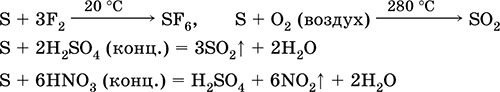
Сірка піддається дисмутації в розчинах лугів:
3S 0 + 6КОН (конц.) = 2K 2 S -II + K 2 S IV O 3 + 3H 2 O
при високій температурі(400 ° C) сірка витісняє йод з иодоводорода:
S + 2НI (г) = I 2 + H 2 S,
але в розчині реакція йде у зворотний бік:
I 2 + H 2 S (p) = 2 HI + S ↓
отримання: в промисловостівиплавляється з природних покладів самородної сірки (за допомогою водяної пари), виділяється при десульфурації продуктів газифікації вугілля.
Сірка застосовується для синтезу сірковуглецю, сірчаної кислоти, сірчистих (кубових) барвників, при вулканізації каучуку, як засіб захисту рослин від борошнистої роси, для лікування шкірних захворювань.
Сірководень H 2 S.Безкиснева кислота. Безбарвний газ з задушливим запахом, важчий за повітря. Молекула має будову двічі незавершеного тетраедра [:: S (H) 2]
(Sp 3-гібридизація, валетний кут Н - S-Н далекий від тетраедричного). Нестійкий при нагріванні вище 400 ° C. Малорастворим в воді (2,6 л / 1 л Н 2 O при 20 ° C), насичений розчин децімолярний (0,1, «сірководнева вода»). Дуже слабка кислота в розчині, практично не дисоціює за другий стадії до іонів S 2- (максимальна концентрація S 2 рівна 1 10 -13 моль / л). При стоянні на повітрі розчин мутніє (інгібітор - сахароза). Нейтралізується лугами, в повному обсязі - гидратом аміаку. Сильний відновник. Вступає в реакції іонного обміну. Сульфидирующих агент, тримає в облозі з розчину разноокрашенние сульфіди з дуже малою розчинністю.
якісні реакції - осадження сульфідів, а також неповне згоряння H 2 S з утворенням жовтого нальоту сірки на внесеному в полум'я холодному предметі (фарфоровий шпатель). Побічний продукт очищення нафти, природного і коксового газу.
Застосовується у виробництві сірки, неорганічних і органічних сірковмісних сполук як аналітичний реагент. Надзвичайно отруйний. Рівняння найважливіших реакцій:
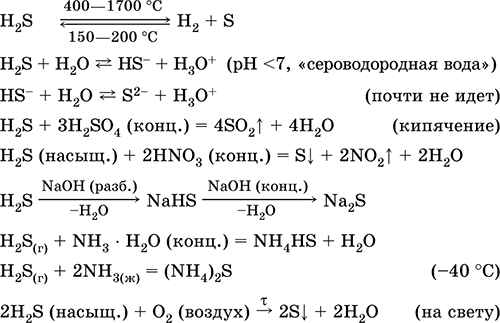

отримання: в промисловості- прямим синтезом:
Н 2 + S = H 2 S(150-200 ° C)
або при нагріванні сірки з парафіном;
в лабораторії- витісненням з сульфідів сильними кислотами
FeS + 2НCl (конц.) = FeCl 2 + H 2 S
або повним гідролізом бінарних сполук:
Al 2 S 3 + 6Н 2 O = 2Al (OH) 3 ↓ + 3 H 2 S
Сульфід натрію Na 2 S.Безкиснева сіль. Білий, дуже гігроскопічний. Плавиться без розкладання, термічно стійкий. Добре розчинний у воді, гідролізується за аніоном, створює в розчині сильнолужну середу. При стоянні на повітрі розчин мутніє (колоїдна сірка) і жовтіє (забарвлення полісульфіду). Типовий відновник. Приєднує сірку. Вступає в реакції іонного обміну.
якісні реакціїна іон S 2- - осадження разноокрашенних сульфідів металів, з яких MnS, FeS, ZnS розкладаються в НCl (разб.).
Застосовується у виробництві сірчистих барвників і целюлози, для видалення волосяного покриву шкір під час дублення шкір, як реагент в аналітичній хімії.
Рівняння найважливіших реакцій:
Na 2 S + 2НCl (разб.) = 2NaCl + H 2 S
Na 2 S + 3H 2 SO 4 (конц.) = SO 2 + S ↓ + 2H 2 O + 2NaHSO 4 (до 50 ° C)
Na 2 S + 4HNO 3 (конц.) = 2NO + S ↓ + 2H 2 O + 2NaNO 3 (60 ° C)
Na 2 S + H 2 S (насичений.) = 2NaHS
Na 2 S (т) + 2O 2 = Na 2 SO 4 (вище 400 ° C)
Na 2 S + 4H 2 O 2 (конц.) = Na 2 SO 4 + 4H 2 O
S 2+ M 2+ = MnS (тілесні.) ↓; FeS (черн.) ↓; ZnS (біл.) ↓
S 2 + 2Ag + = Ag 2 S (черн.) ↓
S 2+ M 2+ = СdS (жовтий.) ↓; PbS, CuS, HgS (чорні) ↓
3S 2 + 2Bi 3+ = Bi 2 S 3 (кор. - черн.) ↓
3S 2 + 6H 2 O + 2M 3+ = 3H 2 S + 2M (OH) 3 ↓ (M = Al, Cr)
отриманняв промисловості- прожарювання мінералу мирабилит Na 2 SO 4 10Н 2 O в присутності відновників:
Na 2 SO 4 + 4Н 2 = Na 2 S + 4Н 2 O (500 ° C, кат. Fe 2 O 3)
Na 2 SO 4 + 4С (кокс) = Na 2 S + 4СО (800-1000 ° C)
Na 2 SO 4 + 4СО = Na 2 S + 4СO 2 (600-700 ° C)
Сульфід алюмінію Al 2 S 3.Безкиснева сіль. Білий, зв'язок Al - S переважно ковалентний. Плавиться без розкладання під надлишковим тиском N 2, легко переганяється. Окислюється на повітрі при прожаренні. Повністю гідролізується водою, не осідає з розчину. Розкладається сильними кислотами. Застосовується як твердий джерело чистого сірководню. Рівняння найважливіших реакцій:
Al 2 S 3 + 6Н 2 O = 2Al (OH) 3 ↓ + 3H 2 S (чистий)
Al 2 S 3 + 6НCl (разб.) = 2AlCl 3 + 3H 2 S
Al 2 S 3 + 24HNO 3 (конц.) = Al 2 (SO 4) 3 + 24NO 2 + 12H 2 O (100 ° C)
2Al 2 S 3 + 9O 2 (повітря) = 2Al 2 O 3 + 6SO 2 (700-800 ° C)
отримання: Взаємодія алюмінію з розплавленої сірої під час відсутності кисню і вологи:
2Al + 3S = AL 2 S 3(150-200 ° C)
Сульфід заліза (II) FeS.Безкиснева сіль. Чорно-сірий з зеленим відтінком, тугоплавкий, розкладається при нагріванні в вакуумі. У вологому стані чутливий до кисню повітря. Не розчиняється в воді. Чи не випадає в осад при насиченні розчинів солей заліза (II) сірководнем. Розкладається кислотами. Застосовується як сировина у виробництві чавуну, твердий джерело сірководню.
З'єднання заліза (III) складу Fe 2 S 3 невідомо (ніхто не почув).
Рівняння найважливіших реакцій:
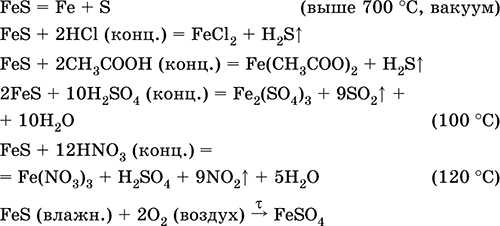
отримання:
Fe + S = FeS(600 ° C)
Fe 2 O 3 + H 2 + 2H 2 S = 9 FeS+ 3H 2 O (700-1000 ° C)
FeCl 2 + 2NH 4 HS (хат.) = FeS↓ + 2NH 4 Cl + H 2 S
Дисульфід заліза FeS 2.Бінарна сполука. Має іонну будову Fe 2+ (-S - S-) 2. Темно-жовтий, термічно стійкий, при прожарюванні розкладається. Не розчиняється в воді, не реагує з розведеними кислотами, лугами. Розкладається кислотами-окислювачами, піддається випалу на повітрі. Застосовується як сировина у виробництві чавуну, сірки і сірчаної кислоти, каталізатор в органічному синтезі. У природі - рудні мінерали піриті марказіт.
Рівняння найважливіших реакцій:
FeS 2 = FeS + S (вище 1170 ° C, вакуум)
2FeS 2 + 14H 2 SO 4 (конц., Гір.) = Fe 2 (SO 4) 3 + 15SO 2 + 14Н 2 O
FeS 2 + 18HNO 3 (конц.) = Fe (NO 3) 3 + 2H 2 SO 4 + 15NO 2 + 7H 2 O
4FeS 2 + 11O 2 (повітря) = 8SO 2 + 2Fe 2 O 3 (800 ° C, випал)
Гідросульфід амонію NH 4 HS.Безкиснева кисла сіль. Білий, плавиться під надлишковим тиском. Вельми летючий, термічно нестійкий. На повітрі окислюється. Добре розчинний у воді, гідролізується по катіону і аніону (переважає), створює лужне середовище. Розчин жовтіє на повітрі. Розкладається кислотами, в насиченому розчині приєднує сірку. Лугами НЕ нейтралізується, середня сіль (NH 4) 2 S не існує в розчині (умови отримання середньої солі см. В рубриці «H 2 S»). Застосовується в якості компонента фотопроявітелей, як аналітичний реагент (осадитель сульфідів).
Рівняння найважливіших реакцій:
NH 4 HS = NH 3 + H 2 S (вище 20 ° C)
NH 4 HS + НCl (разб.) = NH 4 Cl + H 2 S
NH 4 HS + 3HNO 3 (конц.) = S ↓ + 2NO 2 + NH 4 NO 3 + 2H 2 O
2NH 4 HS (насичений. H 2 S) + 2CuSO 4 = (NH 4) 2 SO 4 + H 2 SO 4 + 2CuS ↓
отримання: насичення концентрованого розчину NH 3 сірководнем:
NH 3 Н 2 O (конц.) + H 2 S (г) = NH 4 HS+ Н 2 O
В аналітичній хімії розчин, що містить рівні кількості NH 4 HS і NH 3 Н 2 O, умовно вважають розчином (NH 4) 2 S і використовують формулу середньої солі в запису рівнянь реакцій, хоча сульфід амонію повністю гідролізується у воді до NH 4 HS і NH 3 Н 2 O.
Сірка - це тверда кристалічна речовина жовтого кольору. Температура плавлення - 119С о, температура кипіння - 444,6С о.
Сірка має кілька аллотропних модифікація. Кристалічна сірка складається з циклічних молекул S 8 мають ромбічну форму. Дана модифікація є найбільш стійкою. При кристалізації сірки з розплаву виходять голчасті кристали (так звана моноклінна сірка). При температурі приблизно 100 ° С про моноклінна сірка переходить в ромбічну (кристалічну). Якщо розплавлену сірку вилити в холодну воду, утворюється пластична сірка. Через деякий час пластична сірка перекрісталлізуется і знову стане жорсткою і крихкою.
При температурі 1800 С про пари сірки одноатомни. Сірка абсолютно нерозчинні у воді, трохи розчинна в етиловому спирті і бензолі, добре розчинна в сероуглероде CS 2.
Так як атом сірки здатний виявляти кілька ступенів окислення, отже, в хімічних реакціяхсірка виявляє двоїстий, окисні і відновні, властивості. Можливі також реакції диспропорціонування.

горіння сірки
З підвищенням температури зростає хімічна активність сірки.
- Взаємодія з киснем
Сірка легко спалахує в атмосфері кисню з утворенням оксиду сірки 2 (сірчистий газ).
- Взаємодія з воднем
Якщо сірку розплавити, вона легко вступить у взаємодію з воднем, утворюючи смердючий газ - сірководень H 2 S.
- Взаємодія з іншими неметалами
Розплавлена сірка реагує з хлором з утворенням хлориду сірки 1 (хлориста сірка).

хлорид сірки
2S + Cl 2 = S 2 Cl 2
Можливо також отримання і інших сполук сірки з хлором: SCl 2, SCl 4.
Хлориди сірки розкладаються водою з утворенням кислот.

При взаємодії з металами сірка виявляє окисні властивості. В даних реакціях утворюються сульфіди.
2Al + 3S = Al 2 S 3
- Взаємодія з лугами
Сірка легко вступає в реакції з лугами
3S + 6KOH = K 2 SO 4 + 2K 2 S + 3H 2 O