حمض الهيدروكلوريك الجاف. أملاح حمض الهيدروكلوريك
هيدروجين. الحمض التقني له لون أخضر مصفر بسبب الكلور وأملاح الحديد. أقصى تركيز حامض الهيدروكلوريك حوالي 36٪ ؛ مثل هذا الحل له كثافة 1.18 ز / سم 3 ، "يدخن" في الهواء ، لأنه يشكل H المتطور قطرات صغيرة مع بخار الماء.
حامض الهيدروكلوريك كان معروفًا للكيميائيين في نهاية القرن السادس عشر ، الذين حصلوا عليه عن طريق تسخين ملح الطعام بالطين أو بزجاج الحديد. تحت اسم "الكحول الهيدروكلوري" في منتصف القرن السابع عشر. وصفه I.R. جلوبر الذين استعدوا حامض الهيدروكلوريك التفاعل مع H 2 4. لا تزال طريقة جلوبر مستخدمة حتى اليوم.
حامض الهيدروكلوريك هو من أقوى الأحماض. يذوب (مع إطلاق H 2 وتشكيل الأملاح - كلوريدات ) جميع المعادن في الإجهاد تتراوح حتى الهيدروجين. تتشكل الكلوريدات أيضًا عند التفاعل حامض الهيدروكلوريك مع أكاسيد وهيدروكسيدات المعادن. مع مؤكسدات قوية حامض الهيدروكلوريك يتصرف كعامل اختزال ، على سبيل المثال: O 2 + 4H = Mn 2 + 2 + 2H 2 O.
إنتاج حامض الهيدروكلوريك تشتمل الصناعة على مرحلتين: الحصول على H وامتصاصه بالماء. الطريقة الرئيسية لإنتاج H هي التخليق من 2 و H 2. تتشكل كميات كبيرة من H كمنتج ثانوي لكلورة المركبات العضوية: RH + 2 = RCI + H ، حيث R هو جذور عضوية.
المصنعة التقنية حامض الهيدروكلوريك لديه قوة لا تقل عن 31٪ H (اصطناعي) و 27.5٪ H (من Na). يسمى حمض التاجر مخفف إذا كان يحتوي ، على سبيل المثال ، على 12.2٪ H ؛ عند محتوى 24٪ وأكثر من H ، يطلق عليه المركز. في الممارسة المعملية ، 2n. يشار إلى H (7٪ ، الكثافة 1.035) على أنها مخفف حامض الهيدروكلوريك
حامض الهيدروكلوريك - أهم منتج للصناعة الكيماوية. يتم استخدامه للحصول على كلوريدات من معادن مختلفة ولتجميع المنتجات العضوية المحتوية على الكلور. حامض الهيدروكلوريك يتم استخدامها لنقش المعادن ، لتنظيف الأوعية المختلفة ، وتغليف أنابيب الآبار من الكربونات والأكاسيد والرواسب والملوثات الأخرى. في علم المعادن ، تتم معالجة الخامات معها ، في صناعة الجلود - الجلود قبل الدباغة. حامض الهيدروكلوريك - كاشف مهم في الممارسة المختبرية. المواصلات حامض الهيدروكلوريك في عبوات زجاجية أو أوعية معدنية مصمّعة (مغطاة بطبقة من المطاط).
غاز H سام. يؤدي التعرض المطول لجو H2 إلى نزلات في الجهاز التنفسي وتسوس الأسنان وتقرح الغشاء المخاطي للأنف واضطراب في الجهاز الهضمي. المحتوى المسموح به من H في هواء غرف العمل لا يزيد عن 0.005 ملغم / لتر.الحماية: قناع الغاز ، نظارات واقية ، قفازات مطاطية ، أحذية ، ساحة.
آي كيه مالينا.
حامض الهيدروكلوريك الواردة في عصير المعدة (حوالي 0.3٪) ؛ يعزز الهضم ويقتل البكتيريا المسببة للأمراض.
في الممارسة الطبية مطلقة حامض الهيدروكلوريك تستخدم في القطرات والمخاليط بالاشتراك مع بيبسين في الأمراض المصحوبة بحموضة غير كافية لعصير المعدة (على سبيل المثال ، التهاب المعدة) ، و فقر الدم الناقص الصبغي (مع مستحضرات الحديد لتحسين امتصاصها).
مقال عن كلمة " حامض الهيدروكلوريك"في الموسوعة السوفيتية العظمى تمت قراءتها 12940 مرة
الدرس لا.
الموضوع: حمض الهيدروكلوريك
الأهداف:
التعليمية - في عملية البحث ، لدراسة الخصائص الكيميائية لحمض الهيدروكلوريك والتعرف على التفاعل النوعي لأيون الكلوريد.
تطوير - لتطوير مزيد من المهارات لتكوين معادلات التفاعلات الكيميائية ؛ تعليم المقارنة والتعميم والتحليل واستخلاص النتائج.
تعليمي - لتطوير النشاط المعرفي من خلال التجربة.
المعدات: العرض
خلال الفصول
المرحلة التنظيمية
مساء الخير يا رفاق!
يُطلق على القرن الحادي والعشرين بحق "عصر الكيمياء" ، "عصر التقنيات الجديدة". ومن السمات التي تميز الشخص المتعلم الحديث موقفه الكيميائى تجاه نفسه وصحته والبيئة. لا يمكنك أن تصبح متعلمًا كيميائيًا إلا من خلال الدراسة ومعرفة العالم من حولك وأكثر من ذلك على نحو فعال الإدراك هو البحث. واليوم في الدرس ستصبحون علماء مرة أخرى - باحثون ، موظفون في مختبر علمي ، وسيقوم كل واحد منكم باكتشاف صغير لكن مستقل سيسمح لك بالتعمق في أسرار علم الكيمياء العظيم.
2- الدافع المعرفي
في درس اليوم ، سنتحدث عن مادة لا غنى عنها ليس فقط في العديد من الصناعات ، ولكن أيضًا تلعب دورًا كبيرًا في جسم الإنسان. لسوء الحظ ، لا أحد يعرف مدى أهمية المحتوى الطبيعي لهذه المادة في المعدة. عندما يكون الجسم غير قادر على إنتاج الكمية المطلوبة من العصارة المعدية ، تحدث حالة من الحموضة المنخفضة تسمى نقص الحموضة. انخفاض الحموضة له تأثير ضار حتمي على الهضم ويتعارض مع امتصاص العناصر الغذائية اللازمة للصحة.
هذه المادة هي الحمض الوحيد الذي ينتجه أجسامنا. جميع الأحماض الأخرى هي منتجات ثانوية استقلابية ويجب التخلص منها من الجسم في أسرع وقت ممكن. ما الحمض الذي نتحدث عنه؟ إجابات الأطفال (يشكل المعلم مع الطلاب موضوع الدرس)
3 الاستهداف
انظر إلى موضوع الدرس ، وفكر ، ونصوغ معًا أهداف الدرس ، ما الأسئلة التي نحتاج إلى دراستها اليوم. وبالتالي،
يكتشف التاريخ وطرق الإنتاج والخصائص الفيزيائية لحمض الهيدروكلوريك
يكتشف الخواص الكيميائية لحمض الهيدروكلوريك
اكتشف - حل مهارات رسم معادلات التفاعلات الكيميائية
4- تحديث المعرفة
ما رأيك كلوريد الهيدروجين و حامض الهيدروكلوريك هل هذه مادة واحدة؟ إذا كان الأمر كذلك ، لماذا؟ (إجابات الطلاب). إذن لماذا يوجد اسمان؟ لأي سبب. سوف نحصل على الإجابة الصحيحة من خلال النظر إلى تجربة "الحل كلوريد الهيدروجين"(فيديو)
بعد الاطلاع على أسئلة التجربة: ما الإجابة التي حصلت عليها؟ محلول حمض الهيدروكلوريك الصحيح كلوريد الهيدروجين.
قل لي ما هي الأحماض.
ما هي الخصائص الكيميائية العامة للأحماض (إجابات الطلاب)
5 .تعلم مواد جديدة
1- تاريخ اكتشاف حمض الهيدروكلوريك
تي من الصعب تحديد من ومتى تلقى حمض الهيدروكلوريك لأول مرة. على أي حال ، نحن نعلم ذلك بالفعل في نهاية القرن الخامس عشر. الخيميائي فاسيلي فالنتين وفي القرن السادس عشر. أندرياس ليبافيوس ، في بحثه الدؤوب عن إكسير الحياة المعجزة ، قام بتكلس ملح الطعام مع الشبة والزاج في أجهزة كيميائية غريبة بالنسبة لنا وحصل على منتج يوصف بـ "الكحول الحمضي". كان هذا حمض الهيدروكلوريك المألوف ، بالطبع ، نجس جدًا.
بالنسبة للمستكشفين الأوائل ، كانت مادة جديدة تمامًا لها خصائص أدهشت خيالهم بشكل كبير. استنشقوها ، شهقوا وسعالوا ، تدخين "كحول حامض" في الهواء. عند تذوقه ، يحرق اللسان والحنك ، ويتآكل المعادن ، ويدمر الأنسجة.
في عام 1658 ، وجد الكيميائي الألماني جي آر جلوبر (1604-1670) طريقة جديدة لإنتاج حمض الهيدروكلوريك ، والتي أطلق عليها اسم "الكحول الهيدروكلوري". لا تزال هذه الطريقة مستخدمة على نطاق واسع في المختبرات. قام بتسخين ملح الطعام بحمض الكبريتيك المركز وامتصاص "الدخان" المنبعث بالماء.
في عام 1772 ، أثبت الكيميائي الإنجليزي جيه بريستلي (1733-1804) أنه عندما يعمل حمض الكبريتيك على ملح الطعام ، يتم إطلاق غاز عديم اللون ، والذي يمكن تجميعه فوق الزئبق ، وأن هذا الغاز لديه قدرة عالية للغاية على الذوبان في الماء. سمي محلول مائي لهذا الغاز "حمض الهيدروكلوريك" (حمض مرياتيكوم)، وأطلق بريستلي على الغاز اسم "حمض الهيدروكلوريك الغازي النقي".
2- إنتاج حمض الهيدروكلوريك
فيديو: الحصول على حمض الهيدروكلوريك.
تم اقتراح طريقة الإنتاج هذه في القرن السابع عشر من قبل الكيميائي الألماني يوهان جلوبر ، واستخدمت في روسيا حتى منتصف القرن العشرين تقريبًا. تستخدم هذه الطريقة الآن في الإنتاج المختبري لكلوريد الهيدروجين.
يذهب أحد الطلاب إلى السبورة ويكتب معادلة التفاعل.
NaCl (صلب) + H2SO4 (conc.) \u003d HCl + NaHSO4
3- الخواص الفيزيائية لحمض الهيدروكلوريك
حمض الهيدروكلوريك هو محلول عديم اللون ، يدخن بقوة في الهواء ، مع رائحة نفاذة بسبب إطلاق كلوريد الهيدروجين. الحد الأقصى لتركيز حمض الهيدروكلوريك - 37 ٪ ، مثل هذا المحلول له كثافة 1 ، 18 جم / سم 3 ، يسمى الحمض مخفف إذا كان يحتوي على 12 ٪ أو أقل من حمض الهيدروكلوريك.في المختبر ، عادة ما يستخدم 7 ٪ من حمض الهيدروكلوريك ، وكثافته 1.035 جم / سم 3. إنه حمض قوي ، لذلك يجب ملاحظة السل عند العمل مع الأحماض حمض الهيدروكلوريك عالي التركيز -مادة كاوية عند ملامسته للجلد يسبب مادة كيميائية قوية ... اتصال العين خطير بشكل خاص. عادة ما يتم استخدام محلول قلوي ضعيف لتحييد الحروق .
عند فتح الأوعية التي تحتوي على حمض الهيدروكلوريك المركز ، البخار تجذب الرطوبة في الهواء ، فتشكل ضبابًا يهيج العينين و الخطوط الجوية شخص. حمض الهيدروكلوريك سائل عديم اللون مسبب للتآكل ، "يدخن" في الهواء. وهو عبارة عن إلكتروليت قوي ويتفكك تمامًا في محلول مائي إلى أيونات الكلور والهيدروجين:
حمض الهيدروكلوريك⇄ ح (+) + Cl (-).
دعنا نحدد نوع الارتباط.
تذكر أنواع الروابط.
الرابطة الكيميائية بين ذرات الكلور والهيدروجين في جزيء حمض الهيدروكلوريك هي رابطة قطبية تساهمية.
4- الخواص الكيميائية للحمض
قبل أن نبدأ في دراسة الخصائص الكيميائية لحمض الهيدروكلوريك ، دعنا نكرر قواعد T.B
التكرار مع التدريب ، السل عند العمل مع الأحماض.
يمكن أن تسبب الأحماض عند ملامستها للجلد حروقًا. خطورة حرق كيميائي يعتمد على قوة وتركيز الحمض. عند استخدام زجاجة حمض ، تأكد من أن كل زجاجة تحمل اسمًا واضحًا للحمض. من الضروري سكب الحمض بحيث يكون الملصق في الأعلى عند إمالة الزجاجة لتجنب تلفها. يجب سكب الحمض بعناية ، لا تسمح للحمض بالتسرب على الجلد والأشياء والأرضية.
الإسعافات الأولية . يتم غسل المنطقة المصابة من الجلد بتيار ماء بارد منزلق بشدة لمدة 10-15 دقيقة. بعد الشطف ، توضع ضمادة شاش أو قطعة قطن مبللة بمحلول مائي 2٪ من صودا الخبز على المكان المحروق. في 10 دقائق. تتم إزالة الضمادة ، وغسل الجلد ، وإزالة الرطوبة بعناية بورق الترشيح أو لينة بقطعة قماش ملطخة بالجلسرين لتقليل الألم.
دعونا نتذكر الخصائص العامة للأحماض (إجابات المدرب)
يدرس الطلاب الخصائص الكيميائية لحمض الهيدروكلوريك في مجموعات. تتلقى كل مجموعة بطاقة تعليمات.
لديك بطاقات تعليمات ومعدات وكواشف على طاولاتك. قراءة التعليمات بعناية وإجراء التجارب ومراعاة قواعد السلامة.
الخواص الكيميائية للحمض
ما هي الخصائص الكيميائية التي يجب أن يمتلكها حمض الهيدروكلوريك في رأيك؟ يصوغ الطلاب فرضية.
نماذج الإجابات:
إذا كان NS l هو حمض ، إذًا يجب أن يكون له خصائص جميع الأحماض.
تتشابه خصائص حمض الهيدروكلوريك مع خصائص الأحماض. ما هو القاسم المشترك بين حمض الهيدروكلوريك والأحماض الأخرى؟ (وجود H + أيون الذي يحدد خصائص الحمض)
تجربة 1. تغيير لون المؤشر.
صب 2-3 قطرات من محلول حمض الهيدروكلوريك في 3 أنابيب اختبار.
أضف قطرة واحدة من برتقال الميثيل والفينول فثالين وعباد الشمس إلى محلول حمض الهيدروكلوريك.
ما هي التغييرات التي تحدث؟
الاستنتاجات:
تجربة 2. تفاعل حمض الهيدروكلوريك مع المعادن.
ما هي التغييرات التي تحدث؟
اكتب معادلة التفاعل.
خاتمة: يتفاعل حمض الهيدروكلوريك مع المعادن في نطاق الأنشطة حتى (يزيحون الهيدروجين من الأحماض)
Mg + 2HCl \u003d MgCl2 + H2 ،
تجربة رقم 3 التفاعل مع الأكاسيد.
ضع كمية صغيرة من أكسيد الكالسيوم في أنبوب اختبار.
أضف محلول حمض الهيدروكلوريك بالتنقيط إلى المحلول الناتج ، كوّن معادلة التفاعل.
خاتمة:
تجربة 3. تفاعل حمض الهيدروكلوريك مع القواعد.
4.1 تفاعل حمض الهيدروكلوريك مع قواعد قابلة للذوبان.
ما هي التغييرات التي تحدث؟
أضف محلول حمض الهيدروكلوريك بالتنقيط إلى المحلول الناتج حتى يختفي اللون. ما هو اسم تفاعل الحمض والقلوي
اكتب معادلة التفاعل.
خاتمة:تدخل الأحماض ذات القواعد في تفاعل معادل
HCl + NaOH \u003d NaCl + H2O
اكتب معادلة التفاعل
ما هو القاسم المشترك بين حمض الهيدروكلوريك والأحماض الأخرى؟ (وجود H + أيون الذي يحدد خصائص الحمض)
هل يمتلك حمض الهيدروكلوريك خواص مميزة له وأملاحه فقط؟
نعم ، هناك مثل هذه الخاصية. هذا هو رد فعل نوعي لأيون الكلوريد.
التفاعل مع الأملاح
تجربة 5. رد فعل نوعي لأيون الكلوريد.
ضع 2-3 قطرات من محلول حمض الهيدروكلوريك ومحلول كلوريد البوتاسيوم في بئرين من اللوحة لتحليل السقوط ، على التوالي.
أضف 2-3 قطرات من محلول نترات الفضة لكل خلية.
ما هي التغييرات التي تحدث؟
اكتب معادلات تفاعل أيونية جزيئية وموجزة.
خاتمة: يعتبر التفاعل مع نترات الفضة خاصية محددة لحمض الهيدروكلوريك وأملاحه.
تسمح التفاعلات النوعية باكتشاف أيون أو مجموعة كيميائية أو وظيفية أو أخرى
5. منهجية المعرفة
أ - 2.44 و 1.258 ، كلور
ب - 3.44 و 2.258 ، كلور
G - 4 و 2 ، كلوريد الهيدروجين
6. التفكير
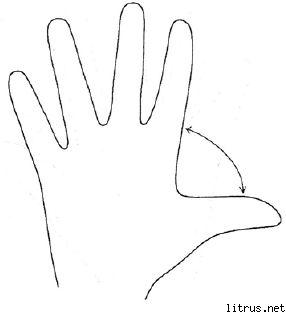
طريقة الخمس أصابع.
م
ب
من عند (متوسط) - حالة ذهنية.
يملك
ب
7.D / Z
الاسم الكامل و _________________________________________________________________________
حامض الهيدروكلوريك____________________________________________________________________________________________________________________________________________________
تاريخ الاكتشاف
فاسيلي فالنتين وأندرياس ليبافي ________________________________________________________________________________________________________________________________________________________________
يوهان رودولف جلوبر __________________________________________________________________________________________________________________________________________________________________________________
جيه بريستلي ______________________________________________________________________________________________________________________________________________________________الحصول على حمض الهيدروكلوريك
__________________________________________________________________________________________________________________________________
الخصائص الفيزيائية للحمض
_____________________________________________________________________________________________________________________________________________
الخواص الكيميائية للحمض
العمل على المؤشرات
1. صب 2-3 قطرات من محلول حمض الهيدروكلوريك في 3 أنابيب اختبار.
أضف قطرة واحدة من برتقال الميثيل إلى الأنبوب الأول ، وقطرة واحدة من الفينول فثالين في الأنبوب الثاني ، وقطرة واحدة من عباد الشمس في الأنبوب الثالث. ما هي التغييرات التي تحدث؟
مؤشر
لون في محلول حامض
ميتيل برتقالي
الفينول فثالين
عباد الشمس
الاستنتاجات:
2. تفاعل حمض الهيدروكلوريك مع المعادن.
ضع حبيبات الزنك في أنبوب الاختبار رقم 1 ونشارة النحاس في أنبوب الاختبار رقم 2.
صب 1-2 مل من محلول حمض الهيدروكلوريك في كل أنبوب.
ما هي التغييرات التي تحدث؟ ___________________________________________
اكتب معادلة التفاعل
______________________________________________________________________________________________________________________________________________________________________________________________________
الاستنتاجات:
التفاعل مع الأكاسيد
صب ملعقة من أكسيد الكالسيوم في أنبوب اختبار.
أضف 1 مل من محلول حمض الهيدروكلوريك إلى أنبوب الاختبار
لاحظ انحلال الراسب.
اكتب معادلات التفاعل
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
الاستنتاجات:
4. تفاعل حمض الهيدروكلوريك مع القواعد.
تفاعل حمض الهيدروكلوريك مع قواعد قابلة للذوبان.
ضع 2-3 قطرات من محلول هيدروكسيد الصوديوم في أنبوب اختبار.
أضف قطرة واحدة من الفينول فثالين إلى هذا المحلول
ما هي التغييرات التي تحدث؟ __________________________________________
أضف محلول حمض الهيدروكلوريك بالتنقيط إلى المحلول الناتج حتى يختفي اللون. ما اسم تفاعل الحمض والقلوي __________________________
اكتب معادلة التفاعل.
____________________________________________________________________________________________________________________________________________________________________
خاتمة:
تفاعل حمض الهيدروكلوريك مع قواعد غير قابلة للذوبان
تفاعل حمض الهيدروكلوريك مع الأملاح.
1. صب ملعقة من كربونات الصوديوم في أنبوب اختبار.
2- أضف 1 مل من محلول حمض الهيدروكلوريك إلى أنبوب الاختبار
3. ما هي التغييرات التي تحدث؟ __________________________________________
4. اكتب معادلات التفاعل
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
الاستنتاجات:
رد فعل نوعي لأيون الكلوريد.
خذ أنبوبين اختبار. صب 1 مل من محلول حمض الهيدروكلوريك في واحد. أضف 1 مل من محلول كلوريد الباريوم للآخر.
أضف 2-3 قطرات من محلول نترات الفضة لكل أنبوب.
ما هي التغييرات التي تحدث؟
اكتب معادلات التفاعل.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
خاتمة:
رد الفعل النوعي ____________________________________________________________________________________________________________________________________________________________________________
البيانات الصحيحة هي
حامض الهيدروكلوريك:
يغير لون المؤشر
يتفاعل مع
قواعد قابلة للذوبان
قواعد غير قابلة للذوبان
أكاسيد حمضية
أكاسيد أساسية
أملاح الأحماض الضعيفة
أملاح أحماض أقوى
تقف المعادن حتى مستوى H.
المعادن بعد H.
احسب الكثافة النسبية للكلور وكلوريد الهيدروجين في الهواء. أي غاز أثقل؟
أ - 2.44 و 1.258 ، كلور
ب - 3.44 و 2.258 ، كلور
ب - 1.258 و 2.44 ، كلوريد الهيدروجين
G - 4 و 2 ، كلوريد الهيدروجين
انعكاس
طريقة الخمس أصابع.
م (الاصبع الصغير) - عملية التفكير. ما هي المعرفة والخبرة التي تلقيتها اليوم؟
ب (غير مسمى) - القرب المستهدف. ماذا فعلت اليوم وماذا حققت؟
من عند (متوسط) - حالة ذهنية. ماذا كان مزاجي السائد اليوم؟
يملك (فهرس) - خدمة ، مساعدة. كيف ساعدت اليوم ، كيف من فضلك أو ماذا ساهمت؟
ب (كبير) - البهجة واللياقة البدنية. ماذا كانت حالتي الجسدية اليوم؟ ماذا فعلت لصحتي؟
أملاح أو كلوريدات حمض الهيدروكلوريك- مركبات الكلور مع جميع العناصر التي لها قيمة كهرسلبية منخفضة.
كلوريدات المعادن- المواد الصلبة. قابل للذوبان في الماء بشكل جيد في الغالب ، ولكن AgCl و CuCl و HgCl2 و TlCl و PbCl2- قابل للذوبان قليلا. كلوريدات الفلزات القلوية والقلوية الترابية محايدة. تؤدي زيادة عدد ذرات الكلور في جزيئات الكلوريد إلى انخفاض قطبية الرابطة الكيميائية والاستقرار الحراري للكلوريدات ، وزيادة في قابليتها للتطاير والميل إلى التحلل المائي. محاليل كلوريدات المعادن الأخرى لها تفاعل حمضي بسبب التحلل المائي:
كلوريدات اللافلزات هي مواد يمكن أن تكون في أي حالة تجمع: غازي (HCl) ، سائل (PCl3) وصلب (PCl5). أدخل أيضًا في تفاعل التحلل المائي:
بعض الكلوريدات غير الفلزية عبارة عن مركبات معقدة ، على سبيل المثال ، يتكون PC15 من أيونات [PCl4] + و [PCl6]. يشار إلى كلوريدات البروم واليود باسم مركبات الهالوجين. يتميز عدد من الكلوريدات بالارتباط والبلمرة في المراحل السائلة والغازية مع تكوين جسور الكلوريد بين الذرات.
يستلم.يتم الحصول عليها عن طريق تفاعل المعادن مع الكلور أو تفاعلات حمض الهيدروكلوريك مع المعادن وأكاسيدها وهيدروكسيداتها ، وكذلك عن طريق التبادل مع بعض الأملاح:
تحديد أيون الكلور نوعياً وكمياً باستخدام نترات الفضة. ينتج عن هذا ترسب أبيض يشبه الرقائق.
كلوريداتتستخدم في الإنتاج والتوليف العضوي. يعتمد تكوين الكلوريدات المتطايرة على إثراء وفصل العديد من المعادن غير الحديدية والنادرة. كلوريد الصوديوم- للحصول على هيدروكسيد الصوديوم وحمض الهيدروكلوريك وكربونات الصوديوم والكلور. كما أنها تستخدم في صناعة المواد الغذائية وصنع الصابون. كلوريد البوتاسيوم- كسماد البوتاس. كلوريد الباريوم- وسائل مكافحة الآفات الحشرية. كلوريد الزنك- لتشريب الخشب ، كمادة حافظة ضد التعفن ، عند لحام المعدن. كلوريد الكالسيوميستخدم اللامائي لتجفيف المواد (الغازات) ، في الممارسة الطبية ، ويستخدم هيدراته البلورية كعامل تبريد. كلوريد الفضةتستخدم لعمل الصور. كلوريد الزئبق- مركب سام يستخدم لمعالجة البذور ودباغة الجلود وصباغة الأقمشة. يعمل كعامل مساعد في التخليق العضوي. كمطهر. كلوريد الأمونيومتستخدم في صناعة الصباغة والطلاء الكهربائي واللحام والتعليب.
نهاية العمل -
هذا الموضوع ينتمي إلى القسم:
ورقة الغش الكيمياء غير العضوية
ورقة الغش في الكيمياء غير العضوية ... أولغا فلاديميروفنا ماكاروفا ...
إذا كنت بحاجة إلى مواد إضافية حول هذا الموضوع ، أو لم تجد ما كنت تبحث عنه ، فإننا نوصي باستخدام البحث في قاعدة عملنا:
ماذا سنفعل بالمواد المستلمة:
إذا كانت هذه المادة مفيدة لك ، فيمكنك حفظها في صفحتك على الشبكات الاجتماعية:
| سقسقة |
جميع المواضيع في هذا القسم:
المادة وحركتها
المادة هي حقيقة موضوعية لها خاصية الحركة. كل ما هو موجود هو أنواع مختلفة من المادة المتحركة. المادة موجودة بشكل مستقل عن الوعي
المواد وتغييرها. موضوع الكيمياء غير العضوية
المواد - أنواع المواد ، الجسيمات المنفصلة التي لها كتلة سكون محدودة (كبريت ، أكسجين ، جير ، إلخ) تتكون الأجسام المادية من مواد. كل
الجدول الدوري للعناصر D.I. منديليف
تم اكتشاف القانون الدوري في عام 1869 من قبل د. منديليف. كما أنشأ تصنيفًا للعناصر الكيميائية ، معبرًا عنه في شكل نظام دوري. افعلني
أهمية الجدول الدوري لمندليف.
كان الجدول الدوري للعناصر هو أول تصنيف طبيعي للعناصر الكيميائية ، والذي أظهر أنها مترابطة مع بعضها البعض ، كما أنها كانت بمثابة مزيد من البحث.
نظرية التركيب الكيميائي
تم تطوير نظرية التركيب الكيميائي بواسطة A.M. Butlerov ، لديه المواقف التالية: 1) ترتبط الذرات في الجزيئات ببعضها البعض
الخصائص العامة لعناصر P- ، S- ، D
تنقسم العناصر في النظام الدوري لمندليف إلى عناصر s- و p- و d. يتم إجراء هذا التقسيم الفرعي بناءً على عدد المستويات التي تحتوي عليها غلاف الإلكترون لذرة عنصر ما
الرابطة التساهمية. طريقة رابطة التكافؤ
تسمى الرابطة الكيميائية التي يتم إجراؤها بواسطة أزواج الإلكترونات الشائعة التي تنشأ في أغلفة الذرات المترابطة التي لها لفات مضادة للتوازي ، الذرة أو التساهمية
الروابط التساهمية القطبية وغير القطبية
بمساعدة رابطة كيميائية ، يتم الاحتفاظ بذرات العناصر في تكوين المواد بالقرب من بعضها البعض. يعتمد نوع الرابطة الكيميائية على توزيع كثافة الإلكترون في الجزيء.
اتصالات متعددة المراكز
في عملية تطوير طريقة روابط التكافؤ ، اتضح أن الخصائص الحقيقية للجزيء اتضح أنها وسيطة بين تلك الموصوفة في الصيغة المقابلة. هذه الجزيئات
الرابطة الأيونية
الرابطة التي نشأت بين الذرات ذات الخصائص المعاكسة المعبر عنها بحدة (معدن نموذجي وغير معدني نموذجي) ، والتي تنشأ بينها قوى الجذب الكهروستاتيكي
رابطة الهيدروجين
في الثمانينيات من القرن التاسع عشر. ماجستير إيلينسكي ن. اكتشف بيكيتوف أن ذرة الهيدروجين مجتمعة مع الفلور أو الأكسجين أو ذرة النيتروجين قادرة على تكوين
تحويل الطاقة في التفاعلات الكيميائية
التفاعل الكيميائي - تحول مادة أو أكثر من مواد البدء إلى مواد أخرى التركيب الكيميائي أو هيكل المادة. مقارنة بالمفاعلات النووية
سلسلة من ردود الفعل
هناك تفاعلات كيميائية يكون فيها التفاعل بين المكونات بسيطًا جدًا. هناك مجموعة واسعة جدًا من ردود الفعل المعقدة. في ردود الفعل هذه
الخصائص العامة لللافلزات
بناءً على موضع اللافلزات في النظام الدوري لمندليف ، يمكن تحديد خصائصها المميزة. يمكنك تحديد عدد الإلكترونات في en الخارجي
هيدروجين
الهيدروجين (H) - العنصر الأول في نظام مندليف الدوري - المجموعتان الأولى والسابعة ، المجموعة الفرعية الرئيسية ، فترة واحدة. يحتوي المستوى الفرعي s1 الخارجي على 1 إلكترون تكافؤ و 1 s2
بيروكسيد الهيدروجين
بيروكسيد أو بيروكسيد الهيدروجين هو مركب أكسجين من الهيدروجين (بيروكسيد). الصيغة: Н2О2 الخصائص الفيزيائية: بيروكسيد الهيدروجين - شراب عديم اللون
الخصائص العامة لمجموعة الهالوجين الفرعية
الهالوجينات - عناصر المجموعة السابعة - الفلور والكلور والبروم واليود والأستاتين (تمت دراسة الأستاتين قليلاً بسبب نشاطه الإشعاعي). الهالوجينات هي غير معادن واضحة للغاية. فقط اليود في إعادة
الكلور. كلوريد الهيدروجين وحمض الهيدروكلوريك
الكلور (Cl) موجود في الفترة الثالثة ، في المجموعة السابعة من المجموعة الفرعية الرئيسية للنظام الدوري ، العدد الذري 17 ، الكتلة الذرية 35.453 ؛ يشير إلى الهالوجينات.
معلومات موجزة عن الفلور والبروم واليود
الفلور (F) ؛ البروم (Br) ؛ اليود (I) ينتمي إلى مجموعة الهالوجينات. يقفون في المجموعة السابعة من المجموعة الفرعية الرئيسية للنظام الدوري. الصيغة الإلكترونية العامة: ns2np6.
الخصائص العامة لمجموعة الأكسجين الفرعية
المجموعة الفرعية للأكسجين ، أو الكالكوجينات - المجموعة السادسة من D.I. Mendeleva ، والتي تشمل العناصر التالية: 1) الأكسجين - O ؛ 2) الكبريت
الأكسجين وخصائصه
يوجد الأكسجين (O) في الفترة 1 ، المجموعة السادسة ، في المجموعة الفرعية الرئيسية. عنصر ص. التكوين الإلكتروني 1s22s22p4. عدد الإلكترونات على سطح اور الخارجي
الأوزون وخصائصه
في الحالة الصلبة ، للأكسجين ثلاثة تعديلات: - ، - - و - تعديلات. الأوزون (O3) هو أحد التعديلات المتآصلة للأكسجين
الكبريت وخصائصه
يوجد الكبريت بشكل طبيعي في المركبات وفي صورة حرة. مركبات الكبريت شائعة أيضًا ، مثل بريق الرصاص PbS و Zinc blende ZnS وبريق النحاس Cu
كبريتيد الهيدروجين وكبريتيد
كبريتيد الهيدروجين (H2S) هو غاز عديم اللون له رائحة نفاذة من البروتين المتحلل. في الطبيعة ، هناك مدخلات من الينابيع المعدنية والغازات البركانية والنفايات المتعفنة وكذلك
خصائص حامض الكبريتيك وأهميته العملية
هيكل معادلة حامض الكبريتيك: الإنتاج: الطريقة الرئيسية لإنتاج حامض الكبريتيك من SO3 هي طريقة الاتصال.
الخواص الكيميائية.
1. حمض الكبريتيك المركز هو عامل مؤكسد قوي. تتطلب تفاعلات الأكسدة والاختزال التسخين ويكون ناتج التفاعل بشكل أساسي ثاني أكسيد الكبريت.
يستلم.
1. في الصناعة ، يتم الحصول على النيتروجين عن طريق تسييل الهواء مع التبخر اللاحق وفصل النيتروجين عن أجزاء الغاز الأخرى في الهواء. يحتوي النيتروجين الناتج على خليط من الغازات النبيلة (الأرجون).
الخصائص العامة للمجموعة الفرعية للنيتروجين
المجموعة الفرعية للنيتروجين هي المجموعة الخامسة ، المجموعة الفرعية الرئيسية لـ D.I. منديليف. يتضمن عناصر: نيتروجين (N) ؛ الفوسفور (ف) ؛ الزرنيخ (
الأمونيوم (كلوريد النيتروجين).
الإنتاج: في الصناعة حتى نهاية القرن التاسع عشر ، تم الحصول على الأمونيا كمنتج ثانوي أثناء فحم الكوك للفحم الذي يحتوي على ما يصل إلى 1-2٪ نيتروجين. في البداية
أملاح الأمونيوم
أملاح الأمونيوم هي مواد معقدة تشمل كاتيونات الأمونيوم NH4 + والمخلفات الحمضية. الخصائص الفيزيائية: أملاح الأمونيوم - ر
أكاسيد النيتروجين
مع الأكسجين ، تشكل أكاسيد N: N2O و NO و N2O3 NO2 و N2O5 و NO3. أكسيد النيتريك I - N2O - أكسيد النيتروز "غاز الضحك". الخصائص الفيزيائية:
حمض النيتريك
حمض النيتريك هو سائل عديم اللون "يدخن" في الهواء برائحة نفاذة. الصيغة الكيميائية HNO3. الخصائص الفيزيائية في درجة الحرارة
تعديلات متآصلة من الفوسفور
يشكل الفوسفور العديد من التعديلات - التعديلات. تحدث ظاهرة التعديلات المتآصلة في الفوسفور عن طريق تكوين أشكال بلورية مختلفة. الفوسفو الأبيض
أكاسيد الفوسفور وأحماض الفوسفوريك
يشكل عنصر الفسفور عددًا من الأكاسيد أهمها الفوسفور (III) أكسيد P2O3 وأكسيد الفوسفور (V) P2O5. أكسيد الفوس
أحماض الفوسفوريك.
العديد من الأحماض تتوافق مع أنهيدريد الفوسفوريك. العامل الرئيسي هو حمض الفوسفوريك H3PO4. يتم تقديم حامض الفوسفوريك المجفف على شكل بلورات شفافة عديمة اللون
الأسمدة المعدنية
الأسمدة المعدنية - مواد غير عضويةخاصة الأملاح التي تحتوي على العناصر الغذائية الضرورية للنبات وتستخدم لزيادة الخصوبة
الكربون وخصائصه
الكربون (C) هو مادة غير معدنية نموذجية ؛ في النظام الدوري في الفترة الثانية من المجموعة الرابعة ، المجموعة الفرعية الرئيسية. العدد الذري 6 ، Ar \u003d 12.011 amu ، شحنة النواة +6.
التعديلات المتآصلة للكربون
يتكون الكربون من 5 تعديلات متآصلة: الماس المكعب ، الماس السداسي ، الجرافيت ، وشكلان من كاربين. الماس السداسي الموجود في النيازك (المعدنية
أكاسيد الكربون. حمض الكربونيك
يتكون الكربون مع أكاسيد الأكسجين: СО ، СО2 ، С3О2 ، С5О2 ، С6О9 ، إلخ. أول أكسيد الكربون (II) - СО. الخصائص الفيزيائية: أول أكسيد الكربون ، ب
السيليكون وخصائصه
السيليكون (Si) في الفترة الثالثة ، المجموعة الرابعة من المجموعة الفرعية الرئيسية للنظام الدوري. الخصائص الفيزيائية: يوجد السيليكون في تعديلين: amo
هناك ثلاثة أنواع من البنية الداخلية للجسيمات الأولية.
1. المواد المعلقة (أو الغرويات التي لا رجعة فيها) هي أنظمة غير متجانسة ، يمكن تحديد خصائصها من خلال واجهة مطورة. بالمقارنة مع أنظمة التعليق ، فهي أكثر تشتتًا
أملاح حمض السيليك
الصيغة العامة لأحماض السيليك هي n SiO2 - m H2O. في الطبيعة ، توجد بشكل أساسي في شكل أملاح ، يتم عزل القليل منها بشكل حر ، على سبيل المثال ، HSiO (ortho
استلام الأسمنت والسيراميك
الأسمنت هو أهم مادة في البناء. يتم الحصول على الأسمنت عن طريق حرق خليط من الطين والحجر الجيري. عند إطلاق خليط من كربونات الكالسيوم CaCO3 (رماد الصودا)
الخصائص الفيزيائية للمعادن
جميع المعادن لها عدد من الخصائص المميزة والمشتركة. الخصائص العامة تعتبر: الموصلية الكهربائية والحرارية العالية ، اللدونة. انتشار المعلمات للوفاء
الخواص الكيميائية للمعادن
تتمتع المعادن بإمكانية تأين منخفضة وتقارب الإلكترون ؛ لذلك ، في التفاعلات الكيميائية ، تعمل كعوامل اختزال ، في المحاليل التي تشكلها
المعادن والسبائك في التكنولوجيا
في الجدول الدوري المكون من 110 عنصرًا معروفًا ، هناك 88 معدنًا. في القرن العشرين ، بمساعدة التفاعلات النووية ، تم الحصول على المعادن المشعة ، والتي لم يتم الحصول عليها
الطرق الرئيسية للحصول على المعادن
تم العثور على عدد كبير من المعادن في الطبيعة في شكل مركبات. المعادن الأصلية هي تلك التي توجد في حالة حرة (الذهب ، البلاتين ، ص
تآكل المعادن
تآكل المعادن (التآكل - التآكل) هو تفاعل فيزيائي وكيميائي للمعادن والسبائك مع البيئةونتيجة لذلك فقدوا ممتلكاتهم. في قلب
حماية المعادن من التآكل
تعتمد حماية المعادن والسبائك ضد التآكل في البيئات العدوانية على: 1) زيادة مقاومة التآكل للمواد نفسها ؛ 2) انخفاض في العدوانية
الخصائص العامة لمجموعة الليثيوم الفرعية
مجموعة الليثيوم الفرعية - مجموعة واحدة ، المجموعة الفرعية الرئيسية - تشمل المعادن القلوية: Li - lithium، Na - sodium، K - potassium، Cs - cesium، Rb - rubidium، Fr - francium. مجموع الإلكترون
الصوديوم والبوتاسيوم
الصوديوم والبوتاسيوم - الفلزات القلوية ، في المجموعة 1 من المجموعة الفرعية الرئيسية. الخصائص الفيزيائية: متشابهة في الخصائص الفيزيائية: فضي فاتح
القلويات الكاوية
تشكل القلويات هيدروكسيدات الفلزات القلوية للمجموعة الأولى من المجموعة الفرعية الرئيسية عندما تذوب في الماء. الخصائص الفيزيائية: محاليل القلويات في الماء صابونية
أملاح الصوديوم والبوتاسيوم
أملاح الصوديوم والبوتاسيوم مع جميع الأحماض. أملاح الصوديوم والبوتاسيوم متشابهة جدًا في الخواص الكيميائية... لذلك فإن السمة المميزة لهذه الأملاح هي قابليتها للذوبان في الماء
الخصائص العامة لمجموعة البريليوم الفرعية
تشمل المجموعة الفرعية للبريليوم: البريليوم والمعادن الأرضية القلوية: المغنيسيوم والسترونشيوم والباريوم والكالسيوم والراديوم. الأكثر شيوعًا في الطبيعة كمركبات
الكالسيوم
الكالسيوم (Ca) - عنصر كيميائي من المجموعة الثانية من النظام الدوري ، هو عنصر قلوي أرضي. يتكون الكالسيوم الطبيعي من ستة نظائر مستقرة. أسيوط
أكسيد الكالسيوم وهيدروكسيد
أكسيد الكالسيوم (CaO) - الجير الحي أو الجير المحروق - مادة بيضاء مقاومة للحريق تتكون من البلورات. يتبلور في بلورة مكعبة محورها الوجه
عسر الماء وكيفية التخلص منه
نظرًا لانتشار الكالسيوم في الطبيعة ، توجد أملاحه بكميات كبيرة في المياه الطبيعية. تسمى المياه التي تحتوي على أملاح المغنيسيوم والكالسيوم f
الخصائص العامة لمجموعة البورون الفرعية
التكوين الإلكتروني الخارجي لجميع عناصر المجموعة الفرعية هو s2p1. الخاصية المميزة للمجموعة الفرعية IIIA هي الغياب التام للخصائص المعدنية في البورون و ty
الألومنيوم. تطبيقات الألمنيوم وسبائكه
يقع الألمنيوم في المجموعة الثالثة من المجموعة الفرعية الرئيسية ، في الفترة الثالثة. الرقم المسلسل 13. الكتلة الذرية ~ 27. عنصر ف. التكوين الإلكتروني: 1s22s22p63s23p1.Outside
أكسيد وهيدروكسيد الألومنيوم
أكسيد الألومنيوم - Al2O3. الخصائص الفيزيائية: أكسيد الألومنيوم عبارة عن مسحوق أبيض غير متبلور أو بلورات بيضاء شديدة الصلابة. الوزن الجزيئي \u003d 101.96 ، الكثافة - 3.97
الخصائص العامة لمجموعة الكروم الفرعية
تحتل عناصر المجموعة الفرعية للكروم موقعًا وسيطًا في سلسلة المعادن الانتقالية. يملك درجات حرارة عالية الذوبان والغليان والمساحات الفارغة على الإلكترونيات
أكاسيد وهيدروكسيدات الكروم
يشكل الكروم ثلاثة أكاسيد: CrO و Cr2O3 و CrO3. أكسيد الكروم الثاني (CrO) - أكسيد قاعدي - مسحوق أسود. عامل اختزال قوي. CrO يذوب في حمض الهيدروكلوريك المخفف
كرومات وثنائي كرومات
الكرومات هي أملاح حمض الكروميك H2Cr04 الموجود فقط محاليل مائية بتركيز لا يزيد عن 75٪. تكافؤ الكروم في الكرومات هو 6. كرومات
الخصائص العامة لعائلة الحديد
عائلة الحديد هي جزء من المجموعة الفرعية الجانبية للمجموعة الثامنة وهي الثالوث الأول فيها والذي يشمل الحديد والنيكل الكوبالت
مركبات الحديد
أكسيد الحديد (II) FeO عبارة عن مادة بلورية سوداء غير قابلة للذوبان في الماء والقلويات. الحديد O يتوافق مع القاعدة Fe (OH) 2.
عملية المجال
عملية فرن الانفجار - صهر الحديد في فرن الصهر. تم تجهيز الفرن العالي بالطوب المقاوم للحرارة بارتفاع 30 مترًا وقطرًا داخليًا 12 مترًا ، والنصف العلوي من
الحديد الزهر والفولاذ
خلائط الحديد - أنظمة معدنية، المكون الرئيسي منها هو الحديد. تصنيف سبائك الحديد: 1) سبائك الحديد مع الكربون (n
الماء الثقيل
الماء الثقيل - أكسيد الديوتيريوم D2O مع الأكسجين بتكوين نظائر طبيعي ، سائل عديم اللون ، عديم الرائحة والمذاق. كان الماء الثقيل مفتوحًا
الخصائص الكيميائية والفيزيائية.
تبلغ درجة غليان الماء الثقيل 101.44 درجة مئوية ودرجة انصهار 3.823 درجة مئوية. بلورات D2O لها نفس بنية بلورات الثلج العادية ، الفرق في الحجم
