Száraz sósav. Sósav sók
Hidrogén. A technikai sav sárgászöld színű a klór- és a vas-sók miatt. Maximális koncentráció Sósav körülbelül 36%; egy ilyen megoldás sűrűsége 1,18 g / cm 3, „dohányzik” a levegőben, mert a kialakult H apró cseppeket képez vízgőzzel.
Sósav század végén az alkimisták ismerték, akik asztali sót agyaggal vagy vas-vitriollal hevítve nyertek. A 17. század közepén „sósavnak” hívták. leírta I.R. Glauber aki felkészült Sósav kölcsönhatás a H 2 -val 4. A Glauber-módszert ma is alkalmazzák.
Sósav az egyik legerősebb sav. Oldódik (H 2 felszabadulásával és sók képződésével - kloridok ) a stressz tartományban lévő összes fém a hidrogénig. A kölcsönhatás során kloridok is képződnek Sósav fémek oxidjaival és hidroxidjaival. Erős oxidálószerekkel Sósav redukálószerként viselkedik, például: O 2 + 4H = Mn2 + 2 + 2H20.
Termelés Sósav az iparban két szakaszból áll: a H előállítása és víz általi felszívódása. A H előállításának fő módszere a 2 és a H 2 szintézise. A szerves vegyületek klórozásának melléktermékeként nagy mennyiségű H képződik: RH + 2 = RCI + H, ahol R jelentése szerves gyök.
Gyártott műszaki Sósav szilárdsága legalább 31% H (szintetikus) és 27,5% H (Na-ból származik). A kereskedelmi savat hígnak nevezzük, ha például 12,2% hidrogént tartalmaz; 24% és nagyobb H-tartalommal koncentráltnak nevezik. A laboratóriumi gyakorlatban 2n. A H-t (7%, sűrűség 1,035) általában hígnak nevezik Sósav
Sósav - a vegyipar legfontosabb terméke. Különféle fémek kloridjainak előállítására és klórtartalmú szerves termékek szintetizálására szolgál. Sósav Fémek maratására, különféle edények tisztítására, fúrások burkolatának csövek karbonátoktól, oxidoktól és egyéb üledékektől és szennyeződéstől való tisztítására szolgálnak. A kohászatban az érceket dolgozzák fel vele, a bőriparban - bőrt cserzés előtt. Sósav - fontos reagens a laboratóriumi gyakorlatban. Szállítás Sósav üvegpalackokban vagy gumírozott (gumiréteggel borított) fémtartályokban.
A H gáz mérgező. A H-nak való hosszan tartó expozíció a légutak hurutját, a fogszuvasodást, az orrnyálkahártya fekélyesedését és a gyomor-bélrendszeri rendellenességeket okoz. A H megengedett tartalma a dolgozó szobák levegőjében legfeljebb 0,005 mg / l.Védelem: gázálarc, védőszemüveg, gumikesztyű, cipő, kötény.
I.K. Malina.
Sósav gyomornedv tartalmaz (kb. 0,3%); elősegíti az emésztést és elpusztítja a betegségeket okozó baktériumokat.
BAN BEN orvosi gyakorlat elvált Sósav cseppekben és keverékekben használják együtt pepszin - a gyomornedv elégtelen savasságával járó betegségekben (például gyomorhurut), és hipokróm vérszegénység (vaskészítményekkel együtt azok felszívódásának javítása érdekében).
Cikk a "szó" szóról Sósav"a Nagy Szovjet Enciklopédiában 12940-szer olvasták
Lecke
Téma: Sósav
Célok:
Oktatási - a kutatás folyamán a sósav kémiai tulajdonságainak tanulmányozása és a kloridionra adott kvalitatív reakció megismerése.
Fejlesztés - további készségek fejlesztése a kémiai reakciók egyenleteinek összeállításához; megtanítani összehasonlítani, általánosítani, elemezni és levonni a következtetéseket.
Oktatási - a kognitív tevékenység fejlesztése kísérletezéssel.
Felszerelés: Prezentáció
Az órák alatt
Szervezeti szakasz
Jó napot kedves srácok!
A 21. századot joggal nevezik „a kémia korának”, „az új technológiák korának”. A modern művelt embereket pedig az jellemzi, hogy kémiailag hozzááll az önmaga, az egészsége és a környezet iránt. Kémiailag írástudóvá csak akkor válhatsz, ha tanulsz, ismered a körülötted lévő világot és a legtöbbet hatékony mód a megismerés kutatás. És ma a leckében ismét tudósok leszel - kutatók, egy tudományos laboratórium alkalmazottai, és mindegyikőtök kicsi, de független felfedezést tesz, amely lehetővé teszi, hogy mélyebben behatoljon a kémia nagy tudományának titkaiba.
2. Tudásmotiváció
A mai leckében olyan anyagról fogunk beszélni, amely nélkülözhetetlen nemcsak számos iparágban, hanem nagy szerepet játszik az emberi testben is. Sajnos szinte senki sem tudja, mennyire döntő jelentőségű ennek az anyagnak a normál tartalma a gyomorban. Amikor a test nem képes előállítani a szükséges mennyiségű gyomornedvet, akkor alacsony savtartalmú állapot lép fel, ezt hipo-savnak nevezik. Az alacsony savtartalom elkerülhetetlen káros hatással van az emésztésre, és zavarja az egészséghez szükséges tápanyagok felszívódását.
Ez az anyag az egyetlen sav, amelyet testünk állít elő. Az összes többi sav metabolikus melléktermék, és a lehető leghamarabb ki kell ürülni a szervezetből. Milyen savról beszélünk? A gyerekek válaszai. (A tanár a diákokkal együtt alkotja az óra témáját)
3 célzás
Nézd meg a lecke témáját, gondolkodj el, és együtt fogalmazzuk meg a lecke céljait, milyen kérdéseket kell megvizsgálnunk ma. Így,
Fedezd fel a sósav története, előállítási módszerei és fizikai tulajdonságai
Fedezd fel a sósav kémiai tulajdonságai
Dolgozzon ki készségek a kémiai reakciók egyenleteinek összeállításához
4. Tudásfrissítés
Mit gondolsz a hidrogén-klorid és sósav ez egy anyag? Ha igen, miért? (A hallgatók válaszai). Akkor miért van két név? Milyen okból. Megkapjuk a helyes választ, ha megnézzük a „Oldódás hidrogén klorid"(Videó)
A tapasztalati kérdések vizsgálata: Milyen választ kapott? Helyes sósavoldat hidrogén klorid.
Mondja meg, hogy melyek a savak.
Melyek a savak általános kémiai tulajdonságai (hallgatók válaszai)
5 .Új anyagok megtanulása
1. A sósav felfedezésének története
T nehéz megmondani, ki és mikor kapott először sósavat. Mindenesetre tudjuk, hogy már a 15. század végén. alkimista Vaszilij Valentin és a XVI. Andreas Libavius \u200b\u200begy csodálatos életelixír szorgalmas keresése során timsóval és vitriollal kalcinált asztali sót kínált számunkra furcsa alkímiai eszközökben, és kapott egy olyan terméket, amelyet "savas alkoholnak" neveztek. Ez volt a ma már ismert sósav, természetesen nagyon tisztátalan.
Az első felfedezők számára ez egy teljesen új, tulajdonságokkal bíró anyag volt, ami nagyon meghökkentette fantáziájukat. Megszagolva kapkodtak és köhögtek, "savanyú alkohol" füstölt a levegőben. Kóstolva megégette a nyelvet és a szájpadot, korrodálta a fémeket, tönkretette a szöveteket.
1658-ban J. R. Glauber (1604–1670) német vegyész megtalálta új út sósav előállítása, amelyet "sós alkoholnak" nevezett. Ezt a módszert a laboratóriumokban még mindig széles körben alkalmazzák. A konyhasót tömény kénsavval melegítette, és a felszabaduló "füstöt" vízzel szívta fel.
1772-ben J. Priestley angol kémikus (1733-1804) megállapította, hogy amikor a kénsav az asztali sóra hat, színtelen gáz szabadul fel, amelyet a higany felett összegyűjthetnek, és hogy ez a gáz rendkívül nagy mértékben képes vízben oldódni. Ennek a gáznak a vizes oldatát "sósavnak" nevezték el (acidum muriaticum)és Priestley "tiszta gáznemű sósavnak" nevezte a gázt.
2. Sósav előállítása
Videó: sósavat kapunk.
Ezt a gyártási módszert a 17. században Johann Glauber német vegyész javasolta, majdnem a 20. század közepéig Oroszországban alkalmazták. Most ezt a módszert alkalmazzák a hidrogén-klorid laboratóriumi előállítására.
Az egyik hallgató a táblához megy, és felírja a reakcióegyenletet.
NaCl (szilárd) + H2SO4 (tömény) \u003d HCl + NaHSO4
3. A sósav fizikai tulajdonságai
A sósav színtelen oldat, erősen füstöl a levegőben, a sziklacsík felszabadulása miatt csípős szagú. A maximális HCl-koncentráció - 37%, egy ilyen oldat sűrűsége 1, 18 g / cm3, egy savat hígítottnak nevezünk, ha 12% vagy kevesebb HCl-t tartalmaz. A laboratóriumban általában 7% HCl-t használnak, sűrűsége 1,035 g / cm3. Ez egy erős sav, ezért a savakkal való munkavégzés során a tuberkulózist figyelembe kell venni Erősen koncentrált sósav -maró anyag , bőrrel érintkezve erős kémiai anyagokat okoz ... A szemkontaktus különösen veszélyes. Az égési sérülések semlegesítésére általában gyenge lúgos oldatot használnak .
Ha tömény sósavval nyitja az edényeket, gőzölje meg vonzza a nedvességet a levegőben, köd képződik, amely irritálja a szemet és légutak személy. A sósav színtelen, maró folyadék, "füstölög" a levegőben. Erős elektrolit, és vizes oldatban teljesen diszociál klór- és hidrogénionokká:
HCl⇄ H (+) + Cl (-).
Határozzuk meg a kapcsolat típusát.
Ne feledje a linkek típusait.
A HCl-molekula klór- és hidrogénatomjai közötti kémiai kötés kovalens poláris kötés.
4. A sav kémiai tulajdonságai
Mielőtt elkezdenénk tanulmányozni a sósav kémiai tulajdonságait, ismételjük meg a T.B szabályait
Ismétlés edzéssel, TB savakkal végzett munka során.
A bőrrel érintkező savak égési sérüléseket okozhatnak. Súlyosság kémiai égés a sav erősségétől és koncentrációjától függ. Savasüveg használata esetén győződjön meg arról, hogy minden palackon egyértelműen megnevezik a savat. A savat úgy kell önteni, hogy az üveg megdöntésekor a címke a tetején legyen, hogy elkerülje annak károsodását. A savat óvatosan kell önteni, ne engedje, hogy a sav a bőrre, dolgokra, padlóra kerüljön.
Elsősegély . Az érintett bőrfelületet erősen csúszó hideg vízárammal mossuk 10-15 percig. öblítés után 2% -os szódabikarbóna vizes oldatában áztatott gézkötést vagy vattapamacsot visznek fel az égett helyre. 10 perc múlva. az öntetet eltávolítják, a bőrt megmossák, a nedvességet szűrőpapírral vagy puhával óvatosan eltávolítják ruhával és glicerinnel bekenve a fájdalom csökkentése érdekében.
Emlékezzünk a savak általános tulajdonságaira (edző válaszai)
A hallgatók csoportokban vizsgálják a sósav kémiai tulajdonságait. Minden csoport kap egy utasításkártyát.
Asztalain utasításkártyák, felszerelések és reagensek találhatók. Gondosan olvassa el az utasításokat, hajtsa végre a kísérleteket, betartva a biztonsági szabályokat.
A sav kémiai tulajdonságai
Ön szerint milyen kémiai tulajdonságokkal kell rendelkeznie a sósavnak? A hallgatók megfogalmazzák hipotézis.
Minta válaszok:
Ha NS l egy sav, akkor minden savnak meg kell lennie.
A HCl tulajdonságai hasonlóak a savakéhoz. Mi a közös a sósavban és más savakban? (A sav tulajdonságait meghatározó H + ion jelenléte)
Tapasztalat 1. Az indikátor színének megváltoztatása.
Öntsön 2-3 csepp sósavoldatot 3 kémcsőbe.
Adjunk hozzá 1 csepp metil-narancsot, fenolftaleint és lakmuszot a sósavoldathoz.
Milyen változások zajlanak?
Következtetések:
2. tapasztalat. A sósav és a fémek kölcsönhatása.
Milyen változások zajlanak?
Írja fel a reakcióegyenletet!
Következtetés: A HCl kölcsönhatásba lép a fémekkel a tevékenységek tartományában (kiszorítják a hidrogént a savakból)
Mg + 2HCl \u003d MgCl2 + H2,
3. tapasztalat: kölcsönhatás oxidokkal.
Helyezzen egy kis mennyiségű kalcium-oxidot egy kémcsőbe.
A kapott oldathoz cseppenként hozzáadunk sósavoldatot, és töltsük fel a reakcióegyenletet.
Következtetés:
3. tapasztalat. A sósav és bázisok kölcsönhatása.
4.1. A sósav és az oldható bázisok kölcsönhatása.
Milyen változások zajlanak?
A kapott oldathoz cseppenként hozzáadunk sósavoldatot, amíg a szín el nem tűnik. Mi a neve a sav és az alkál reakciójának
Írja fel a reakcióegyenletet!
Következtetés:A bázisos savak semlegesítési reakcióba lépnek
HCl + NaOH \u003d NaCl + H20
Írja fel a reakcióegyenletet!
Mi a közös a sósavban és más savakban? (A sav tulajdonságait meghatározó H + ion jelenléte)
A HCl rendelkezik-e olyan tulajdonságokkal, amelyek csak rá és sóira jellemzőek?
Igen, van ilyen tulajdonság. Ez egy minőségi reakció a kloridionra.
Kölcsönhatás sókkal
5. tapasztalat. Minőségi reakció kloridionra.
Tegyen 2-3 csepp sósavoldatot és kálium-klorid-oldatot a lemez két üregébe cseppanalízishez.
Minden cellába adjon 2-3 csepp ezüst-nitrát oldatot.
Milyen változások zajlanak?
Írjon molekuláris és tömör ionos reakcióegyenleteket!
Következtetés: Az ezüst-nitráttal való kölcsönhatás a sósav és sói sajátos tulajdonsága.
A kvalitatív reakciók lehetővé teszik az egyik vagy másik ion, kémiai vagy funkcionális csoport kimutatását
5. Az ismeretek rendszerezése
A - 2,44 és 1,258, klór
B - 3,44 és 2,258, klór
G - 4 és 2, hidrogén-klorid
6. Tükröződés
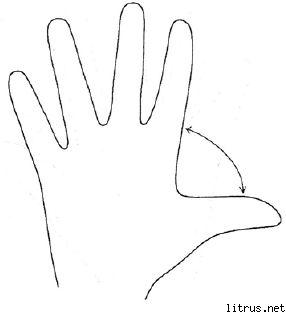
Ötujjas módszer.
M
B
TÓL TŐL (közepes) - lelkiállapot.
Van
B
7. D / Z
Teljes név és _________________________________________________________________________
Sósav____________________________________________________________________________________________________________________________________________________
Felfedezés története
Vaszilij Valentin és Andreas Libaviy _____________________________________________________________________________________________________________________________________________________________
Johann Rudolf Glauber __________________________________________________________________________________________________________________________________________________________________________________________
J. Priestley ______________________________________________________________________________________________________________________________________________________________________Sósav előállítása
__________________________________________________________________________________________________________________________________
A sav fizikai tulajdonságai
_____________________________________________________________________________________________________________________________________________
A sav kémiai tulajdonságai
A mutatókkal kapcsolatos fellépés
1. Öntsön 2-3 csepp sósavoldatot 3 kémcsőbe.
Az első csőbe 1 csepp metil-narancsot, a második csőbe 1 csepp fenolftaleint és a harmadik csőbe 1 csepp lakmuszot adunk. Milyen változások zajlanak?
Indikátor
Szín savas oldatban
Metil narancs
Fenolftalein
Lakmusz
Következtetések:
2. A sósav és a fémek kölcsönhatása.
Helyezze a cinkgranulátumot az 1. kémcsőbe és a rézforgácsot a 2. kémcsőbe.
Öntsön 1-2 ml sósavoldatot mindegyik csőbe.
Milyen változások mennek végbe? ___________________________________________
Írja fel a reakcióegyenletet!
______________________________________________________________________________________________________________________________________________________________________________________________________
Következtetések:
Kölcsönhatás oxidokkal
Öntsön egy kanál kalcium-oxidot egy kémcsőbe.
Adjon 1 ml sósavoldatot a kémcsőbe
Jegyezzük fel a csapadék feloldódását.
Írja fel a reakcióegyenleteket!
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Következtetések:
4. A sósav és bázisok kölcsönhatása.
A sósav és az oldható bázisok kölcsönhatása.
Tegyen egy 2-3 csepp nátrium-hidroxid-oldatot egy kémcsőbe.
Adjon 1 csepp fenolftaleint ehhez az oldathoz
Milyen változások mennek végbe? __________________________________________
A kapott oldathoz cseppenként hozzáadunk sósavoldatot, amíg a szín el nem tűnik. Mi a neve a sav és lúg reakciójának __________________________
Írja fel a reakcióegyenletet!
____________________________________________________________________________________________________________________________________________________________________
Következtetés:
A sósav és oldhatatlan bázisok kölcsönhatása
A sósav és a sók kölcsönhatása.
1. Öntsön egy kanál nátrium-karbonátot egy kémcsőbe.
2. Adjon 1 ml sósavoldatot a kémcsőbe
3. Milyen változások mennek végbe? __________________________________________
4. Írja fel a reakcióegyenleteket!
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Következtetések:
Minőségi reakció kloridionra.
Vegyünk két kémcsövet. Öntsön 1 ml sósavoldatot egybe. Adjunk hozzá 1 ml bárium-klorid-oldatot a másikhoz.
Minden csőbe adjon 2-3 csepp ezüst-nitrát oldatot.
Milyen változások zajlanak?
Írja fel a reakcióegyenleteket!
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Következtetés:
Minőségi reakció ____________________________________________________________________________________________________________________________________________________________________________
A helyes állítások
Sósav:
Megváltoztatja az indikátor színét
Kölcsönhatásba lép
Oldható bázisok
Oldhatatlan bázisok
Savas oxidok
Bázikus oxidok
Gyengébb savak sói
Erősebb savak sói
Fémek állnak H felé
Fémek H után
Számítsa ki a klór és a hidrogén-klorid relatív sűrűségét a levegőben. Melyik gáz nehezebb?
A - 2,44 és 1,258, klór
B - 3,44 és 2,258, klór
B - 1,258 és 2,44, hidrogén-klorid
G - 4 és 2, hidrogén-klorid
Visszaverődés
Ötujjas módszer.
M (kisujj) - gondolkodási folyamat. Milyen tudást és tapasztalatot kaptam ma?
B (név nélkül) - célközelség. Mit tettem ma és mit értem el?
TÓL TŐL (közepes) - lelkiállapot. Milyen volt a mai hangulatom?
Van (index) - szolgáltatás, segítségnyújtás. Hogyan segítettem ma, hogyan tetszett vagy mit tettem hozzá?
B (nagy) - vidámság, fizikai erőnlét. Mi volt a mai fizikai állapotom? Mit tettem az egészségem érdekében?
Sósavas sók vagy kloridok- klórvegyületek minden olyan elemgel, amelyek alacsonyabb elektronegativitási értékkel rendelkeznek.
Fém-kloridok- szilárd anyagok. Többnyire jól oldódik vízben, de AgCl, CuCl, HgCl2, TlCl és PbCl2- enyhén oldódik. Az alkáli- és alkáliföldfém-kloridok semlegesek. A kloridatomok számának növekedése a kloridmolekulákban a kémiai kötés polaritásának és a kloridok hőstabilitásának csökkenéséhez, illékonyságuk és hidrolízishajlamuk növekedéséhez vezet. Más fémek kloridoldatai savas reakcióval rendelkeznek a hidrolízis következtében:
A nemfémek kloridjai olyan anyagok, amelyek bármilyen aggregációs állapotban lehetnek: gázneműek (HCl), folyékonyak (PCl3) és szilárdak (PCl5). Vegyen részt egy hidrolízis reakcióban is:
A nemfémek egyes kloridjai összetett vegyületek, például a PC15 [PCl4] + és [PCl6] - ionokból áll. A bróm és a jód kloridjait interhalogén vegyületeknek nevezzük. Számos kloridot a folyadék- és gázfázisokban való asszociáció és polimerizáció jellemez, az atomok között pedig kloridhidak képződnek.
Fogadás.Ezeket a fémek klórral történő reakciójával vagy a sósav és a fémek, azok oxidjainak és hidroxidjainak kölcsönhatásával nyerik, néhány sóval cserélve is:
Határozzuk meg a klóriont minőségileg és mennyiségileg ezüst-nitrát alkalmazásával. Ennek eredményeként fehér pehely csapadék keletkezik.
Kloridoktermelésben és szerves szintézisben használják. Az illékony kloridok képződése számos színesfém és ritka fém dúsításán és elválasztásán alapul. Nátrium-klorid- nátrium-hidroxid, sósav, nátrium-karbonát, klór előállításához. Az élelmiszeriparban és a szappangyártásban is használják. Kálium klorid- káliumtrágyaként. Bárium-klorid- eszköz a rovarkártevők elleni védekezésre. Cink-klorid- fa impregnálására, bomlás elleni védőszerként, fém forrasztásakor. Kalcium-kloridvízmentes anyagokat (gázokat) szárítanak az orvosi gyakorlatban, kristályos hidrátját hűtőszerként. Ezüst-kloridfénykép készítésére használják. Higany-klorid- mérgező vegyület, amelyet magkezelőként, bőrcserzőként, szövetfestésként használnak. A szerves szintézis katalizátoraként működik. Fertőtlenítőszerként. Ammónium-kloridfestékiparban, galvanizálásban, forrasztásban és ónozásban használják.
Munka vége -
Ez a téma a következő szakaszhoz tartozik:
Szervetlen kémia csalólap
Csalólap a szervetlen kémiáról ... Olga Vladimirovna Makarova ...
Ha további anyagra van szüksége erről a témáról, vagy nem találta meg azt, amit keresett, javasoljuk, hogy használja a keresést a munkabázisunkban:
Mit fogunk tenni a beérkezett anyaggal:
Ha ez az anyag hasznosnak bizonyult az Ön számára, elmentheti a közösségi hálózatok oldalára:
| Csipog |
A szakasz összes témája:
Az anyag és annak mozgása
Az anyag egy objektív valóság, amely a mozgás tulajdonságával rendelkezik. Minden létező a mozgó anyag különböző típusai. Az anyag a tudattól függetlenül létezik
Anyagok és változásuk. Szervetlen kémia tárgya
Anyagok - olyan anyagtípusok, amelyek különálló részecskéinek véges nyugalmi tömege van (kén, oxigén, mész stb.). A fizikai testek anyagokból állnak. Minden egyes
Periódusos rendszer elemei D.I. Mendelejev
Az időszakos törvényt 1869-ben fedezte fel D.I. Mendelejev. Emellett létrehozta a kémiai elemek osztályozását, periodikus rendszer formájában kifejezve. Kupola
Mendelejev periódusos rendszerének értéke.
Az elemek periódusos rendszere volt a kémiai elemek első természetes osztályozása, amely megmutatta, hogy összekapcsolódnak egymással, és további kutatásként is szolgált.
A kémiai szerkezet elmélete
A kémiai szerkezet elméletét A.M. Butlerov, a következő pozíciókkal rendelkezik: 1) a molekulák atomjai kapcsolódnak egymáshoz
A P-, S-, D-elemek általános jellemzői
A Mendelejev periodikus rendszerének elemeit s-, p-, d-elemekre osztják. Ezt a felosztást az alapján hajtják végre, hogy egy elem atomjának hány szintje van
Kovalens kötés. Valence kötés módszer
Az antiparalell pörgésű kapcsolt atomok héjában keletkező közös elektronpárok által végrehajtott kémiai kötést atomnak vagy kovalensnek nevezzük.
Nem poláros és poláris kovalens kötések
Kémiai kötés segítségével az anyagok összetételében lévő elemek atomjai egymás közelében vannak. A kémiai kötés típusa az elektron sűrűségének megoszlásától függ a molekulában.
Multicentrikus kommunikáció
A vegyértékkötések módszerének kidolgozása során kiderült, hogy a molekula valós tulajdonságai közbülsőnek bizonyulnak a megfelelő képlettel leírtak között. Ilyen molekulák
Ionos kötés
Az élesen kifejezett ellentétes tulajdonságokkal rendelkező atomok (tipikus fém és tipikus nem fém) közötti kötés, amely között elektrosztatikus vonzerők keletkeznek
Hidrogén kötés
A 80-as években a XIX. M.A. Ilyinsky N.N. Beketov megállapította, hogy egy fluor-, oxigén- vagy nitrogénatommal kombinált hidrogénatom képes kialakulni
Energia átalakítása kémiai reakciókban
Kémiai reakció - egy vagy több kiindulási anyag átalakulása másokká kémiai összetétel vagy az anyag szerkezete. Az atomreaktorokhoz képest
Láncreakciók
Vannak olyan kémiai reakciók, amelyekben az összetevők közötti kölcsönhatás meglehetősen egyszerű. A komplex reakciók nagyon tág csoportja van. Ezekben a reakciókban
A nemfémek általános tulajdonságai
A nemfémek Mendelejev periodikus rendszerében elfoglalt helyzete alapján meg lehet határozni azok jellemző tulajdonságait. Meghatározhatja az elektronok számát a külső en
Hidrogén
Hidrogén (H) - Mendelejev periodikus rendszerének 1. eleme - I. és VII. Csoport, fő alcsoport, 1. periódus. A külső s1 alszintben 1 vegyérték elektron és 1 s2 van
Hidrogén-peroxid
A peroxid vagy a hidrogén-peroxid a hidrogén (peroxid) oxigénvegyülete. Képlet: Н2О2 Fizikai tulajdonságok: hidrogén-peroxid - színtelen szirup
A halogén alcsoport általános jellemzői
Halogének - a VII csoport elemei - fluor, klór, bróm, jód, asztatin (radioaktivitása miatt az astatint kevéssé tanulmányozzák). A halogének nagyon hangsúlyos nemfémek. Csak jód a re-ben
Klór. Hidrogén-klorid és sósav
A klór (Cl) a 3. periódusban, a periodikus rendszer fő alcsoportjának VII. Csoportjában található, 17. atomszám, 35.453 atomtömeg; halogénekre utal.
Rövid információ a fluorról, a brómról és a jódról
Fluor (F); bróm (Br); a jód (I) a halogének csoportjába tartozik. A periódusos rendszer fő alcsoportjának 7. csoportjában állnak. Általános elektronikus képlet: ns2np6.
Az oxigén alcsoport általános jellemzői
Az oxigén, vagy kalkogének alcsoportja - a D.I. Mendeleva, amely a következő elemeket tartalmazza: 1) oxigén - O; 2) kén
Oxigén és tulajdonságai
Az oxigén (O) az 1. periódusban, a VI. Csoportban található a fő alcsoportban. p-elem. Elektronikus konfiguráció 1s22s22p4. Az elektronok száma a külső ur-on
Az ózon és tulajdonságai
Szilárd állapotban az oxigénnek három módosulata van :? - ,? - és? - módosítások. Az ózon (O3) az oxigén egyik allotrop modifikációja
A kén és tulajdonságai
A kén (S) természetesen vegyületekben és szabad formában fordul elő. A kénvegyületek is gyakoriak, mint például az ólomfény, PbS, cinkkeverék ZnS, rézfény, Cu
Kénhidrogén és szulfidok
A hidrogén-szulfid (H2S) egy színtelen gáz, amelynek bomló fehérje szúrós szagú. A természetben vannak ásványi források, vulkanikus gázok, rothadó hulladékok, valamint
Kénsav tulajdonságai és gyakorlati jelentősége
A kénsavképlet felépítése: Előállítás: a kénsav SO3-ból történő előállításának fő módszere az érintkezési módszer.
Kémiai tulajdonságok.
1. A tömény kénsav erős oxidálószer. A redox-reakciók melegítést igényelnek, és a reakciótermék főleg SO2.
Fogadás.
1. Az iparban a nitrogént a levegő cseppfolyósításával nyerik, majd párologtatják és a nitrogént elválasztják a levegő egyéb gázfrakcióitól. A kapott nitrogén nemesgáz-keverékeket tartalmaz (argon).
A nitrogén alcsoport általános jellemzői
A nitrogén alcsoport az ötödik csoport, a D.I fő alcsoportja. Mendelejev. Elemeket tartalmaz: nitrogén (N); foszfor (P); arzén (
Ammónium (nitrogén-klorid).
Termelés: az iparban a 19. század végéig az ammóniát melléktermékként nyerték a szén kokszolása során, amely legfeljebb 1-2% nitrogént tartalmaz. Az elején
Ammóniumsók
Az ammóniumsók összetett anyagok, amelyek ammónium-kationokat (NH4 +) és savas maradékokat tartalmaznak. Fizikai tulajdonságok: ammóniumsók - t
Nitrogén-oxidok
Oxigénnel N oxidokat képez: N2O, NO, N2O3 NO2, N2O5 és NO3. I nitrogén-oxid - N2O - dinitrogén-oxid, "nevetőgáz". Fizikai tulajdonságok:
Salétromsav
A salétromsav színtelen folyadék, amely éles szagú "füstölög" a levegőben. Kémiai képlet HNO3. Fizikai tulajdonságok hőmérsékleten
A foszfor allotróp módosításai
A foszfor számos allotrop modifikációt alkot - módosítást. A foszfor allotróp módosításainak jelenségét különféle kristályos formák képződése okozza. Fehér foszfo
Foszfor-oxidok és foszforsavak
A foszfor eleme számos oxidot képez, amelyek közül a legfontosabbak a P2O3 foszfor (III) -oxid és a P2O5 foszfor (V) -oxid. Phos-oxid
Foszforsavak.
Számos sav felel meg a foszforsavanhidridnek. A legfontosabb az ortofoszforsav H3PO4. A dehidratált foszforsav színtelen átlátszó kristályok formájában jelenik meg
Ásványi műtrágyák
Ásványi műtrágyák - szervetlen anyagok, főleg sók, amelyek a növények számára szükséges tápanyagokat tartalmazzák és a termékenység növelésére szolgálnak
Szén és tulajdonságai
A szén (C) tipikus nemfém; a periódusos rendszerben a IV. csoport 2. periódusában, a fő alcsoportban található. 6. atomszám, Ar \u003d 12.011 amu, a mag töltése +6.
A szén allotróp módosításai
A szén 5 allotrop modifikációt alkot: köbös gyémánt, hatszögletű gyémánt, grafit és a karabin két formája. A meteoritokban talált hatszögletű gyémánt (ásványi anyag)
Szén-oxidok. szénsav
Az oxigénnel rendelkező szén oxidokat képez: СО, СО2, С3О2, С5О2, С6О9 stb. Szén-monoxid (II) - СО. Fizikai tulajdonságok: szén-monoxid, b
A szilícium és tulajdonságai
A szilícium (Si) a periodikus rendszer fő alcsoportjának 3. periódusának IV. Csoportjába tartozik. Fizikai tulajdonságok: a szilícium két változatban létezik: amo
A primer részecskék belső szerkezetének három típusa van.
1. A szuszpenzoidok (vagy irreverzibilis kolloidok) heterogén rendszerek, amelyek tulajdonságait egy kifejlesztett interfész határozhatja meg. A szuszpenziókhoz képest jobban eloszlik
Kovasav-sók
A kovasavak általános képlete n SiO2 m m H2O. A természetben főleg sók formájában találhatók, kevesen szabad formában vannak izolálva, például HSiO (orto
Cement és kerámia fogadása
A cement az építkezés legfontosabb anyaga. A cementet agyag és mészkő keverékének égetésével nyerik. CaCO3 (szóda) keverékének tüzelésénél
A fémek fizikai tulajdonságai
Minden fémnek számos közös, jellegzetes tulajdonsága van. Általános tulajdonságok figyelembe veszik: magas elektromos és hővezető képesség, plaszticitás. A met paramétereinek elterjedése
A fémek kémiai tulajdonságai
A fémek alacsony ionizációs potenciállal és elektron-affinitással rendelkeznek, ezért kémiai reakciókban redukálószerként, oldatokban képződve
Fémek és ötvözetek a technológiában
A 110 ismert elemből álló periódusos rendszerben 88 fém. A XX. Században a nukleáris reakciók segítségével radioaktív fémeket nyertek, amelyek nem
A fémek előállításának fő módszerei
Nagyszámú fém található meg a természetben vegyületek formájában. A natív fémek azok, amelyek szabad állapotban találhatók (arany, platina, p
Fémek korróziója
A fémek korróziója (korrózió - korrózió) a fémek és ötvözeteik fizikai és kémiai reakciója a fémekkel a környezet, aminek következtében elveszítik tulajdonságait. A
A fémek védelme a korrózió ellen
A fémek és ötvözetek korrózió elleni védelme agresszív környezetben a következőkön alapul: 1) az anyag korrózióállóságának növelése; 2) az agresszivitás csökkenése
A lítium alcsoport általános jellemzői
Lítium alcsoport - 1 csoport, a fő alcsoport - alkálifémeket tartalmaz: Li - lítium, Na - nátrium, K - kálium, Cs - cézium, Rb - rubídium, Fr - francium. Teljes elektron
Nátrium és kálium
A nátrium és a kálium - alkálifémek a fő alcsoport 1. csoportjába tartoznak. Fizikai tulajdonságok: hasonló fizikai tulajdonságok: világos ezüst
Maró lúgok
A lúgok a fő alcsoport 1. csoportjába tartozó alkálifémek hidroxidjait képezik, ha vízben oldják őket. Fizikai tulajdonságok: a lúgok vizes oldatai szappanosak
Nátrium- és káliumsók
A nátrium és a kálium sót képez az összes savval. A nátrium- és káliumsók nagyon hasonlóak kémiai tulajdonságok... Ezeknek a sóknak jellemző jellemzője a vízben való jó oldékonyság
A berillium alcsoport általános jellemzői
A berillium alcsoportba tartoznak: berillium és alkáliföldfémek: magnézium, stroncium, bárium, kalcium és rádium. A természetben leggyakrabban vegyületekként
Kalcium
A kalcium (Ca) - a periodikus rendszer 2. csoportjának kémiai eleme alkáliföldfém elem. A természetes kalcium hat stabil izotópból áll. Konf
Kalcium-oxid és hidroxid
A kalcium-oxid (CaO) - oltatlan vagy égetett mész - fehér, tűzálló anyag, amelyet kristályok képeznek. Kocka alakú, arccentrikus kristályban kristályosodik
A vízkeménység és annak megszüntetése
Mivel a kalcium elterjedt a természetben, sói nagy mennyiségben találhatók meg a természetes vizekben. A magnézium- és kalcium-sókat tartalmazó vizet f-nek nevezzük
A bór alcsoport általános jellemzői
Az alcsoport összes elemének külső elektronikus konfigurációja az s2p1. A IIIA alcsoport jellemző tulajdonsága, hogy a bórban és a ty-ban a fémes tulajdonságok teljesen hiányoznak
Alumínium. Alumínium és ötvözeteinek alkalmazása
Az alumínium a fő alcsoport 3. csoportjában található, a 3. időszakban. Sorszám 13. Atomtömeg ~ 27. P-elem. Elektronikus konfiguráció: 1s22s22p63s23p1.Külső
Alumínium-oxid és -hidroxid
Alumínium-oxid - Al2O3. Fizikai tulajdonságok: az alumínium-oxid fehér amorf por vagy nagyon kemény fehér kristályok. Molekulatömeg \u003d 101,96, sűrűség - 3,97
A króm alcsoport általános jellemzői
A króm alcsoport elemei köztes helyet foglalnak el az átmeneti fémek sorozatában. Van magas hőmérséklet olvadó és forró, üres helyek az elektronikus
Króm-oxidok és -hidroxidok
A króm három oxidot képez: CrO, Cr2O3 és CrO3. Króm II-oxid (CrO) - bázikus oxid - fekete por. Erős redukálószer. A CrO híg sósavban oldódik
Kromátok és dikromátok
A kromátok csak a H2Cr04 krómsav sói vizes oldatok legfeljebb 75% -os koncentrációval. A króm vegyértéke a kromátokban 6. A kromátok igen
A vascsalád általános jellemzői
A vascsalád a nyolcadik csoport oldalsó alcsoportjának része, és az első triád, amely vasat, kobalt-nikkelt tartalmaz
Vasvegyületek
Vas-oxid (II) FeO fekete kristályos anyag, vízben és lúgokban oldhatatlan. A FeO megfelel a bázis Fe (OH) 2-nak.
Domain folyamat
Nagyolvasztó eljárás - vasolvasztás nagyolvasztóban. A kohót 30 m magas és 12 m belső átmérőjű tűzálló téglákkal helyezzük el. A felső fele w
Öntöttvas és acél
Vasötvözetek - fém rendszerek, amelynek fő alkotóeleme a vas. Vasötvözetek osztályozása: 1) vas ötvözetei szénnel (n
Nehézvíz
Nehézvíz - természetes izotóp összetételű oxigénnel rendelkező D2O deutérium-oxid, színtelen folyadék, szagtalan és íztelen. A nehéz víz nyitva volt
Kémiai és fizikai tulajdonságok.
A nehézvíz forráspontja 101,44 ° C, olvadáspontja pedig 3,823 ° C. A D2O kristályok szerkezete megegyezik a szokásos jégkristályokéval, a méretbeli különbség
