A kén fizikai és kémiai tulajdonságai. A kén az
Elektronok elhelyezése a külső réteg pályáin
A kénatomon 6 vegyértékelektron van, ezért a kén akár 6 vegyértékkötést is létrehozhat. A kénatom sugara nagyobb, ezért kisebb az elektronegativitása, mint az oxigéné. A redoxi reakciókban megnyilvánuló oxidációs állapotok: S 0, S -2, S +4, S +6.
■ 68. Írja fel a kén és az egyszerű anyagok reakcióinak egyenleteit, amelyekre az alábbiakban hivatkozunk: Ezek a reakciók redoxok? Adjon indokolt választ.
69. Mi a kén oxidációs állapota a hidrogénnel és fémekkel rendelkező vegyületekben?
70. Milyen típusú kénvegyületek fémekkel?
71. Miért nem lehet cinket és alumíniumot előállítani oldatcserével?
72. Mennyi vas (II) -szulfid keletkezik, ha 30 g vasat és 16 g ként veszünk fel, és ha ezt csak 90% -ban használjuk?
Más reakciók is lehetségesek, amelyek eredményeként a kén pozitív oxidációs állapotokat kap. Ez általában a kén és az oxigén közvetlen kölcsönhatása során történik - a kén elégetése során:
S + O2 \u003d SO2
Mivel az oxigén elektronegativitási értéke magasabb, mint a kéné, az SO2 vegyületben található kén +4 oxidációs állapotot mutat, és ebben a reakcióban redukálószerként viselkedik. A kénsav-anhidrid képződésével a víz mélyebb oxidációja +6-os oxidációs állapotig lehetséges. Katalizátor jelenlétében 400-500 ° C hőmérsékleten a kén-dioxidot oxigén oxidálja, kén-anhidridet képezve:
2SО2 + О2 \u003d 2SО3
A magas kémiai aktivitás ellenére a kén meglehetősen széles körben megtalálható natív kénnek nevezett ásvány formájában. Szinte kizárólag rombos kénről van szó. A kén egyéb allotróp módosulása a természetben nem fordul elő.
A kén általában különböző kőzetekbe keveredik, amelyekből elég könnyen kiolvasztható. leggyakrabban vulkanikus eredetű. Gazdag az őshonos szürke Kaukázus, a Kara-Kum-sivatag, a Kerch-félsziget, Üzbegisztán.
A kén kénfémek, r-szulfidok (FeS2, cinkkeverék ZnS, ólomfény PbS) formájában is megtalálható, szulfátok formájában (Glauber sója Na2SO4 · 10H2O, CaSO4 · 2H2O). A kén néhány fehérjében megtalálható. A kő kinyerése érdekében a kőzetből 150-160 ° C-on túlhevített gőz hatására autoklávokban olvasztják fel. A kapott olvadt ként szublimálással finomítják (tisztítják). Ha megolvasztják és fa formákba öntik, akkor rudak formájában megszilárdul. Ezt a ként dugványnak nevezik.
Ábra: 52. A kén használata
Néha a ként egy nagy formába öntik, és megkeményedése után apró, alaktalan darabokra osztják. Ezt a ként rögösnek nevezik. Végül a kén finom porlasztott por formájában kapható - az úgynevezett kén színű.
A szabad ként főként a kénsav előállításában, valamint a papíriparban, a gumi vulkanizálására, a színezékek előállítására, a mezőgazdaságban szőlő és gyapot beporzására és füstölésére, gyufa gyártására használják (52. ábra). Az orvostudományban a ként kenőcsök formájában használják, más anyagokkal együtt a rüh és más bőrbetegségek ellen. A tiszta kén nem mérgező.
■ 73. Lista kémiai tulajdonságok kén, jelzem, mi a hasonlóság és mi a különbség a kén és az oxigén között.
57. Kétértékű kén vegyületei
A kétértékű kén hidrogénnel (H2S) és fémekkel (Na2S, FeS) vegyületeket képez. A szulfidok a hidrogén-szulfid, azaz a hidrogén-szulfid sav sóinak származékai.
Hidrogén-szulfid... A hidrogén-szulfid molekula a kötés poláris típusának megfelelően épül fel:
A közös elektronpárok erősen elfogultak az atom felé, a kén pedig elektronegatívabb.
A hidrogén-szulfid gáz nehezebb, mint a levegő, csípős kellemetlen szaga van a rothadt tojásoknak. Ez a gáz nagyon mérgező. A szaglásunk nagyon érzékeny a hidrogén-szulfidra. 1/2000 rész hidrogén-szulfid jelenléte a levegőben szagvesztést okozhat. Kis adagokban történő krónikus hidrogén-szulfid-mérgezés lesoványodást, fejfájást, fájdalmat okoz. Súlyosabb mérgezés esetén egy idő után ájulás léphet fel, és a nagyon erős koncentrációk a légzési bénulás következtében halált okoznak. Hidrogén-szulfiddal történő mérgezés esetén a tekercset friss levegőre kell vinni, és kis mennyiségű klórt kell belélegezni, valamint tisztítani kell. A megengedett legnagyobb kénhidrogén-koncentráció a dolgozó helyiségben 0,01 mg / l.
A hidrogén-szulfid -60 ° C hőmérsékleten folyékonyá válik. Jól oldódik vízben, miközben hidrogén-szulfid vizet képez H2Saq, vagy, ahogy más néven kén-hidrogén-savat képez.
A hidrogén-szulfid az egyik legjobb redukálószer. Könnyen redukálja a bróm- és klórvizet bróm- vagy sósavvá:
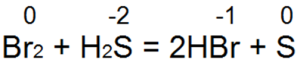
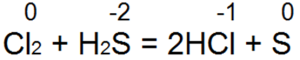
Ebben a reakcióban S (-2) semleges kénné S (0) oxidálódik.
A hidrogén-szulfid ég. Megfelelő levegő hozzáférés esetén (53. ábra, a) a teljes égés az alábbi egyenlet szerint történik:
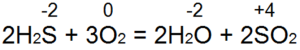
Ebben az esetben S (-2) oxidálódik S (+4) -re, 6 elektron adódik vissza), és O (0) -ról O (-2) -re redukálódik. Ha egy
a levegő hozzáférése nem megfelelő, vagy ha hideg tárgyat vezetnek be a kénhidrogén-lángba (53.6. ábra), akkor a teljes égés az egyenlet szerint történik:
2H2S + O2 \u003d 2S + 2H20
■ 74. Melyek az elsősegély-nyújtási intézkedések a hidrogén-szulfid mérgezéshez?
75. Miért hívják gyakran a kénsavat?
hidrogén-szulfid víz?
76. Ha a jódvizet hidrogén-szulfid vízzel keverjük, akkor az oldat elszíneződik és zavarosodik. Hogyan lehet ezt megmagyarázni?
77. Lehetséges-e, hogy az S (-2) oxidáló tulajdonságokat mutasson?
A laboratóriumban hidrogén-szulfidot nyernek a Kipp készülékben a vas-szulfid (vagy nátrium-szulfid) és híg kénsav kölcsönhatásával:
FeS + H2SO4 \u003d FeSО4 + H2S

Ábra: 53. Hidrogén-szulfid elégetése teljes levegő-hozzáféréssel (a) és hiányos levegő-hozzáféréssel (b).
A vízben oldódó hidrogén-szulfid gyenge kénsavat képez, amely két szakaszban disszociál:
H2S ⇄ Н + + HS - ⇄ 2Н + + S 2-
A második szakasz jelentéktelen.
A hidrogén-szulfid sav instabilitása miatt hosszú ideig nem tárolható a laboratóriumban. A szabad kén felszabadulása következtében fokozatosan zavarossá válik:
H2S \u003d H2 + S
Redox-reakciókban a hidrogén-szulfid-sav tipikus redukálószerként viselkedik, például:
H2S + К2Cr2O7 + H2SO4 → (S 0; Cr + 3)
Maga töltse ki ennek a redoxreakciónak az egyenletét.
A hidrogén-szulfidot az analitikai kémiában használják.
A hidrogén-szulfid-sav a savak általános tulajdonságait mutatja. Igaz, a savak nem minden tulajdonságát lehet megfigyelni rajta. Például, nem reagálnak vele, és a hidrogén-szulfid-savba kerülve, nem vele, hanem az ott lévő vízzel reagálnak, alkálit képezve, amely ezután reagálhat kén-hidrogén-savval. Mivel kétbázisú savról van szó, két sósort alkothat - szulfidokat és hidroszulfidokat vagy biszulfidokat.
A kénhidrogén-sav közepes sói - a szulfidok - vízben nem oldódnak, kivéve a nátrium- és káliumsókat, és különböző színűek: ólom és vas-szulfid - fekete, cink - fehér, kadmium - sárga. A hidroszulfidok vízben könnyen oldódnak.
Az S 2 kétértékű kénion reagense a Cd 2+ kadmiumion, amely az ionnal kombinálva sárga, vízben oldhatatlan csapadékot eredményez, például:
Cd (NO3) 2 + H2S \u003d CdS ↓ + 2HNO3
Cd 2+ + S 2- \u003d CdS
A szulfidok gyengén savak sóiként könnyen hidrolizálhatók, ezért általában a kén és a fém közvetlen kölcsönhatásával nyerik őket.
■ 78. Írja fel a kénsav és nátrium-hidroxid reakciójának egyenletét, és magyarázza el a reakció eredményét, figyelembe véve az oldat sójának hidrolízisét.
79. Az egészségügyi és higiéniai kutatások során oldható ólomsókkal nagyon érzékeny reakciót alkalmaznak a levegőben lévő kén-szulfid kimutatására. Mi figyelhető meg ezzel a reakcióval teljes ionos és redukált ionos formában?
58. § A négyértékű kén vegyületei
Négy vegyértékű kén - kén-dioxid (kén-dioxid) SO2 vegyülete. A kén-dioxid nehezebb, mint a levegő, és erős, kellemetlen szaga van. A kén-dioxid molekula szintén a kovalens kötés típusának megfelelően épül fel, polaritása gyengén kifejeződik. -10 ° C-on és légköri nyomáson a kén-dioxid folyadékká alakul, és -73 ° C-on megszilárdul. Könnyen oldódik vízben (1 térfogat vízhez 40 térfogat kén-dioxid), miközben az oldódás mellett vízzel kölcsönhatásba lép az egyenlet szerint:
SO2 + Н2О H2SO3
A kapott kénsav nagyon törékeny, ezért a reakció reverzibilis.
A kén-dioxid ipari jelentőséggel bír. FeS2 pirit vagy kén pörkölésével állítják elő:
4FeS2 + 11О2 \u003d 2Fe2О3 + 8SО2 S + О2 \u003d SO2
A laboratóriumban az erős savak kénsavas sókra gyakorolt \u200b\u200bhatásával nyerik, például a kénsav hatására:
Na2SO3 + H2SO4 \u003d Na2SO4 + H2O + SO2
A kén-dioxid a kénsav sóinak, például a kalcium-szulfit CaSO3-nak melegítéssel történő bontásával állítható elő.
CaSO3 \u003d CaO + SO2
A kén-dioxid mérgező. Mérgezés esetén rekedtség, légszomj, néha eszméletvesztés jelentkezik. A megengedett SO2 koncentráció a levegőben 0,02 mg / l.
Szerves festékekkel kölcsönhatásban a kén-dioxid elszíneződést okozhat, ennek oka azonban más, mint klórral történő fehérítéskor: oxidáció nem következik be, de egy színezékkel rendelkező színtelen SO2 vegyület jelenik meg, amely idővel elpusztul és a festék színe helyreáll.
■ 80. Javasoljon olyan eszközök rajzait, amelyek segítségével kén-dioxidot nyerhet: a) nátrium-szulfitból sav hatására: b) kalcinált kalcium-szulfit.
81. 40 g kalcium-szulfit bontásakor kapott kén-dioxidot 500 g Ba (OH) 2 barit-víz oldatán vezetjük át, amelynek eredményeként mindaz, ami oldatban van, kicsapódik. Mennyi a baritvíz aránya, ha az égetéssel keletkező kén-dioxid 20% -a elvész?
82. Milyen oxidok csoportjába tartozik a kén-dioxid? Sorolja fel az oxidok ezen csoportjára jellemző tulajdonságait. Támogassa válaszát a reakcióegyenletekkel.
83. Miért jelenik meg a zavarosság az SO2 mészvízen való áthaladásakor, valamint a CO2 elhaladásakor?
84. A levegő kén-dioxidot tartalmaz. Hogyan szabadítsd meg őt ettől a szennyezettségtől?
85. Mennyi kén-dioxid nyerhető 20 mol FeS2-ből 80% -os hozammal?
86. A kén-dioxidot 200 ml 20% -os nátrium-hidroxid-oldaton át vezetjük a nátrium-hidroxid szulfittá történő teljes átalakulásáig (a hidrolízist nem vesszük figyelembe). Mekkora a kapott nátrium-szulfit-oldat koncentrációja?
Annak a ténynek köszönhetően, hogy a kén oxidációs állapota a kén-dioxidban + 4, azaz hagyományosan 4 elektron adományozott a kénatom külső szintjéről, két lehetőség kínálkozik rá: vagy adományozhat további 2, a külső rétegben megmaradt elektront, és akkor megmutatja
egy redukálószer tulajdonságai, vagy S (+4) bizonyos számú elektron befogadására képes, és ezután oxidáló tulajdonságokkal rendelkezik.
Például erős oxidálószer jelenlétében S (+4) redukálószerként viselkedik.
Br2 + H2O + SO2 → H2SO4 + HBr
КМnO4 + Н2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2 (SO4) 3 + H2O
Saját maga keresse meg ezeknek a reakcióknak az együtthatóit.
Különösen fontos a kén-dioxid oxigénnel való oxidációja V2O5 vagy Pt katalizátor jelenlétében 400-500 ° C hőmérsékleten, amelynek eredményeként kénsav-anhidrid képződik:
2SO2 + O2 \u003d 2SO3
Ezt az eljárást széles körben alkalmazzák a kénsav érintkezési módszerrel történő előállításában.
Erős redukálószerek, például hidrogén-szulfid jelenlétében az S (+4) oxidáló szerként viselkedik: H2SO3 + H2S → H2O + S
Az elektronikus mérleg összeállításával keresse meg az egyenlet együtthatóit.
■ 87. Jegyzetfüzetbe írja fel a kén-dioxid fizikai és kémiai tulajdonságait, feljegyezve mind az oxidációs állapot megváltoztatása nélkül zajló reakciókat, mind a redox reakciókat.
88. Mi a kén-dioxid élettani hatása?
Mint már említettük, amikor a kén-dioxid vízben oldódik, kénsav képződik.
A kénsav közepes erősségű sav. Két szakaszban disszociál:
H2SO3 ⇄ 2 H + + HSO 3 - ⇄ 2H + + SO 2 3 -
A kénsav instabil, gyorsan kén-dioxiddá és vízzé bomlik:
H2SO3 ⇄ H2O + SO2
Ezért lehetetlen például olyan reakciót végrehajtani, amely aktívabb fémekkel rendelkezik, mint kénsavval.
Kétbázisú kénsav kétféle sót képezhet: közepes - szulfitok és savas - hidroszulfitok. Minden szulfit oldhatatlan só, az alkálifém és az ammónium-szulfit kivételével. A hidroszulfitok valamivel magasabbak. Ezeket a sókat erősebb savak képesek lebontani:
Na2SOs + H2S04 \u003d Na2SO4 + H2O + SO2
2NaHSО3 + H2SO \u003d Na2SО4 + 2H2О + 2SO2
A savak szulfitokra gyakorolt \u200b\u200bhatása kén-dioxidot eredményez, amelynek kellemetlen szaga van. Ezt a reakciót használják arra, hogy megkülönböztessék a kénsavas sókat a karbonátoktól, amelyek hasonló módon viselkednek, de a szén-dioxidnak nincs szaga.
A szulfitok meglehetősen könnyen hidrolizálódnak.
59. § A hat vegyértékű kén vegyületei
Mint már említettük, a kén-dioxid oxidációja SO3 kén-anhidridet eredményez, amely hat vegyértékű kénvegyület. Ha egy kén-anhidrid molekula képződik, a kén összes vegyérték-elektronja részt vesz a vegyérték-kötések kialakulásában, mint s- és r-borbitalok. A kén oxidációs állapota +6 maximálisan pozitív. Ezért az S +6 soha nem viselkedhet restaurátorként.
A kén-anhidrid fehér kristályos anyag. Olvadáspontja 17 °, forráspontja 45 °. A kén-anhidrid annyira higroszkópos, hogy nem tárolható közönséges edényekben. Zárt üveg ampullákban tárolják.
A kénsav-anhidrid egy savas oxid, amely minden jellemző tulajdonsággal rendelkezik ennek az anyagcsoportnak. Különösen vízzel reagálva kénsavat képez:
SO3 + H2O \u003d H2SO4
■ 89. Írja meg saját egyenleteit a kén-anhidrid bázisokkal és bázikus oxidokkal történő reakcióira.
A kén-anhidrid erős oxidálószer. A legfontosabb hat vegyértékű kénvegyület a H2SO4. Ez az egyik erős sav. kétfázisú és két szakaszban disszociál:
H2SO4 ⇄ Н + + HSО 4 - ⇄ 2Н + + SO 2 4 -

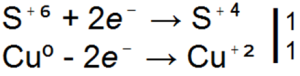
A tömény kénsav más módon reagál a hidrogénnél reaktívabb fémekkel, mint a híg kén. például nem helyettesíti a hidrogént tömény kénsavból, hanem a kénsavat kén-dioxiddá, szabad kénné vagy hidrogén-szulfiddá redukálja:
H2SO4 + Zn → ZnSО4 + SO2
H2SO4 + Zn → ZnSO4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. A kénsav és a cink reakcióinak fenti három egyenlete redox. Helyezze beléjük az együtthatókat az elektronikus mérleg alapján.
A vízmentes kénsavat monohidrátnak nevezzük. A monohidrát nem tartalmaz ionokat, ezért nem vezet elektromos áramot. A monohidrát jól felszívja a nedvességet. Mivel a kénsav és a fémek reakciója sok ionos, a monohidrát nem reagál néhány olyan fémmel, amely reakcióképesebb, mint a hidrogén, például a vas, így vastartályokban szállítható. , bármilyen koncentrációban ellenáll a kénsavnak. A tömény kénsav oxidál például néhány nemfémet is.
■ 93. Milyen hasonlóságok és különbségek vannak a kénsav és más savak között?
94. Végezhetőek-e olyan reakciók, amelyekben a kénsav csökkentő tulajdonságokkal rendelkezik?
95. Hogyan hajtsuk végre a következő átalakításokat:

Írja le a megfelelő reakciók egyenleteit! Redoxhoz készítsen egy elektronikus mérleget, írja fel az ionreakciók egyenleteit ionos formában.
96. Az egyik palackban kénsavoldat található, a másikban - salétromsavas, a harmadikban - sósavoldat. Hogyan lehet megkülönböztetni őket? 21
Kén
KÉN -y; g.
1. Kémiai elem (S); erősen gyúlékony sárga anyag (iparban, katonai ügyekben, mezőgazdaságban, orvostudományban használják).
2. Sárga, zsíros anyag, amely a hallójárat falain képződik. Tisztítsa meg a füleket a viasztól.
◁ Serny (lásd).
kén(lat. kén), a periodikus rendszer VI. csoportjának kémiai eleme. Sárga kristályok. Kétféle változatban stabil - rombikus (sűrűség 2,07 g / cm 3, t pl 112,8 ° C) és monoklinikában (sűrűség 1,96 g / cm 3, t olvadáspont: 119 ° C). Oldhatatlan vízben. Ellenáll a levegőnek; amikor az égetés SO 2 -ot eredményez, szulfidokat képez a fémekkel. A természetben - natív kén, szulfidok, szulfátok. A ként megolvasztják a natív ércekből; Ezeket a természetes, olaj- és kokszolókemence-gázokban található kén-hidrogén oxidációjával atmoszférikus oxigénnel és más módszerekkel is előállítják. A kén körülbelül 50% -át kénsav előállítására, 25% -át szulfitok előállítására használják (a papíriparban használják), a többit a növénybetegségek leküzdésére, a vulkanizálásra, a színezékek szintézisére, a gyufa gyártására stb.
KÉNCEPA (Latin-kén), S, 16-os kémiai elem, 32,066-os atomtömeg. A kén kémiai S szimbóluma "es". A természetes kén négy stabil nuklidból áll (cm. NUCLID): 32 S (tartalom 95,084 tömeg%), 33 S (0,74%), 34 S (4,16%) és 36 S (0,016%). A kénatom sugara 0,104 nm. Az ionok sugara: ion S 2 - 0,170 nm (koordinációs szám 6), ion S 4+ 0,051 nm (koordinációs szám 6) és S 6+ 0,026 nm ion (koordináció szám 4). Az S 0-tól S 6+ -ig terjedő semleges kénatom szekvenciális ionizációs energiái 10,36, 23,35, 34,8, 47,3, 72,5 és 88,0 eV. A kén D. I. Mendelejev periodikus rendszerének VIA csoportjában található, a 3. periódusban, és a kalkogének közé tartozik. A külső elektronréteg konfigurálása 3 s 2
3o 4
... A vegyületek legjellemzőbb oxidációs állapota –2, +4, +6 (valenciák, illetve II, IV és VI). A Paulingi elektronegativitás értéke 2,6. A kén nem fém.
A szabad formában lévő kén sárga, törékeny kristályok vagy sárga por.
Történelmi hivatkozás
A kén a természetben szabad (őshonos) állapotban található, így az ember már az ókorban ismerte. A kén jellegzetes színével, kék lángjával és az égés során keletkező sajátos szagával (kén-dioxid szaga) vonzotta a figyelmet. Úgy gondolták, hogy a kénégetés elűzi a gonosz szellemeket. A Biblia a kén használatáról beszél a bűnösök megtisztítására. A középkor embere társította a "kén" szagát az alvilággal. Homer említi az égő kén fertőtlenítéséhez való alkalmazását. Az ókori Rómában a szöveteket kén-dioxid segítségével fehérítették.
A ként már régóta használják az orvostudományban - lángjával a betegeket füstölgették, a bőrbetegségek kezelésére szolgáló különböző kenőcsökbe helyezték. A 11. században. Avicenna (Ibn Sina (cm. IBN SINA)), majd az európai alkimisták úgy vélték, hogy a fémek, beleértve az aranyat és az ezüstöt, különböző arányban tartalmaznak ként és higanyt. Ezért a kén fontos szerepet játszott az alkimisták azon kísérleteiben, hogy megtalálják a "filozófus kövét", és az nemesfémeket értékesekké változtassák. Században. Paracelsus (cm. PARACELS) ként tartják számon, a higany és a "só" mellett, a természet egyik fő "alapelve", minden test "lelke".
A kén gyakorlati jelentősége ugrásszerűen megnőtt a fekete por (amely szükségszerűen magában foglalja a ként is) feltalálása után. A bizánciak 673-ban, Konstantinápolyt védve, az úgynevezett görög tűz - salétrom, kén, gyanta és egyéb anyagok keverékével - elégették az ellenség flottáját, amelynek lángját víz nem oltotta el. A középkorban fekete lőport használtak Európában, összetételében közel a görög tűz keverékéhez. Azóta a ként széles körben használják katonai célokra.
A legfontosabb kénvegyület, a kénsav régóta ismert. Az iatrokémia egyik alapítója (cm. IATROKÉMIA), Vaszilij Valentin szerzetes, a 15. században. részletesen leírta a kénsav termelését vas-szulfát kalcinálásával (a kénsav régi neve vitriololaj).
A kén elemi jellegét A. Lavoisier 1789-ben állapította meg (cm. LAVOISIER Antoine Laurent)... A kéntartalmú vegyi anyagok megnevezései gyakran tartalmazzák a "tio" előtagot (például a fényképezés során használt Na 2 S 2 O 3 reagenst nátrium-tioszulfátnak hívják). Ennek az előtagnak az eredete a kén görög nevéhez fűződik - aion.
A természetben lenni
A kén meglehetősen elterjedt a természetben. A földkéregben annak tartalmát 0,05 tömeg% -ra becsülik. A natív kén jelentős lerakódásai gyakran megtalálhatók a természetben (általában vulkánok közelében); Európában Dél-Olaszországban, Szicíliában találhatók. Nagy mennyiségű natív kén található az Egyesült Államokban (Louisiana és Texas államokban), valamint Közép-Ázsiában, Japánban és Mexikóban. A természetben a kén mind a placerekben, mind pedig kristályos rétegek formájában megtalálható, néha elképesztően szép, áttetsző sárga kristályok csoportjait képezik (az úgynevezett druszok).
A vulkáni területeken gyakran megfigyelhető a H 2 S hidrogén-szulfid gáz felszabadulása a talajból; ugyanazon régiókban a kénes vizekben oldott hidrogén-szulfid található. A vulkanikus gázok gyakran tartalmaznak kén-dioxid SO 2 -ot is.
Különböző szulfidvegyületek betétjei elterjedtek bolygónk felszínén. A leggyakoribbak közülük: vaspirit (pirit (cm. PIRIT)) FeS 2, rézpirit (kalkopirit) CuFeS 2, ólomfény (cm. GALENIT) PbS, cinóber (cm. CINNABAR) HgS, szfalerit (cm. SPHALERITE) ZnS és kristályos módosító wurtzite (cm. WURTZIT), antimonit (cm. ANTIMONIT) Sb 2 S 3 és mások. Számos különféle szulfát lerakódás található, például kalcium-szulfát (gipsz CaSO 4 2H 2 O és anhidrit CaSO 4), magnézium-szulfát MgSO 4 (keserű só), bárium-szulfát BaSO 4 (barit), stroncium-szulfát SrSO 4 (celesztin), nátrium-szulfát Na 2 SO 4 · 10H 2 O (mirabilit) stb.
A bitumenes szenek átlagosan 1,0-1,5% ként tartalmaznak. A kén is az olaj része lehet. Számos természetes éghető gáz-lerakódás (például Astrakhanskoye) szennyezésként hidrogén-szulfidot tartalmaz.
A kén azon elemek közé tartozik, amelyek az élő szervezetek számára szükségesek, mivel a fehérjék nélkülözhetetlen alkotóeleme. A fehérjék 0,8-2,4 tömeg% kémiailag kötött ként tartalmaznak. A növények a talajban lévő szulfátokból nyernek ként. A rothadó állati tetemekből fakadó kellemetlen szagok elsősorban a kénvegyületek (hidrogén-szulfid és merkaptánok) felszabadulásának tudhatók be. (cm. THIOLS)) a fehérjék lebontása során képződött. A tengervízben körülbelül 8,7 · 10 -2% kén van.
Fogadás
A ként főként natív (elemi) ként tartalmazó kőzetekből olvasztva nyerik. Az úgynevezett geotechnológiai módszer lehetővé teszi a kén megszerzését anélkül, hogy ércet emelne a felszínre. Ezt a módszert a 19. század végén javasolták. G. Frash amerikai vegyész, aki azzal a feladattal szembesült, hogy ként nyerjen ki az Egyesült Államok déli részének lerakódásaiból a föld felszínére, ahol a homokos talaj élesen bonyolította kivonását a hagyományos bányamódszerrel.
Frasch túlmelegített vízgőz felhasználásával javasolta a kén felszínre emelését. A túlhevített gőzt egy csövön keresztül egy ként tartalmazó földalatti rétegbe vezetik. A kén megolvad (olvadáspontja valamivel 120 ° C alatt van), és egy olyan csövön keresztül emelkedik felfelé, amely azon belül helyezkedik el, amelyen keresztül a vízgőzt a föld alá pumpálják. A folyékony kén felszabadulásának biztosítása érdekében sűrített levegőt juttatunk a legvékonyabb belső csövön keresztül.
Egy másik (termikus) módszer szerint, amely különösen a 20. század elején terjedt el. Szicíliában a ként megolvasztják vagy szublimálják a zúzott kőzetből speciális agyagkemencékben.
Vannak más módszerek a natív kén kivonására a kőzetből, például szén-diszulfid extrakciós vagy flotációs módszerek.
Tekintettel arra, hogy az iparban nagyon nagy a kén iránti kereslet, kidolgozták a H 2 S hidrogén-szulfidból és a szulfátokból történő előállítására szolgáló módszereket.
A hidrogén-szulfid elemi kénné oxidálásának módszerét először Nagy-Britanniában fejlesztették ki, ahol N. Leblanc francia kémikus módszerével megtanultak jelentős mennyiségű ként nyerni a szódabevonat után megmaradt Na 2 CO 3 -ból. (cm. LEBLANN Nicola) kalcium-szulfid CaS. Leblanc módszere a nátrium-szulfát szénnel történő redukcióján alapul CaCO 3 mészkő jelenlétében.
Na2S04 + 2C \u003d Na2S + 2C02;
Na 2S + CaCO 3 \u003d Na 2 CO 3 + CaS.
Ezután a szódát vízzel kimossák, és a rosszul oldódó kalcium-szulfid vizes szuszpenzióját szén-dioxiddal kezelik:
CaS + CO 2 + H 2 O \u003d CaCO 3 + H 2S
A kapott levegővel kevert hidrogén-szulfid H2S-t a katalizátorágyon át vezetik a kemencébe. Ebben az esetben a hidrogén-szulfid hiányos oxidációja miatt kén képződik:
2H2S + O2 \u003d 2H20 + 2S
Hasonló eljárást alkalmaznak az elemi kén és a természetes gázokat kísérő kénhidrogén előállítására.
Mivel a modern technológia nagy tisztaságú ként igényel, kifejlesztve hatékony módszerek kénfinomítás. Ebben az esetben különösen a kén és a szennyeződések kémiai viselkedésében mutatkozó különbségeket alkalmazzák. Tehát az arzént és a szelént a kén salétromsav és kénsav keverékével történő kezelésével távolítják el.
Desztilláción és rektifikáláson alapuló módszerek alkalmazásával nagy tisztaságú ként nyerhetünk, amelynek szennyezőanyag-tartalma 10-5-10-6 tömeg%.
Fizikai és kémiai tulajdonságok
A kénatomoknak egyedülálló képességük van stabil homokáncok, azaz csak S atomokból álló láncok kialakítására (az S - S kötési energia körülbelül 260 kJ / mol). A kénhomokáncok cikcakk alakúak, mivel a szomszédos atomokban kölcsönösen merőleges p-pályákon elhelyezkedő elektronok részt vesznek kialakulásukban. Ezek a láncok nagy hosszúságot érhetnek el, vagy éppen ellenkezőleg, zárt gyűrűket alkothatnak S 20, S 8, S 6, S 4.
Ezért a kén több tíz kristályos és amorf módosulatot alkot, amelyek mind a molekulák, mind a polimer láncok összetételében, mind a szilárd állapotban történő csomagolásukban különböznek.
Normál nyomáson és 98,38 ° C-ig terjedő hőmérsékleten a kén a-módosulása stabil (egyébként ezt a módosítást rombikusnak nevezik), amely citromsárga kristályokat képez. Kristályrácsa ortorombos, az egységsejtek paraméterei a \u003d 1,04646, b \u003d 1,28660, c \u003d 2,4486 nm. Sűrűség: 2,07 kg / dm 3. 95,39 ° C felett a kén (az úgynevezett monoklinikus kén) b-módosulása stabil. Szobahőmérsékleten a monoklin b-S egységsejt-paraméterei a \u003d 1,090, b \u003d 1,096, c \u003d 1,102 nm, t \u003d 83,27 ° C. Sűrűség b-S 1,96 kg / dm 3.
A kén a- és b-modifikációjának szerkezete nem sík, nyolctagú ciklikus S 8 molekulákat tartalmaz. Ezek a molekulák kicsit olyanok, mint a koronák.
Ez a két kénmódosítás különbözik az S 8 molekulák kölcsönös orientációjától a kristályrácsban.
Egy másik kénmódosítás - az úgynevezett rombohedrális kén - úgy érhető el, hogy a Na 2 S 2 O 3 nátrium-tioszulfát-oldatot 0 ° C-on tömény sósavba öntjük, majd a ként toluollal extraháljuk. (cm. TOLUOL)... Az oldószer elpárologtatása után rombohéder kristályok képződnek, amelyek szék alakú S 6 molekulákat tartalmaznak.
Az amorf ként (sűrűség 1,92 g / cm 3) és a gumiszerű műanyag ként olvadt kén éles hűtésével (az olvadék hideg vízbe öntésével) nyerjük. Ezek a módosítások szabálytalan cikk-cakk S n láncokból állnak. Hosszabb tárolással 20-95 ° C hőmérsékleten az összes kénmódosítás átalakul a-kénné.
A rombikus a-kén olvadáspontja 112,8 ° C, a monoklinikus b-kéné 119,3 ° C. Mindkét esetben könnyen mozgó sárga folyadék képződik, amely körülbelül 160 ° C hőmérsékleten sötétedik; viszkozitása növekszik, és 200 ° C feletti hőmérsékleten az olvadt kén sötétbarnává és viszkózussá válik, akár egy gyanta. Ezt azzal magyarázzák, hogy az S 8 gyűrűmolekulák először megolvadnak az olvadékban. A kapott fragmensek egymással egyesülve hosszú, több százezer atomú Sµ-láncokat képeznek. Az olvadt kén további melegítése (250 ° C felett) a láncok részleges szakadásához vezet, és a folyadék ismét mozgékonyabbá válik. Ábrán. a folyékony kén viszkozitásának hőmérsékletfüggése látható. Körülbelül 190 ° C-on a viszkozitása a 9000-szerese a 160 ° C-nak.
Az olvadt kén 444,6 ° C-on forr. A hőmérséklettől függően az S 8, S 6, S 4 és S 2 molekulák megtalálhatók gőzeiben. A molekulák összetételének változása a kéngőz színének változását okozza narancssárgáról szalmasárgára. 1500 ° C feletti hőmérsékleten az S 2 molekulák atomokká válnak.
Az S 2 molekulák paramágnesesek (cm. PARAMÁGNESES) és az O 2 molekulához hasonlóan vannak felépítve. Minden más állapotban a kén diamagneses (cm. DIAMAGNETIKUS).
A kén gyakorlatilag nem oldódik vízben. Modifikációinak egy része szerves folyadékokban (toluol, benzol) és különösen jól oldódik CS 2 szén-diszulfidban és NH 3 folyékony ammóniában.
A kén meglehetősen aktív nemfém. Mérsékelt melegítés mellett is sok egyszerű anyagot oxidál, de önmagában oxigén és halogének elég könnyen oxidálódnak.
S + O 2 \u003d SO 2, S + 3F 2 \u003d SF 6,
2S + Cl 2 \u003d S 2 Cl 2 (SCl 2-vel adva)
Hidrogénnel melegítve a kén hidrogén-szulfidot képez H 2 S és kis mennyiségben szulfánokat (H 2 S n összetételű vegyületek):
H 2 + S H 2 S
Példák a kén reakciójára a fémekkel:
2Na + S \u003d Na 2S, Ca + S \u003d CaS, Fe + S \u003d FeS
Az ezekben a reakciókban képződött szulfidokat nem állandó, hanem általában változó összetétel jellemzi. Tehát a kalcium-szulfid összetétele folyamatosan változhat a CaS és a CaS 5 közötti tartományban. A CaS n vagy Na 2 S n típusú poliszulfidok, ha például sósavval lépnek kölcsönhatásba, szulfánokat képeznek H 2 S n , és n értéke 1 és körülbelül 10 között lehet.
Hevítve a tömény kénsav SO 2 -vá oxidálja a ként:
S + 2H 2SO 4 \u003d 2H 2 O + 3SO 2.
A Tsarskaya vodka (salétromsav és sósav keveréke) ként kénsavvá oxidálja.
Hígított salétromsav, sósav oxidálószerek és kénsav nélkül a hideg nem lép kölcsönhatásba a kénnel. Forrásban lévő vízben vagy lúgos oldatokban melegítve a kén aránytalan:
3S + 6NaOH 2Na2S + Na2S03 + 3H20;
A kén hozzáadhatja a szulfidokat
Na 2S + (n - 1) S \u003d Na 2S n
és szulfitokra:
Na 2SO 3 + S \u003d Na 2 S 2 O 3
E reakció eredményeként a nátrium-tioszulfát Na2S2O3 képződik nátrium-szulfit Na2S03-ból.
Hevítve a kén szinte minden elemmel reagál, az inert gázok, a jód, a nitrogén, a platina és az arany kivételével.
Számos kénoxid ismert. A perzisztens kén-dioxid SO 2 mellett [más nevek: kén-dioxid, kénsav-anhidrid, kén-oxid (IV)] és kén-trioxid SO 3 [egyéb nevek: kén-gáz, kén-anhidrid, kén (VI) -oxid], instabil oxidokat (S H 2S és SOCl 2 kölcsönhatásában). Az SO 4 és S 2 O 7 peroxidok úgy képződnek, hogy az SO 2-t oxigénnel keverékben izzító kisülés útján vezetik át, vagy az SO 2 ózonnal oxidálják.
A savas kén-dioxid SO 2 egy közepes erősségű H 2 SO 3 (kénsav) instabil savnak felel meg:
H 2 O + SO 2 H 2 SO 3,
és savas kén-trioxid SO 3 - erős kétbázisú kénsav (cm. KÉNSAV) H 2 SO 4:
SO 3 + H 2 O \u003d H 2 SO 4
A kénsav H 2 SO 3 és a kénes H 2 SO 4 egyaránt két sósornak felel meg: savas [hidroszulfitok NaHSO 3, Ca (HSO 3) 2 stb. És hidroszulfátok KHSO 4, Na Na 2SO 3, K 2 SO 3 és szulfátok CaSO 4, Fe 2 (SO 4) 3].
A kén számos szerves vegyület része (lásd a tiofén cikkeket (cm. TIOFÉN), Thiola (cm. THIOLS) Egyéb).
Alkalmazás
Az előállított kén körülbelül felét kénsav előállítására fordítják, körülbelül 25% -át szulfitok előállítására, 10-15% -át a mezőgazdasági növények (elsősorban szőlő és gyapot) kártevőinek elleni védekezésre fordítják (itt a legfontosabb a réz-szulfát oldata 10% -át a gumiipar felhasználja a vulkanizáláshoz. A ként színezékek és pigmentek, robbanóanyagok (még mindig a puskapor része), mesterséges szálak, foszforok előállítására használják (cm. LUMINOFOROK)... A ként használják a gyufák gyártásához, mivel ez a kompozíció része, amelyből a gyufafejek készülnek. Néhány bőrbetegség kezelésére szolgáló kenőcs továbbra is ként tartalmaz. Az acélok különleges tulajdonságainak biztosítása érdekében kis mennyiségű ként adagolnak beléjük (bár az acélokban általában nem kívánatos a kén keveréke).
Biológiai szerep
A kén minden élő szervezetben folyamatosan jelen van, fontos biogén elem (cm. BIOGÉN ELEMEK)... A növényekben 0,3–1,2%, az állatokban 0,5–2% ( tengeri élőlények tartalmaz több kénmint földi). A kén biológiai jelentőségét elsősorban az határozza meg, hogy része a metionin aminosavaknak (cm. METIONIN) és cisztein (cm. CYSTEINE) és ezért a peptidek összetételében (cm. PEPTIDES) és fehérjék. A polipeptidláncok –S - S– diszulfidkötései részt vesznek a fehérjék térszerkezetének kialakulásában, a szulfhidrilcsoportok (–SH) fontos szerepet játszanak az enzimek aktív központjaiban. Ezenkívül a kén szerepel a hormonmolekulákban, fontos anyagok... Sok kén található a haj, a csontok és az idegszövet keratinjában. A szervetlen kénvegyületek elengedhetetlenek a növények ásványi táplálkozásához. Szubsztrátként szolgálnak a természetben előforduló kénbaktériumok által végzett oxidatív reakciókhoz (cm. SEROBACTERIA).
Egy átlagos ember teste (70 kg testtömeg) körülbelül 1402 g ként tartalmaz. A felnőttek napi kénigénye körülbelül 4.
Ami azonban negatív hatással van a környezet és az ember kénje (pontosabban vegyületei) az egyik első helyen áll. A kénszennyezés fő forrása a szén és más kéntartalmú tüzelőanyagok elégetése. Ugyanakkor az üzemanyagban található kén körülbelül 96% -a kén-dioxid SO 2 formájában kerül a légkörbe.
A légkörben a kén-dioxid fokozatosan kén-oxiddá (VI) oxidálódik. Mindkét oxid - a kén (IV) -oxid és a kén (VI) -oxid - kölcsönhatásba lép a vízgőzzel, savas oldatot képezve. Ezután ezek az oldatok savas eső formájában hullanak ki. A savas vizek a talajba kerülve gátolják a talajfauna és a növények fejlődését. Ennek eredményeként kedvezőtlen körülmények jönnek létre a növényzet fejlődéséhez, különösen az északi régiókban, ahol a kémiai szennyezés hozzáadódik a zord éghajlathoz. Ennek eredményeként az erdők elpusztulnak, a fűtakaró megszakad, a víztestek állapota romlik. A savas esők tönkreteszik a márványból és más anyagokból készült műemlékeket, ráadásul még a kőépületek és a fémtermékek rombolását is okozhatják. Ezért különféle intézkedéseket kell hozni annak megakadályozására, hogy az üzemanyagból kénvegyületek kerüljenek a légkörbe. Ennek érdekében az olajat és az olajtermékeket megtisztítják a kénvegyületekből, az üzemanyag elégetése során keletkező gázokat tisztítják.
A kén por formájában önmagában irritálja a nyálkahártyákat, a légzőszerveket és okozhat komoly betegség... A levegőben a kén maximális koncentrációja 0,07 mg / m 3.
Női az egyik egyszerű (bonyolult, nem lebontható) anyag, az olvadó és könnyen éghető vulkáni eredetű kövület; árucikként a neve: éghető kén. A puskaport sóderből és kénből, szénnel készítik. Kén vágása, botokkal öntve. | Kén, szürke ... Szótár Dahl
KÉN - KÉN, Kén, vegyszer elem VІ gr. Mendelejev rendszer, S szimbólum, 16. sorszám, a. ban ben. 32.07. Ősidők óta ismert. A természetben víz (neptunikus) és vulkanikus lerakódások formájában fordul elő. eredet. Található itt: ... Nagy orvosi enciklopédia
KÉN - chem. elem, szimbólum S (Latin kén), at. n. 16, at. m. 32,06. Számos allotróp módosítás van; közöttük monoklin módosulású kén (sűrűség 1960 kg / m3, tm \u003d 119 ° С) és rombikus kén (sűrűség 2070 kg / m3, ίπι \u003d 112,8 ... Nagy Politechnikai Enciklopédia
- (S-vel jelölve), a periódusos tábla VI. csoportjának kémiai eleme, nem fém, az ókor óta ismert. A természetben, mint a formában fordul elő egyedi elem, és szulfid-ásványi anyagok, például GALENIT és PIRIT, valamint szulfát-ásványok formájában, ... Tudományos és műszaki enciklopédikus szótár
Az ír kelták mitológiájában Sera Partalon apja (lásd 6. fejezet). Egyes források szerint Sera, nem pedig Partalon volt Dilgnaid férje. (
