Reťazec nekovovej kyslej kyslej soli s kyselinou. Genetický vzťah medzi hlavnými triedami anorganických látok
\u003e\u003e Chémia: Genetický vzťah medzi triedami látok
Genetické
sa nazýva spojenie medzi látkami rôznych tried založené na ich vzájomných premenách a odrážajúcich jednotu ich pôvodu, to znamená genézu látok.
Najskôr uvádzame naše informácie o klasifikácii látok vo forme diagramu.
Ak poznáme triedy jednoduchých látok, je možné zostaviť dve genetické série: genetickú sériu kovov a kovov.
Genetická séria kovov odráža vzťah látok rôznych tried, ktorých základom je rovnaký kov.
Rozlišovať dve odrody genetickej série kovov
1. Genetický rozsah kovov, ktorý zodpovedá zásadám ako hydroxid. Všeobecne môže byť takáto séria reprezentovaná nasledujúcim reťazcom transformácií:

2. Genetický rozsah kovov, ktorý zodpovedá nerozpustnej zásade. Táto séria je bohatšia na genetické väzby, pretože lepšie odráža myšlienku vzájomných transformácií (priamych a reverzných). Všeobecne môže byť takáto séria reprezentovaná nasledujúcim reťazcom transformácií:
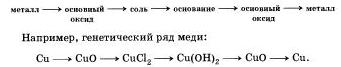
Genetická séria nekovov odráža vzťah látok rôznych tried, ktorý je založený na rovnakom nekove.
Dajú sa tu rozlíšiť aj dve odrody.
1. Genetická séria nekovov, ktorej rozpustná kyselina zodpovedá ako hydroxid, sa môže prejaviť vo forme takého reťazca transformácií:
nekovové -\u003e kyslé kysličné -\u003e kyslé -\u003e soľ
Napríklad genetická línia fosforu:
2. Genetický rozsah nekovov, ktorý zodpovedá nerozpustnej kyseline, je možné znázorniť pomocou nasledujúceho reťazca transformácií:
nekovový - kyslé kysličník - soľ - kyslé - kyslé kysličné - nekovové
Z kyselín, ktoré sme študovali, je nerozpustná iba kyselina kremičitá. Ako príklad poslednej genetickej série zvážte genetickú sériu kremíka:
1. Genetický vzťah.
2. Genetická škála kovov a ich odrody.
3. Genetická škála nekovov a ich odrôd.
Zapíšte si reakčné rovnice, pomocou ktorých môžete vykonávať transformácie, ktoré sú základom danej genetickej série kovov a nekovov. Uveďte názvy látok, napíšte rovnice reakcií za účasti elektrolytov tiež v iónovej forme.
Zapíšte si reakčné rovnice, pomocou ktorých môžete vykonať nasledujúce transformácie (koľko šípok, toľko reakčných rovníc):
a) Li - Li2O - LiOH - LiNO3
b) S - SO2 - H2SO3 - Na2SO3 - SO2 - CaSO3
Zapíšte si aj rovnice reakcií zahŕňajúcich elektrolyty v iónovej forme.
Ktoré z nasledujúcich látok budú interagovať s kyselinou chlorovodíkovou: horčík, oxid meďnatý, hydroxid meďnatý, meď, dusičnan horečnatý, hydroxid železitý, oxid kremičitý, dusičnan strieborný, sulfid železitý ? Zapíšte rovnice možných reakcií v molekulárnej a iónovej forme.
Ak sa reakcie nedajú uskutočniť, vysvetlite prečo.
Ktoré z nasledujúcich látok interagujú s hydrokodedom sodným: oxid uhoľnatý (IV). hydroxid vápenatý, oxid meďnatý, dusičnan meďnatý, chlorid amónny, kyselina kremičitá, síran draselný? Zapíšte rovnice možných reakcií v molekulárnej a iónovej forme. Ak reakcie nepokračujú, vysvetlite prečo.
Uveďte definície pre všetky triedy látok uvedené v tabuľke. Na aké skupiny sa delí každá trieda látok?
Medzi triedami anorganických zlúčenín existuje genetický vzťah. Komplexné látky je možné získať z jednoduchých látok a naopak. Zlúčeniny jednej triedy sa môžu použiť na získanie zlúčenín inej triedy.
Zjednodušene možno genetický vzťah medzi triedami anorganických zlúčenín znázorniť nasledujúcim diagramom:
Poradie takýchto transformácií pre nekovy je možné znázorniť pomocou nasledujúcej schémy: CaHPO4
P → P205 → H3P04 → Ca3 (PO4) 2
(CaOH) 3P04
Pre typické kovy je možné vykonať nasledujúci reťazec transformácií:
Ba → BaO → Ba (OH) 2 → BaSO4
Pre kovy, oxidy a hydroxidy, ktoré sú amfotérne (polokovy), je možné vykonať nasledujúce transformácie:
Al → Al 2 O 3 → Al (OH) 3 → Na → AlCl 3 → AlOHCl 2 → → Al (OH) 3 → Al 2 O 3.
Vzťahy medzi triedami:
1. Kovy, nekovy→ soľ.
Pri priamej interakcii kovov a nekovov sa tvoria soli anoxických kyselín (halogenidy, sulfidy):
2Na + C12 \u003d 2NaCl
Tieto zlúčeniny sú stabilné a pri zahrievaní sa zvyčajne nerozkladajú.
2. Zásadité oxidy, kyslé oxidy→ soľ.
CaO + C02 \u003d CaC03;
Na20 + S03 \u003d Na2S04.
3. Zásady, kyseliny→ soľ.
Vykonáva sa neutralizačnou reakciou:
2NaOH + H2S04 \u003d Na2S04 + 2H20,
OH - + H + → H20;
Mg (OH) 2 + 2HC1 \u003d MgCl2 + 2H20,
Mg (OH) 2 + 2H + → Mg 2+ + 2H20.
4. Kovy→ zásadité oxidy.
Väčšina kovov interaguje s kyslíkom za vzniku oxidov:
2Ca + 02 \u003d 2CaO;
4A1 + 3O2 \u003d 2A1 2O3.
Zlato, striebro, platina a iné ušľachtilé kovy neinteragujú s kyslíkom, oxidy týchto kovov sa získavajú nepriamo.
5. Nekovy→ oxidy kys.
Nekovy (s výnimkou halogénov a vzácnych plynov) interagujú s kyslíkom za vzniku oxidov:
4P + 5O2 \u003d 2P205;
S + 02 \u003d S02.
6. Základné oxidy→ dôvody.
Iba hydroxidy alkalických kovov a kovov alkalických zemín (zásady) je možné získať priamou interakciou s vodou:
Na20 + H20 \u003d 2NaOH;
CaO + H20 \u003d Ca (OH) 2.
Zvyšok báz sa získa nepriamo.
7. Kyslé oxidy→ kyselina.
Oxidy kyselín interagujú s vodou za vzniku zodpovedajúcich kyselín:
S03 + H20 \u003d H2S04;
P205 + 3H20 \u003d 2H3P04.
Výnimkou je SiO 2, ktorý nereaguje s vodou.
8. Zásady, kyslé oxidy→ soľ.
Zásady interagujú s kyslými oxidmi za vzniku solí:
2NaOH + SO3 \u003d Na2S04 + H20,
2OH - + S03 \u003d S04-2 - + H20;
Ca (OH) 2 + C02 \u003d CaCO3 ↓ + H20,
Ca 2+ + 2OH - + CO 2 → CaCO 3 ↓ + H 2 O.
9. Kyseliny, zásadité oxidy→ soľ.
Oxidy kovov sa rozpúšťajú v kyselinách a tvoria soli:
CuO + H2S04 \u003d CuSO4 + H20,
CuO + 2H + \u003d Cu2+ + H20;
Na20 + 2HC1 \u003d 2NaCl + H20,
Na20 + 2H + \u003d 2Na + + H20.
10. Nadácie→ zásadité oxidy.
Nerozpustné zásady a LiOH sa rozkladajú pri zahrievaní:
2LiOH \u003d Li20 + H20;
Cu (OH) 2 \u003d CuO + H20.
11. Kyseliny→ oxidy kys.
Nestabilné kyseliny obsahujúce kyslík sa rozkladajú pri zahrievaní (H 2 SiO 3) a dokonca aj bez zahrievania (H 2 CO 3, HC 10). Zároveň je množstvo kyselín odolných voči zahrievaniu (H 2 SO 4, H 3 PO 4).
H2S03 \u003d H20 + Si02;
H2C03 \u003d H20 + C02.
12. Oxidy kovov→ kovy.
Niektoré oxidy ťažkých kovov sa môžu rozkladať na kov a kyslík:
2HgO \u003d 2Hg + 02.
Kovy sa tiež získavajú zo zodpovedajúcich oxidov pomocou redukčných činidiel:
3Mn02 + 4Al \u003d 3Mn + 2Al203;
Fe 2 O 3 + 3H 2 \u003d 2Fe + 3H 2 O.
13. Oxidy kyselín→ nekovy.
Väčšina oxidov nekovov sa pri zahrievaní nerozkladá. Iba niektoré nestabilné oxidy (oxidy halogénov) sa rozkladajú na nekovy a kyslík.
Niektoré nekovy sa získavajú redukciou zo zodpovedajúcich oxidov:
Si02 + 2Mg \u003d 2MgO + Si.
14. Soli, zásady → zásady.
Nerozpustné zásady sa získavajú pôsobením zásad na roztokoch zodpovedajúcich kyselín:
CuSO4 + 2NaOH \u003d Cu (OH) 2 ↓ + Na2S04,
Cu 2+ + 2OH - → Cu (OH) 2 ↓;
FeCl2 + 2KOH \u003d Fe (OH) 2 ↓ + 2KCl,
Fe 2+ + 2OH - \u003d Fe (OH) 2 ↓.
15. Soli, kyseliny → kyseliny.
Rozpustné soli interagujú s kyselinami (v súlade s vytesňovacou sériou), ak je výsledkom slabšia alebo prchavá kyselina:
Na2SiO3 + 2HCl \u003d 2NaCl + H2SiO3 ↓,
SiO3 2 - + 2H + → H2 SiO3 ↓;
NaCl (tuhá látka) + H2S04 (c) \u003d NaHS04 + HCI.
16. Soli→ zásadité oxidy, kyslé oxidy.
Soli niektorých kyselín obsahujúcich kyslík (dusičnany, uhličitany) sa pri zahrievaní rozkladajú:
CaC03 \u003d CaO + C02;
2Cu (N03) 2 \u003d 2CuO + 4NO2 + 02.
CVIČENIA PRE NEZÁVISLÉ PRÁCE NA TÉME „GENETICKÝ VZŤAH MEDZI TRIEDAMI ANORGANICKÝCH ZLÚČENÍN“
1. Pomenujte látky uvedené nižšie a rozdeľte ich podľa tried anorganických zlúčenín: Na 3 PO 4, H 2 SiO 3, NO, B 2 O 3, MgS, BaI 2, Ca (OH) 2, KNO 3, HNO 2, Cl 2 O7, Fe (OH) 2, P205, HF, Mn02.
2. Z ktorých z nasledujúcich látok sa dá v jednom stupni získať hydroxid (kyselina alebo zásada): meď, oxid železitý (P), oxid bárnatý, oxid dusnatý (P), oxid dusičitý (V), oxid kremičitý, síran meďnatý, chlorid draselný , draslík, uhličitan horečnatý.
3. Z vyššie uvedeného zoznamu zapíšte vzorce látok týkajúce sa: 1) oxidov; 2) dôvody; 3) kyseliny; 4) soli:
C02, NaOH, HCl, S03, CuS04, NaN03, KCI, H2S04, Ca (OH) 2, P205, HNO3, Al (OH) 3.
4. Pomenujte látky: Zn (OH) 2, MgO, P203, NaHCO3, H3P03, Fe2 (SO4) 3, KOH, (AlOH) 3 (P04) 2, Ba (MnO 4 ) 2, CO, HI. Uveďte, do ktorej triedy každá látka patrí.
5. Napíšte molekulárne vzorce nasledujúcich látok a uveďte, do ktorej triedy jednotlivé látky patria:
1) hydrogénuhličitan meďnatý;
2) oxid dusnatý (V);
3) hydroxid nikelnatý;
4) hydrogénfosforečnan bárnatý;
5) kyselina chloristá;
6) hydroxid chromitý;
7) chlorečnan draselný;
8) kyselina sírovodíková;
9) ziničnan sodný.
6. Uveďte príklady reakcií na spojenie medzi:
1) jednoduché nekovové látky;
2) jednoduchá látka a oxid;
3) oxidy;
4) komplexné látky, ktoré nie sú oxidmi;
5) kovové a nekovové;
6) tri látky.
7. S ktorými z nasledujúcich látok môžu reagovať:
1) oxid uhoľnatý (IV): HCl, 02, N02, KOH, H20;
2) oxid horečnatý: Ba (OH) 2, HCl, C02, 02, HNO3;
3) hydroxid železitý: KCl, HC1, KOH, 02, H20, HNO3;
4) chlorovodík: Zn, MgO, ZnCI2, HN03, Ca (OH) 2, Cu, (ZnOH) Cl.
8. Je možná interakcia medzi týmito látkami:
1) oxid uhoľnatý (IV) a hydroxid draselný;
2) hydrogénsíran draselný a hydroxid vápenatý;
3) fosforečnan vápenatý a kyselina sírová;
4) hydroxid vápenatý a oxid sírový;
5) kyselina sírová a hydroxid draselný;
6) hydrogenuhličitan vápenatý a kyselina fosforečná;
7) oxid kremičitý a kyselina sírová;
8) oxid zinočnatý a oxid fosforečný (V).
Napíšte rovnice možných reakcií, uveďte podmienky, v ktorých sa vyskytujú. Ak môžu reakcie viesť k rôznym látkam, potom uveďte rozdiel v podmienkach ich uskutočnenia.
9. Zadajte reakčné rovnice na získanie nasledujúcich látok: ortofosforečnan sodný (4 spôsoby), síran draselný (7 spôsobov), hydroxid zinočnatý.
10. Jedným zo spôsobov, ako získať sódu (uhličitan sodný), je pôsobenie vody a oxidu uhoľnatého (IV) na hlinitan sodný. Napíšte reakčné rovnice.
11. Bez zmeny koeficientov napíšte reakčné produkty:
1) MgO + 2H2S04 →
2) 2SO2 + Ba (OH) 2 →
3) 3N205 + 2Al (OH) 3 →
4) 2205 + 4NaOH →
5) P205 + 6NaOH →
6) P205 + 2NaOH →
12. Vytvorte rovnice reakcií na získanie rôznych druhov solí:
1) SO 2 + Ba (OH) 2 → (stredné a kyslé soli),
2) A1 2 O 3 + H 2 O + HNO 3 → (stredná soľ, zásadité soli),
3) Na20 + H2S → (stredné a kyslé soli),
4) SO3 + Ca (OH) 2 → (stredné a zásadité soli),
5) CaO + H20 + P205 → (zásaditá soľ, kyslé soli).
13. Vyplňte reakčné rovnice:
CaO + Al203 → CaHP04 + Ca (OH) 2 →
Cr203 + H2S04 → AlOHS04 + NaOH →
Cr203 + NaOH → CaCO3 + C02 + H20 →
A1203 + HCI04 → Ca (HCO3) 2 + HCl →
Mn207 + KOH → ZnS + H2S →
N02 + Ca (OH) 2 → CaS04 + H2S04 →
Zn (OH) 2 + NaOH → (ZnOH) Cl + HCl →
Zn (OH) 2 + HNO3 → Bi (OH) 3 + H2S04 (nedostatočné) →
AlCl3 + NaOH (krátky) → (FeOH) Cl + NaHS →
AlCl3 + NaOH → Na2ZnO2 + H2S04 (prebytok) →
AlC1 3 + NaOH (prebytok) → Ca (AlO2) 2 + HCl (prebytok) →
14. Zapíšte si reakčné rovnice, pomocou ktorých môžete vykonať nasledujúce transformácie:
1) Сu → СuО → CuSO 4 → Сu (ОН) 2 → СuС1 2 → Cu (NO 3) 2
2) Zn → ZnO → ZnSO4 → Zn (OH) 2 → Na2 ZnO2 → ZnCl2
3) P → P 2 O 5 → H 3 PO 4 → K 3 PO 4 → Ca 3 (PO 4) 2 → H 3 PO 4
4) Mg → MgO → MgCl2 → Mg (OH) 2 → Mg (HSO4) 2 → MgS04
5) Ca → CaO → Ca (OH) 2 → CaCO3 → Ca (HCO3) 2 → C02
6) Cr → Cr 2 (SO 4) 3 → Cr (OH) 3 → NaСrO 2 → Cr 2 O 3 → K
7) P → P205 → HPO3 → H3P04 → NaH2P04 → Na3P04
8) CuS → CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
9) Al → Al 2 O 3 → Al 2 (SO 4) 3 → Al (HSO 4) 3 → Al (OH) 3 → K
10) S → SO 2 → SO 3 → NaHSO 4 → Na 2 SO 4 → BaSO 4
11) Zn → ZnO → ZnCl2 → Zn → Na2
12) Zn → ZnSO4 → ZnCl2 → Zn (OH) 2 → Na2 → Zn (NO 3) 2
13) Ca → CaCl2 → CaCO3 → Ca (HCO3) 2 → Ca (N03) 2
14) Ca → Ca (OH) 2 → CaCO3 → CaCl2 → CaCO3 → Ca (NO3) 2
15) CuO → CuCl2 → Cu (NO3) 2 → CuO → CuSO4 → Cu
16) CaO → Ca (OH) 2 → Ca (NO 3) 2 → Ca (NO 2) 2 → HNO 2 → NaNO 2
17) MgO → MgS04 → MgCl2 → Mg (N03) 2 → Mg (OH) 2 → MgO
18) SO 2 → H 2 SO 3 → KHSO 3 → K 2 SO 3 → KHSO 3 → SO 2
19) P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2 → CaHPO 4
20) CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl 2 → Ca (NO 3) 2 → CaSO 4
21) PbO → Pb (NO3) 2 → PbO → Na2 PbO2 → Pb (OH) 2 → PbCl2
22) ZnO → ZnSO4 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2 → K2
23) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → Al (OH) 3 → K
24) ZnSO4 → Zn (OH) 2 → ZnCl2 → Zn → ZnO → Zn (NO 3) 2
25) AlCl3 → Al (NO 3) 3 → Al (OH) 3 → NaAlO 2 → A1C1 3 → Al
26) Pb (NO 3) 2 → Pb (OH) 2 → PbO → Na2 PbO2 → Pb (OH) 2 → PbSO 4
27) Fe 2 (SO 4) 3 → FeCl 3 → Fe (OH) 3 → FeOH (NO 3) 2 → Fe (NO 3) 3 → Fe 2 O 3
28) K → KOH → KHSO4 → K2S04 → KCl → KNO3
29) Cu (OH) 2 → CuOHNO 3 → Cu (NO 3) 2 → CuSO 4 → CuCl 2 → Cu (NO 3) 2
30) CaCl2 → Ca → Ca (OH) 2 → CaCl2 → Ca (NO3) 2 → CaSO4
31) Сu → Cu (NO 3) 2 → Cu (OH) 2 → CuSO 4 → Al 2 (SO 4) 3 → A1C1 3
32) Mg → MgS04 → MgCl2 → MgOHCl → Mg (OH) 2 → MgOHNO3
33) CuSO4 → CuCl2 → ZnCl2 → Zn (OH) 2 → Na2 ZnO2 → Zn (OH) 2
34) Hg (NO 3) 2 → Al (NO 3) 3 → Al 2 O 3 → NaAlO 2 → Al (OH) 3 → AlOHCl 2
35) ZnSO4 → Zn (OH) 2 → ZnCl2 → AlCl3 → Al (OH) 3 → A1 2 O 3
36) CuCl2 → Cu (OH) 2 → CuSO4 → ZnSO4 → Zn (OH) 2 → Na2 ZnO2
37) Fe (NO 3) 3 → FeOH (NO 3) 2 → Fe (OH) 3 → FeCl3 → Fe (NO 3) 3 → Fe
38) Al 2 O 3 → AlCl 3 → Al (OH) 3 → NaAlO 2 → NaNO 3 → HNO 3
39) Mg (OH) 2 → MgS04 → MgCl2 → Mg (NO3) 2 → Mg (OH) 2 → MgO
40) síran hlinitý → chlorid hlinitý → dusičnan hlinitý → oxid hlinitý → hlinitan draselný → hydroxid hlinitý → chlorid hlinitý → chlorid hlinitý.
41) Na → NaOH → Na3P04 → NaNO3 → HNO3 → N205
42) BaCO 3 → Ba (HCO 3) 2 → BaCO 3 → (BaOH) 2 CO 3 → BaO → BaSO 4
43) Cu → CuSO 4 → (CuOH) 2 SO 4 → Cu (OH) 2 → Cu (HSO 4) 2 → CuSO 4
44) bárium → hydroxid bárnatý → hydrogenuhličitan bárnatý → chlorid bárnatý → uhličitan bárnatý → chlorid bárnatý → hydroxid bárnatý
45) P → P 2 O 5 → H 3 PO 4 → Ca (H 2 PO 4) 2 → CaHPO 4 → Ca 3 (PO 4) 2
46) Cr → CrO → Cr203 → NaCrO2 → CrCl3 → Cr (OH) 3 → Cr203 → Cr
47) Cr203 → CrCl3 → Cr (OH) 3 → Na3 → Cr2 (SO4) 3 → CrCl3
48) K → KOH → KCl → KOH → K2S04 → KNO3 → KNO2
49) S → FeS → H 2 S → SO 2 → S → ZnS → ZnO → ZnCl2 → Zn (OH) 2 → K 2
50) C → CO 2 → CO → CO 2 → Ca (HCO 3) 2 → CaCO 3 → CaCl2
51) С → СО 2 → NaHCO 3 → Na 2 CO 3 → СО 2
52) S → SO 2 → K 2 SO 3 → KHSO 3 → K 2 SO 3
53) Cu → Cu (OH) 2 → Cu (NO3) 2 → CuO → Cu
54) P 2 O 5 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2 → Ca 3 (PO 4) 2
55) Fe → FeCl2 → Fe (OH) 2 → FeSO4 → Fe
56) Zn → ZnO → Zn (OH) 2 → Zn (N03) 2 → ZnO
57) CuS → SO2 → KHSO3 → CaSO3 → SO2
58) SO2 → H2S04 → CuSO4 → CuO → Cu (NO3) 2
59) KHSO3 → CaSO3 → Ca (HSO3) 2 → SO2 → K2S04
60) SO2 → CaSO3 → SO2 → NaHSO3 → SO2
61) NaHC03 → Na2C03 → NaCl → NaHSO4 → Na2S04
62) К → KOH → KCl → KNO3 → K2S04 → KCl
63) NaCl → Na → NaOH → Na2S04 → NaCl
64) Al → AlCl3 → Al (OH) 3 → A1203 → Al (OH) 3
65) CuO → Cu → CuCl2 → CuSO4 → CuS
66) Fe → FeSO4 → Fe (OH) 2 → Fe → Fe (OH) 3
67) Fe → Fe (OH) 2 → FeCl2 → Fe (NO 3) 2 → Fe
68) Fe (NO3) 3 → Fe203 → FeCl3 → Fe (NO3) 3 → Fe
69) CuO → CuSO4 → Cu (OH) 2 → CuO → Cu
70) MgCO3 → MgO → MgCl2 → Mg (OH) 2 → Mg (N03) 2
71) Mg → Mg (OH) 2 → MgS04 → MgCO3 → Mg (HCO3) 2
72) CaO → Ca (OH) 2 → CaCl2 → CaCO3 → CO2
73) CaCO3 → Ca (HCO3) 2 → CaCl2 → Ca (NO3) 2 → 02
74) FeS → Fe203 → Fe (OH) 3 → Fe2 (SO4) 3 → FeCl3
75) KC1 → K2S04 → KOH → K2C03 → KOH
76) CuS → CuO → Cu (OH) 2 → CuSO4 → Cu
77) Fe → Fe (OH) 3 → Fe (NO3) 3 → FeCl3 → Fe2 (SO4) 3
78) CuSO4 → CuO → Cu (NO3) 2 → CuO → CuS
79) ZnS → H2S → SO2 → Na2S04 → NaOH
80) Al → Al (OH) 3 → A1 2 (SO 4) 3 → A1 2 O 3 → Al (OH) 3
81) CaCl2 → CaCO3 → Ca (HCO3) 2 → CaCO3 → CaSiO3
82) S → ZnS → H2S → Ca (HSO3) 2 → SO2
83) Na2S04 → NaCl → HCl → CaCl2 → Ca (N03) 2
84) Na2S03 → SO2 → H2S04 → HCl → FeCl2
85) С → Na2C03 → CaCO3 → CaSiO3 → H2SiO3
86) P → P205 → Ca (H2P04) 2 → CaHPO4 → H3P04
87) Al → A1203 → Al (OH) 3 → A1C1 3 → A1 (NO3) 3
88) HCl → CuCl2 → Cl2 → HCl → H2
89) P 2 O 5 → Na 2 HPO 4 → Na 3 PO 4 → Ca 3 (PO 4) 2 → CaSO 4
90) NH3 → NH4C1 → NH3∙H20 → NH4HCO3 → NH3
91) NH4C1 → KC1 → HCl → CuCl2 → Cu (OH) 2
92) NH3 → NH4H2P04 → (NH4) 2 HP04 → NH3 → NH4NO3
93) KOH → KHCO3 → K2C03 → CO2 → Ca (HCO3) 2
94) Na → NaOH → NaHC03 → Na2S04 → NaOH
95) KNO3 → K2S04 → KC1 → KNO3 → KNO2
96) Cl2 → KC1 → K2S04 → KNO3 → KHSO4
97) FeSO4 → FeS → SO2 → KHSO3 → K2S04
98) KOH → Cu (OH) 2 → CuSO4 → Cu (OH) 2 → Cu
99) Fe203 → FeCl3 → Fe (OH) 3 → Fe (NO3) 3 → Fe203
100) Al → A1203 → A1 (NO3) 3 → A1203 → Al (OH) 3
101) CaO → CaCO3 → CaSiO3 → Ca (NO3) 2 → 02
102) Cu → Cu (OH) 2 → Cu → CuSO4 → CuCl2
103) H2S → SO2 → ZnSO4 → ZnS → ZnO
104) Cl2 → NaCl → HCl → CuCl2 → CuO
105) Cl2 → FeCl3 → Fe203 → Fe (OH) 3 → Fe (N03) 3
106) P 2 O 5 → Ca 3 (PO 4) 2 → H 3 PO 4 → CaHPO 4 → Ca (H 2 PO 4) 2
107) ZnS → ZnO → Zn → ZnCl2 → Zn (N03) 2
108) ZnO → ZnSO4 → Zn (NO 3) 2 → ZnO → Zn (OH) 2
109) H3P04 → NH4H2P04 → (NH4) 2 HPO4 → Na3P04 → Ca3 (PO4) 2
110) CaCO3 → Na2CO3 → Na3P04 → NaH2P04 → Ca3 (PO4) 2
111) CaCl2 → CaS03 → Ca (OH) 2 → CaCl2 → Ca (N03) 2
112) NaOH → Na2C03 → NaHSO4 → NaNO3 → NaHSO4
113) Na2Si03 → Na2C03 → Na2S04 → NaCl → Na2S04
114) KNO3 → KHSO4 → K2S04 → KCl → Na2S04
115) SiO2 → K2SiO3 → H2SiO3 → SiO2 → CaSiO3
116) Cu → CuCl2 → Cu (NO3) 2 → NO2 → HNO3
117) Ca (NO 3) 2 → O 2 → SiO 2 → H 2 SiO 3 → SiO 2
118) P → H3P04 → Ca3 (PO4) 2 → CaHPO4 → Ca (H2P04) 2
119) CuSO4 → Cu → CuS → CuO → CuCl2
120) Al → A1 2 (SO 4) 3 → Al (OH) 3 → A1C1 3 → A1 (NO 3) 3
121) S → SO3 → H2S04 → KHSO4 → BaSO4
122) N205 → HNO3 → Cu (NO3) 2 → CuO → Cu (OH) 2
123) Al → A1 2 O 3 → Al (OH) 3 → A1 2 (SO 4) 3 → A1 (NO 3) 3
124) Ca → Ca (OH) 2 → Ca (HCO3) 2 → CaO → CaCl2
125) NH3 ∙ H20 → NH4 C1 → NH3 → NH4HCO3 → (NH4) 2CO3
126) Cu (OH) 2 → H20 → HNO3 → Fe (NO3) 3 → Fe
127) SO2 → Ca (HSO 3) 2 → CaCl2 → Ca (OH) 2 → Ca (HCO 3) 2
128) NH 3 ∙ H 2 O → NH 4 HCO 3 → CaCO 3 → CaSiO 3 → CaCl 2
129) CuSO4 → Cu → CuO → Cu (OH) 2 → Cu
130) Fe (OH) 3 → Fe → FeCl3 → Fe (NO3) 3 → Fe
131) Zn → Zn (OH) 2 → Na2 → Zn (OH) 2 → Na2 ZnO2 → Zn
132) Zn → ZnO → Na2 ZnO2 → Zn (OH) 2 → Na2 → ZnCl2
133) Zn → K 2 ZnO 2 → ZnSO 4 → K 2 → Zn (NO 3) 2 → ZnO
134) ZnO → Zn (OH) 2 → K2 ZnO2 → ZnSO4 → ZnCl2 → ZnO
135) Zn → Na 2 → Na 2 ZnO 2 → Zn (NO 3) 2 → ZnO → Zn
136) Al → K3 → Al (OH) 3 → Na3 → A1C1 3 → Al (OH) 3
137) Al 2 O 3 → KAlO 2 → Al (OH) 3 → Al 2 O 3 → Na 3 → Al 2 O 3
138) Al (OH) 3 → A1 2 O 3 → K 3 → Al 2 (SO 4) 3 → A1 (NO 3) 3
139) A1C1 3 → K 3 → Al (NO 3) 3 → NaAlO 2 → Al 2 O 3
140) Be → Na2 → Be (OH) 2 → Na2BeO2 → BaBeO2
EXPERIMENTÁLNE EXPERIMENTY NA TÉMU „ZÁKLADNÉ TRIEDY ANORGANICKÝCH ZLÚČENÍN“
SKÚSENOSTI 1.Neutralizačné reakcie.
a) Interakcia silnej kyseliny a silnej zásady.
Nalejte 5 ml 2N roztoku kyseliny chlorovodíkovej do porcelánového pohára a po kvapkách k nemu pridajte 2N roztok hydroxidu sodného. Roztok premiešajte sklenenou tyčinkou a vyskúšajte jeho účinok na lakmusový papier prevedením kvapky roztoku na lakmusový papierik. Je potrebné dosiahnuť neutrálnu reakciu (modrý a červený lakmusový test nemení farbu). Výsledný roztok sa odparí do sucha. Čo sa formovalo? Napíšte molekulové a iónové reakčné rovnice.
b) Interakcia slabej kyseliny a silnej bázy.
Nalejte 2 ml 2 N alkalického roztoku do skúmavky a pridávajte roztok kyseliny octovej, kým nie je neutrálny. Napíšte molekulové a iónové reakčné rovnice. Vysvetlite, prečo sa rovnováha iónovej reakcie, na ktorej sa podieľa slabý elektrolyt (kyselina octová), posúva smerom k tvorbe molekúl vody.
SKÚSENOSTI 2. Amfotericita hydroxidov.
Z činidiel dostupných v laboratóriu pripravte zrazeninu hydroxidu zinočnatého. Výslednou zrazeninou pretrepte a nalejte malé množstvo do 2 skúmaviek. Do jednej zo skúmaviek sa pridá roztok kyseliny chlorovodíkovej a do druhej roztok hydroxidu sodného (prebytok). Čo sa pozoruje? Napíšte rovnice zodpovedajúcich reakcií v molekulárnej a iónovej forme.
SKÚSENOSTI 3.Chemické vlastnosti solí.
a) Interakcia soľných roztokov s tvorbou ťažko rozpustnej látky.
Nalejte 2 ml roztoku uhličitanu sodného do skúmavky a pridajte roztok chloridu bárnatého, kým sa nevytvorí biela zrazenina. Napíšte rovnicu chemickej reakcie v iónovej a molekulárnej forme. Výsledný sediment rozdeľte na dve časti. Nalejte roztok kyseliny sírovej do jednej zo skúmaviek a hydroxid sodný do druhej. Urobte záver o rozpustnosti zrazeniny v kyselinách a zásadách.
b) Interakcia soľného roztoku s kyselinami za vzniku prchavej zlúčeniny.
Nalejte 2 ml roztoku uhličitanu sodného do skúmavky a pridajte malý objem roztoku kyseliny chlorovodíkovej. Čo sa pozoruje? Napíšte rovnice chemickej reakcie v iónovej a molekulárnej forme.
c) Interakcia soľných roztokov s alkáliami s tvorbou prchavej zlúčeniny.
Nalejte trochu roztoku trochu amónnej soli do skúmavky, pridajte 1 - 2 ml roztoku hydroxidu sodného a zohrejte na teplotu varu. Do skúmavky s reakčnou zmesou pridajte mokrý červený lakmusový papier. Čo sa pozoruje? Vysvetlite. Napíšte reakčné rovnice.
r ) Interakcia soľných roztokov s aktívnejšími kovmi ako s kovom, ktorý je súčasťou soli.
Železný (oceľový) klinec očistite jemným brúsnym papierom. Potom ho ponorte do roztoku síranu meďnatého. Po chvíli sledujte uvoľňovanie medi na povrchu nechtu. Napíšte zodpovedajúcu reakčnú rovnicu v iónovej a molekulárnej forme.
SKÚSENOSTI 4.Získavanie zásaditých a kyslých solí.
a) Získanie hydroxokarbonátu olova.
K roztoku octanu olovnatého (II) sa pridá trochu oxidu olovičitého a zmes sa varí niekoľko minút. Vypustite ochladený roztok zo sedimentu a prelejte cez neho prúd oxidu uhličitého. Čo sa pozoruje? Zrazenina sa filtruje a suší sa medzi kúskami filtračného papiera. Všimnite si farbu a povahu výslednej zrazeniny hydrogénuhličitanu olovnatého. Napíšte reakčné rovnice. Vytvorte grafický vzorec pre získanú soľ.
b) Získanie hydrogénuhličitanu horečnatého.
Pridajte trochu roztoku uhličitanu sodného do veľmi zriedeného roztoku trochu horečnatej soli. Aká látka sa vyzráža? Roztok bol nasýtený sedimentom oxidom uhličitým. Pozorujte postupné rozpúšťanie zrazeniny. Prečo sa to deje? Napíšte reakčné rovnice.
SKÚSENOSTI 5.Získavanie komplexných solí.
a) Tvorba zlúčenín s komplexným katiónom.
Roztok amoniaku sa po kvapkách pridáva do skúmavky s 2 - 3 ml roztoku chloridu meďnatého, kým sa nevytvorí zrazenina hydroxidu meďnatého, a potom sa pridá prebytok roztoku amoniaku, kým sa zrazenina nerozpustí. Porovnajte farbu iónov Cu 2+ s farbou výsledného roztoku. Aké ióny sú zodpovedné za farbu roztoku? Napíšte reakčnú rovnicu na získanie komplexnej zlúčeniny.
b) Tvorba zlúčenín s komplexným aniónom.
K 1 - 2 ml roztoku dusičnanu ortutnatého sa po kvapkách pridáva zriedený roztok jodidu draselného, \u200b\u200bkým sa nevytvorí zrazenina Hgl2. Potom pridajte prebytok roztoku jodidu draselného, \u200b\u200bkým sa zrazenina nerozpustí. Napíšte reakčné rovnice na získanie komplexnej soli.
SKÚSENOSTI 6.Získanie dvojitých solí (kamenca draselného).
Odvážte 7,5 g Al 2 (SO 4) 3 x 18 H 2 O a rozpustite v 50 ml vody s použitím dostatočne veľkého porcelánového pohára na tento účel. Vypočítajte podľa reakčnej rovnice a odvážte hmotnosť síranu draselného potrebného na reakciu. Pripravte horúci nasýtený roztok síranu draselného a za stáleho miešania ho vylejte do porcelánovej misky obsahujúcej roztok síranu hlinitého. Po chvíli pozorujte zrážanie kryštálov kamenca draselného. Po ochladení a na konci kryštalizácie matečný lúh odčerpajte, kryštály kamenca vysušte medzi listami filtračného papiera a získané kryštály odvážte. Vypočítajte percento výnosu.
VÝPOČTOVÉ PROBLÉMY
1. Pri prechode nadbytku sírovodíka cez 16 g roztoku síranu meďnatého sa získalo 1,92 g zrazeniny. Nájdite hmotnostný zlomok síranu meďnatého v použitom roztoku a objem spotrebovaného sírovodíka.
2. Na úplné vyzrážanie medi vo forme sulfidu z 291 cm3 roztoku síranu meďnatého s hmotnostným podielom 10% sa použil plyn získaný interakciou 17,6 g sulfidu železitého s nadbytkom kyseliny chlorovodíkovej. Zistite hustotu pôvodného roztoku síranu meďnatého.
3. Plyn uvoľnený počas interakcie roztoku K2S so zriedenou kyselinou sírovou prechádza cez prebytok roztoku dusičnanu olovnatého. Výsledný sediment má hmotnosť 71,7 g. Zistite objem zreagovaného roztoku kyseliny sírovej, ak je jeho hustota 1,176 g / cm3 a hmotnostný podiel je 25%.
4. K roztoku obsahujúcemu 8 g síranu meďnatého sa pridal roztok obsahujúci 4,68 g sulfidu sodného. Zrazenina sa odfiltruje a filtrát sa odparí. Stanovte hmotnosť látok vo filtráte po odparení a hmotnosť zrazeniny sulfidu meďnatého.
5. Časť sulfidu železnatého sa spracuje prebytkom kyseliny chlorovodíkovej. Výsledný plyn pri reakcii s 12,5 cm3 roztoku NaOH s hmotnostným podielom 25% a hustotou 1,28 g / cm3 vytvoril kyslú soľ. Nájdite hmotnosť pôvodného sulfidu železa.
6. Sulfid železitý (II) s hmotnosťou 176 g sa spracuje prebytkom kyseliny chlorovodíkovej a výsledný plyn sa spaľuje prebytočným vzduchom. Aký objem roztoku KOH s hmotnostným podielom 40% a hustotou 1,4 g / cm3 je potrebný na úplnú neutralizáciu plynu získaného pri spaľovaní?
7. Pri spaľovaní 100 g technického pyritu sa získal plyn, s ktorým sa úplne neutralizovalo 400 cm3 roztoku NaOH s hmotnostným podielom 25% a hustotou 1,28 g / cm3. Stanovte hmotnostný zlomok nečistôt v pyri.
8. K 2 g zmesi železa, oxidu železitého a oxidu železitého sa pridalo 16 cm3 roztoku HC1 s hmotnostným podielom 20% a hustotou 1,09 g / cm3. Na neutralizáciu nadbytku kyseliny bolo potrebných 10,8 cm3 roztoku NaOH s hmotnostným podielom 10% a hustotou 1,05 g / cm3. Nájdite hmotnosti látok v zmesi, ak je objem vyvíjaného vodíka 224 cm 3 (n.u.).
9. Existuje zmes Ca (OH) 2, CaC03 a BaS04 s hmotnosťou 10,5 g. Keď sa na zmes pôsobí nadbytkom kyseliny chlorovodíkovej, uvoľnilo sa 672 cm3 (n.u.) plynu a 71,2 g kyseliny s hmot. podiely 10%. Určte hmotnosti látok v zmesi.
10. Existuje zmes chloridu bárnatého, uhličitanu vápenatého a hydrogenuhličitanu sodného. Keď sa 10 g tejto zmesi rozpustí vo vode, nerozpustný zvyšok je 3,5 g. Po kalcinácii 20 g počiatočnej zmesi sa jej hmotnosť zníži o 5,2 g. Nájdite hmotnostné frakcie látok v pôvodnej zmesi.
11. Existuje roztok obsahujúci kyselinu sírovú aj dusičnú. Na úplnú neutralizáciu 10 g tohto roztoku sa spotrebuje 12,5 cm3 roztoku KOH s hmotnostným podielom 19% a hustotou 1,18 g / cm3. Keď sa k 20 g tej istej kyslej zmesi roztoku pridá nadbytok chloridu bárnatého, vytvorí sa 4,66 g zrazeniny. Nájdite hmotnostný podiel kyselín v zmesi.
12. Všetok chlorovodík získaný zo 100 g zmesi KC1 a KNO3 sa rozpustil v 71,8 cm3 vody. Po kalcinácii 100 g rovnakej zmesi solí zostane 93,6 g pevného zvyšku. Nájdite hmotnostný zlomok chlorovodíka vo vode.
13. Prechodom 2 m 3 vzduchu (NU) cez roztok Ca (OH) 2 sa získali 3 g zrazeniny soli kyseliny uhličitej. Nájdite objemový a hmotnostný zlomok CO 2 vo vzduchu.
14. Oxid uhličitý sa nechá prejsť suspenziou obsahujúcou 50 g CaC03. Reakcia zahŕňala 8,96 dm3 plynu (NU). Aké množstvo CaCO 3 zostalo v tuhej fáze?
15. Pri pridávaní vody do CaO sa jej hmotnosť zvýšila o 30%. Aká časť CaO (v hmotnostných%) bola uhasená?
16. Oxid olovnatý (II) s hmotnosťou 18,47 g bol zahrievaný v prúde vodíka. Po reakcii bola hmotnosť získaného olova a nezreagovaného oxidu 18,07 g. Aká hmotnosť oxidu olovnatého nezreagovala?
17. Oxid uhoľnatý pri zahriatí prechádza oxidom železitým. Hmotnosť pevného zvyšku po reakcii je o 2 g menšia ako pôvodná hmotnosť oxidu železitého. Koľko CO zreagovalo (oxid je úplne redukovaný)?
18. Existuje 8,96 dm 3 (NU) zmesi N2, C02 a S02 s relatívnou hustotou vodíka 25. Po prechode nadbytkom roztoku KOH sa objem zmesi znížil štvornásobne. Nájdite objemy plynov v pôvodnej zmesi.
19. Dva poháre obsahujú 100 g roztoku HC1 s hmotnostným zlomkom 2,5%. Do jedného pohára sa pridalo 10 g CaC03, do druhého - 8,4 g MgC03. Ako sa po reakcii bude líšiť hmotnosť okuliarov?
20. Aký objem (n.u.) oxidu siričitého musí prejsť cez 200 cm3 roztoku s hmotnostným podielom 0,1% NaOH a hustotou 1 g / cm3, aby sa získala kyslá soľ?
21. Aký je maximálny objem (n.u.) oxidu uhličitého, ktorý je schopný absorbovať 25 cm3 roztoku s hmotnostným podielom NaOH 25% a hustotou 1,1 g / cm3?
22. Aký je minimálny objem roztoku s hmotnostným podielom KOH 20% a hustotou 1,19 g / cm 3, aby ste mohli absorbovať všetok získaný oxid uhličitý pri úplnej redukcii 23,2 g magnetitu oxidom uhoľnatým?
23. Aké je minimálne množstvo KOH, ktoré musí reagovať s 24,5 g kyseliny ortofosforečnej, aby sa vytvoril iba dihydrogénfosforečnan draselný?
24. Aké je minimálne množstvo Ca (OH) 2, ktoré sa má pridať do 16 g roztoku hydrogenuhličitanu vápenatého s hmotnostným zlomkom 5% soli, aby sa získala stredná soľ?
25. Aké množstvo hydrogénfosforečnanu draselného by sa malo pridať do roztoku obsahujúceho 12,25 g Н 3 РО4, aby potom roztok obsahoval iba dihydrogenfosforečnan draselný?
26. Roztok vo forme suspenzie obsahoval 56,1 g zmesi uhličitanov vápenatých a horečnatých. Na ich premenu na hydrogenuhličitany sme minuli všetok oxid uhličitý získaný spálením 7 dm 3 (NU) etánu. Nájdite množstvo uhličitanu vápenatého v pôvodnej zmesi.
27. Na premenu 9,5 g zmesi hydrogén- a dihydrogénfosforečnanu sodného na priemernú soľ potrebujete 10 cm3 roztoku s hmotnostným podielom NaOH 27,7% a hustotou 1,3 g / cm3. Nájdite množstvo fosforečnanu v zmesi.
28. Prechodom oxidu uhličitého cez roztok obsahujúci 6 g NaOH sa získalo 9,5 g zmesi kyslých a stredných solí. Nájdite objem spotrebovaného oxidu uhličitého.
29. Po prechode 11,2 dm3 (NU) C02 cez roztok KOH sa získalo 57,6 g zmesi kyslých a stredných solí. Nájdite hmotu stredne silnej soli.
30. Aké množstvo kyseliny ortofosforečnej sa musí neutralizovať, aby sa získalo 1,2 g dihydro- a 4,26 g hydrogénfosforečnanu sodného?
31. K roztoku kyseliny sírovej sa pridal NaOH, čím sa získalo 3,6 g hydrogensíranu a 2,84 g síranu sodného. Určte chemické množstvá kyselín a zásad, ktoré reagovali.
32. Po prechode chlorovodíka cez 200 cm3 roztoku NaOH s hmotnostným podielom 10% a hustotou 1,1 g / cm3 sa hmotnostný podiel NaOH vo výslednom roztoku znížil na polovicu. Stanovte hmotnostný zlomok NaCl vo výslednom roztoku.
33. Rozpustením 14,4 g zmesi medi a jej oxidu (II) sa spotrebovalo 48,5 g roztoku s hmotnostným podielom HNO3 80%. Nájdite hmotnostné frakcie medi a oxidu v pôvodnej zmesi.
34. Oxid sodný s hmotnosťou 6,2 g sa rozpustil v 100 cm3 vody a dostal sa roztok č. 1. Potom sa k tomuto roztoku pridávala kyselina chlorovodíková s hmotnostným podielom 10%, kým médium neutrálne, a získal sa roztok č. :
1) hmotnostné frakcie látok v roztokoch č. 1, 2;
2) hmotnosť roztoku HC1, ktorý sa použil na neutralizáciu roztoku č. 1.
35. 3 g zinku reagujú s 18,69 cm3 roztoku HC1 s hmotnostným zlomkom 14,6% a hustotou 1,07 g / cm3. Po zahriatí sa výsledný plyn vedie cez žiarovku CuO s hmotnosťou 4 g. Aká je hmotnosť získanej medi?
36. Plyn, ktorý sa vyvinul po spracovaní hydridu vápenatého prebytočnou vodou, prešiel cez FeO. V dôsledku toho sa hmotnosť oxidu znížila o 8 g. Nájdite hmotnosť CaH2 ošetreného vodou.
37. Pri kalcinácii vzorky CaCO 3 sa jej hmotnosť znížila o 35,2%. Pevné reakčné produkty sa rozpustili v prebytku kyseliny chlorovodíkovej, čím sa získalo 0,112 dm3 (NU) plynu. Určte hmotnosť pôvodnej vzorky uhličitanu vápenatého.
38. Rozložený dusičnan meďnatý a výsledný oxid meďnatý sa úplne redukuje vodíkom. Výsledné produkty sa nechali prejsť rúrkou s P205 a potom sa hmotnosť skúmavky zvýšila o 3,6 g. Aký je minimálny objem kyseliny sírovej s hmotnostným zlomkom 88% a hustotou 1,87 g / cm3, aby sa rozpustil meď a aká je hmotnosť rozloženej soli?
39. Pri absorpcii oxidu dusičitého (IV) s prebytkom roztoku KOH za studena v neprítomnosti kyslíka sa získalo 40,4 g KNO3. Aká látka sa ešte tvorí a aká je jej hmotnosť?
40. Na neutralizáciu 400 g roztoku obsahujúceho kyselinu chlorovodíkovú a sírovú sa spotrebovalo 287 cm3 roztoku hydroxidu sodného s hmotnostným podielom 10% a hustotou 1,115 g / cm3. Ak sa k 100 g pôvodného roztoku pridá nadbytok roztoku chloridu bárnatého, vypadne 5,825 g zrazeniny. Stanovte hmotnostný zlomok kyselín v pôvodnom roztoku.
41. Po prechode oxidu uhličitého cez roztok hydroxidu sodného sa získalo 13,7 g zmesi média a kyslých solí. Na ich premenu na chlorid sodný potrebujete 75 g kyseliny chlorovodíkovej s hmotnostným podielom 10% HCl. Nájdite objem absorbovaného oxidu uhličitého.
42. Zmes kyseliny chlorovodíkovej a sírovej s celkovou hmotnosťou roztoku 600 g s rovnakými hmotnostnými frakciami kyselín sa spracuje prebytkom hydrogenuhličitanu sodného a dostane sa do nej 32,1 dm3 plynu (NU). Nájdite hmotnostný zlomok kyselín v pôvodnej zmesi.
43. Na neutralizáciu 1 dm3 roztoku NaOH sa spotrebovalo 66,66 cm3 roztoku HNO3 s hmotnostným podielom 63% a hustotou 1,5 g / cm3. Aký objem roztoku kyseliny sírovej s hmotnostným zlomkom 24,5% a hustotou 1,2 g / cm3 by bol potrebný na neutralizáciu rovnakého množstva zásady?
44. V akom objemovom pomere treba na úplnú neutralizáciu vziať roztok kyseliny sírovej s hmotnostným zlomkom 5% a hustotou 1,03 g / cm3 a roztok hydroxidu bárnatého s hmotnostným zlomkom 5% a hustotou 1,1 g / cm3? Odpoveď predložte ako kvocient delenia objemu alkalického roztoku kyslým roztokom.
45. Vypočítajte minimálny objem roztoku amoniaku s hustotou 0,9 g / cm 3 a hmotnostným podielom 25%, ktorý je nevyhnutný na úplnú absorpciu oxidu uhličitého získaného rozkladom 0,5 kg prírodného vápenca s hmotnostným podielom uhličitanu vápenatého rovnajúcim sa 92%.
46. \u200b\u200bNa úplnú premenu 2,92 g zmesi hydroxidu a uhličitanu sodného na chlorid je potrebných 1,344 dm3 chlorovodíka (NU). Nájdite v zmesi hmotnosť uhličitanu sodného.
47. Určité množstvo roztoku hydroxidu sodného s hmotnostným podielom 16% sa pridalo k 25 g roztoku síranu meďnatého s hmotnostným podielom 16%. Vytvorená zrazenina sa odfiltrovala a potom bol filtrát alkalický. Na úplnú neutralizáciu filtrátu bolo potrebných 25 cm3 roztoku kyseliny sírovej s molárnou koncentráciou 0,1 mol / dm3 roztoku. Vypočítajte hmotnosť pridaného roztoku hydroxidu sodného.
48. Látka získaná úplnou redukciou CuO s hmotnosťou 15,8 g vodíkom s koncentráciou 11,2 dm3 (n.s.) sa rozpustila v koncentrovanej kyseline sírovej zahrievaním. Koľko plynu (n.o.) sa uvoľnilo v dôsledku reakcie?
49. Na úplnú neutralizáciu 50 cm3 kyseliny chlorovodíkovej s hmotnostným podielom 20% HCl a hustotou 1,10 g / cm3 sa použil roztok hydroxidu draselného s hmotnostným podielom 20% KOH. Aké je chemické množstvo vody vo výslednom roztoku?
50. Plyn získaný prechodom prebytočného C02 nad 0,84 g horúceho uhlia reaguje s 14,0 g zahriateho oxidu meďnatého. Aký objem roztoku kyseliny dusičnej s hmotnostným zlomkom 63% a hustotou 1,4 g / cm3 je potrebný na úplné rozpustenie látky získanej pri poslednej reakcii?
51. Po kalcinácii na konštantnú hmotnosť dusičnanu meďnatého sa hmotnosť soli znížila o 6,5 g. Aké množstvo soli sa rozložilo?
52. Pôsobením nadbytku kyseliny chlorovodíkovej na zmes hliníka s neznámym jednomocným kovom sa uvoľnilo 6,72 dm3 (n.u.) plynu a hmotnosť zmesi sa znížila na polovicu. Keď sa na zvyšok pôsobilo zriedenou kyselinou dusičnou, uvoľnilo sa 0,373 dm3 (n.s.) NO. Identifikujte neznámy kov.
53. Hmotnosť vzorky kriedy je 105 g a chemické množstvo kyslíka v jej zložení je 1 mol. Stanovte hmotnostný zlomok CaCO 3 vo vzorke kriedy (kyslík je iba časťou uhličitanu vápenatého).
54. Po interakcii oxidu siričitého s vodou sa získal roztok s hmotnostným podielom kyseliny sírovej 25%. Keď sa k tomuto roztoku pridal prebytok Ba (OH) 2, vytvorila sa zrazenina s hmotnosťou 29,13 g. Aké množstvá S03 a H20 sa použili na tvorbu kyslého roztoku?
55. Pri prechode S02 cez 200 g roztoku s hmotnostným podielom NaOH 16% sa vytvorila zmes solí, vrátane 41,6 g kyslej soli. Aké množstvo síry obsahujúce 4,5% hmotnostných nečistôt sa použilo na získanie SO 2? Aká je hmotnosť strednej soli?
56. Interakcia s 80 g roztoku Ca (N03) 2 vyžaduje 50 g roztoku Na2C03. Vytvorená zrazenina sa oddelila a po pridaní prebytku kyseliny chlorovodíkovej sa uvoľnilo 2,24 dm3 (NU) plynu. Aké sú hmotnostné podiely solí v počiatočných roztokoch? Aký je hmotnostný zlomok dusičnanu sodného v roztoku po oddelení zrazeniny?
57. Interakcia zinku s kyselinou sírovou vytvorila 10 dm 3 (NU) zmesi SO2 a H2S s relatívnou hustotou 1,51 pre argón. Koľko zinku bolo rozpustené? Aký je hmotnostný zlomok SO 2 v zmesi plynov?
58. Vzorka zmesi zinkových a hliníkových pilín s celkovou hmotnosťou 11 g sa rozpustila v prebytku alkalického roztoku. Stanovte objem (n.o.) vyvíjaného plynu, ak je hmotnostný podiel zinku v zmesi rovný 30%.
59. Hydroxid sodný s hmotnosťou 4,0 g sa roztavil s hydroxidom hlinitým s hmotnosťou 9,8 g. Vypočítajte hmotnosť získaného metaluminátu sodného.
60. Pri spracovaní 10 g zmesi medi a hliníka koncentrovanou kyselinou dusičnou pri teplote miestnosti sa uvoľnilo 2,24 dm3 plynu (NU). Aký objem (n.o.) plynu sa uvoľní pri spracovaní rovnakej hmotnosti zmesi s prebytkom roztoku KOH?
61. Na zliatinu medi a hliníka s hmotnosťou 20 g sa pôsobilo prebytkom zásady, nerozpustný zvyšok sa rozpustil v koncentrovanej kyseline dusičnej. Takto získaná soľ sa izolovala, kalcinovala do konštantnej hmotnosti a získalo sa 8 g tuhého zvyšku. Stanovte objem spotrebovaného roztoku NaOH s hmotnostným podielom 40% a hustotou 1,4 g / cm3).
62. Zmes hliníka a oxidu kovu (II) (oxid nie je amfotérny) s hmotnosťou 39 g sa spracuje prebytkom roztoku KOH, vyvíjaný plyn sa spáli a získa sa 27 g vody. Nerozpustný zvyšok sa úplne rozpustil v 25,2 cm3 roztoku s hmotnostným podielom HCl 36,5% a hustotou 1,19 g / cm3). Stanovte oxid.
63. Na zmes zinkových a medených triesok sa pôsobilo prebytkom roztoku KOH, pričom sa vyvíjal plyn s objemom 2,24 dm3 (NU). Pre úplnú chloráciu tej istej vzorky kovov bol potrebný chlór s objemom 8,96 dm 3 (NU). Vypočítajte hmotnostný zlomok zinku vo vzorke.
64. Na zmes železných, hliníkových a horčíkových pilín s hmotnosťou 49 g sa pôsobilo prebytkom zriedenej H2S04, čím sa získalo 1,95 mol plynu. Ďalšia časť tej istej zmesi s hmotnosťou 4,9 g sa spracuje prebytkom alkalického roztoku a získa sa 1,68 dm3 (NU) plynu. Nájdite masy kovov v zmesi.
65. Aká je hmotnosť zrazeniny, ktorá sa vytvorí po zlúčení roztokov obsahujúcich 10 g NaOH a 13,6 g ZnCl2?
66. Existujú dve časti zmesi Al, Mg, Fe, Zn rovnakého molárneho zloženia, každá s hmotnosťou 7,4 g. Jedna dávka sa rozpustila v kyselina chlorovodíková a prijal 3,584 dm 3 plynu (n.u.), druhý - v alkalickom roztoku a prijal 2,016 dm 3 plynu (n.u.). Je známe, že v obidvoch zmesiach existujú 3 atómy Zn na atóm Al. Nájdite masy kovov v zmesi.
67. Na zmes medi, horčíka a hliníka s hmotnosťou 1 g sa pôsobilo prebytkom kyseliny chlorovodíkovej. Roztok sa prefiltroval, k filtrátu sa pridal prebytok roztoku NaOH. Výsledná zrazenina sa oddelila a kalcinovala do konštantnej hmotnosti 0,2 g. Zvyšok, ktorý sa nerozpustil po pôsobení kyseliny chlorovodíkovej, sa kalcinoval na vzduchu, čím sa získalo 0,8 g čiernej látky. Nájdite hmotnostný zlomok hliníka v zmesi.
68. Keď sa zliatina zinku, horčíka a medi zahrieva v prúde kyslíka, hmotnosť zmesi sa zvýšila o 9,6 g. Produkt sa čiastočne rozpustí v alkáliách a na rozpustenie je potrebných 40 cm3 roztoku s hmotnostným podielom KOH 40% a hustotou 1,4 g / cm. 3. Na reakciu s rovnakou časťou zliatiny je potrebných 0,7 mol HC1. Nájdite chemické množstvá kovov v zliatine.
69. Na zliatinu medi a zinku s hmotnosťou 5 g sa pôsobilo prebytkom roztoku NaOH. Potom sa tuhý zvyšok oddelil a pôsobil koncentrovanou HN03, výsledná soľ sa izolovala, kalcinovala do konštantnej hmotnosti a získalo sa 2,5 g tuhého zvyšku. Určte hmotnosť kovov v zliatine.
70. Na zliatinu medi a hliníka s hmotnosťou 12,8 g sa pôsobilo prebytkom kyseliny chlorovodíkovej. Nerozpustný zvyšok sa rozpustil v koncentrovanej kyseline dusičnej, výsledný roztok sa odparil, suchý zvyšok sa kalcinoval do konštantnej hmotnosti a získali sa 4 g tuhej látky. Určte hmotnostný zlomok medi v zliatine.
71. V akom hmotnostnom pomere by sa mali brať dve dávky Al, aby sa pri pridaní jedného do alkalického roztoku a druhého do kyseliny chlorovodíkovej uvolnili rovnaké objemy vodíka?
72. Pri spracovaní zmesi oxidu hlinitého a meďnatého s prebytkom roztoku KOH sa uvoľnilo 6,72 dm3 (n.u.) plynu a keď sa rovnaká časť zmesi rozpustila v koncentrovanej HN03 pri teplote miestnosti, získalo sa 75,2 g soli. Nájdite hmotnosť pôvodnej zmesi látok.
73. Akú hmotnosť oxidu meďnatého je možné znížiť pomocou vodíka získaného interakciou prebytočného hliníka s 139,87 cm3 roztoku s hmotnostným podielom NaOH 40% a hustotou 1,43 g / cm3?
74. Pri úplnej oxidácii 7,83 g zliatiny dvoch kovov sa vytvorilo 14,23 g oxidov, pri ktorých zostalo 4,03 g sedimentu nerozpusteného. Určte kvalitatívne zloženie kovov, ktoré tvoria zliatinu, ak majú ich katióny oxidačný stav +2 a +3 a molárny pomer oxidov je 1: 1 (zvážte, že oxid kovu s oxidačným stavom +3 má amfotérne vlastnosti).
75. Dva podiely hliníka, ktoré majú rovnakú hmotnosť, boli rozpustené: jeden v roztoku hydroxidu draselného a druhý v kyseline chlorovodíkovej. Aký je vzťah medzi objemami vyvíjaných plynov (n.o.)?
76. Na zliatinu medi a hliníka s hmotnosťou 1 000 g sa pôsobilo prebytkom alkalického roztoku, nerozpustný zvyšok sa rozpustil v kyseline dusičnej, potom sa roztok odparil a zvyšok sa kalcinoval na konštantnú hmotnosť. Hmotnosť nového zvyšku je 0,398 g. Aké sú hmotnosti kovov v zliatine?
77. Na zliatinu zinku a medi s hmotnosťou 20 g sa pôsobilo prebytkom roztoku NaOH s hmotnostným podielom 30% a hustotou 1,33 g / cm3. Tuhý zvyšok sa izoloval a zmiešal s prebytkom koncentrovaný roztok HNO 3. Výsledná soľ bola izolovaná a kalcinovaná na konštantnú hmotnosť. Hmotnosť pevného zvyšku bola 10,016 g. Vypočítajte hmotnostný zlomok kovov v zliatine a spotrebovaný objem alkalického roztoku.
78. Na zliatinu medi a hliníka s hmotnosťou 2 g sa pôsobilo prebytkom alkalického roztoku. Zvyšok sa odfiltroval, premyl, rozpustil v HN03, roztok sa odparil a kalcinoval do konštantnej hmotnosti. Hmotnosť zvyšku po kalcinácii bola 0,736 g. Vypočítajte hmotnostné frakcie kovov v zliatine.
79. Chlórovanie zmesi železa, medi a hliníka vyžaduje 8,96 dm 3 chlóru (NU) a interakcia tej istej vzorky s chlorovodíkom vyžaduje 5,6 dm 3 (NU). Keď rovnaká hmotnosť zmesi kovov interaguje s zásadami, uvoľní sa 1,68 dm 3 (NU) plynu. Nájdite chemické množstvo kovov v zmesi.
80. Hydrid draselný s hmotnosťou 5,0 g sa rozpustil vo vode s objemom 80 cm3 a do výsledného roztoku sa pridal hliník s hmotnosťou 0,81 g. Hmotnostné frakcie látok vo výslednom roztoku nájdite s presnosťou na tisíciny percenta.
ZOZNAM ODKAZOV
1. Barannik, V.P. Moderná ruská nomenklatúra anorganických zlúčenín / V.P. Barannik // vestník All-Union Chemical Society. DI. Mendelejev. - 1983. - T. XXVIII. - S. 9-16.
2. Vrublevskij, A.I. Chemický simulátor / A.I. Vrublevskij. - 2. vydanie, Rev. a pridať. - Minsk: Krasiko-Print, 2007. - 624 s.
3. Glinka, N.L. Úlohy a cvičenia zo všeobecnej chémie: učebnica. príručka pre univerzity / Vyd. V.A. Rabinovich a H.M. Rubina. - M .: Integral-Press, 2004. - 240 s.
4. Lidin, R.A. Úlohy všeobecnej a anorganickej chémie: učebnica. príručka pre študentov vyšších ročníkov. štúdium. inštitúcie / R.A. Lidin, V.A. Molochko, L.L. Andreeva; vyd. R.A. Lidina. - M .: VLADOS, 2004 .-- 383 s.
5. Lidin, R.A. Základy nomenklatúry anorganických látok / R.A. Lidin [et al.]; vyd. B.D. Vstúpiť. - M.: Chemistry, 1983. - 112 s.
6. Stepin, B.D. Uplatňovanie pravidiel IUPAC na nomenklatúru anorganických zlúčenín v ruštine / B.D. Stepin, R.A. Lidin // vestník All-Union Chemical Society. DI. Mendelejev. - 1983. - T. XXVIII. - S. 17–20.
| Úvod ……………………………………………………………… Všeobecné pravidlá nomenklatúra anorganických látok ………… .. Oxidy ………………………………………………………… Základné oxidy …………………………………… ………………… ... Oxidy kyselín …………………………………………………. Amfoterné oxidy ………………………………………………… .. Získavanie oxidov …………………………………………………… Cvičenia pre samostatnú prácu na téma „Oxidy“ …………………………………………………. Kyseliny ……………………………………………………………. Cvičenia pre samostatnú prácu na tému „Kyseliny“ ………………………………………………… základy ……………………………………………………… ……… .. Cvičenia pre samostatnú prácu na tému „Nadácie“ …………………………………………………. Soli …………………………………………………………………. Cvičenia pre samostatnú prácu na tému „Soli“ …………………………………………………… ... Genetický vzťah medzi triedami anorganických zlúčenín …………………… ... …………… .. Cvičenia pre samostatnú prácu na tému „Genetický vzťah medzi triedami anorganických zlúčenín“ ………………………………………… Experimentálne experimenty na tému „Základné triedy anorganických zlúčenín …………… ……… .. Problémy s výpočtom ……………………………………………… Zoznam literatúry ……………………………………………………… |
Téma: GENETICKÝ VZŤAH MEDZI kovmi a nekovmi a ich zlúčeninami. 9. ročník.
Ciele: vzdelávacie: upevniť pojmy „genetické série“, „genetické prepojenie“; naučiť sa skladať genetické rady prvkov (kovy a nekovy), zostavovať reakčné rovnice zodpovedajúce genetickým radom; skontrolovať, ako vedomosti o chemické vlastnosti oxidy, kyseliny, soli, zásady; vývoj: rozvíjať schopnosť analyzovať, porovnávať, zovšeobecňovať a vyvodzovať závery, vytvárať rovnice chemických reakcií; vzdelávacie: podporovať formovanie vedeckého svetonázoru.
Poskytovanie hodín: tabuľky „Periodická tabuľka“, „Tabuľka rozpustnosti“, „Množstvo kovových aktivít“, pokyny pre študentov, úlohy na overenie vedomostí.
Postup práce: 1) Org. okamih
2) Kontrola d / z
3) Učenie sa nového materiálu
4) Kotvenie
5) D / Z
1) Org. okamih. Pozdravujem vás.
2) Kontrola d / z.
Genetické väzby sú väzby medzi rôznymi triedami na základe ich vzájomnej premeny.
Ak poznáme triedy anorganických látok, je možné zostaviť genetickú sériu kovov a nekovov. Tieto série sú založené na rovnakom prvku.
Medzi kovmi možno rozlíšiť dva typy riadkov:
1 ... Genetická séria, v ktorej alkálie pôsobia ako báza. Túto sériu je možné znázorniť pomocou nasledujúcich transformácií:
kov → zásaditý oxid → zásada → soľ
Napríklad K → K 2 O → KOH → KCl
2 ... Genetické číslo, kde báza slúži ako nerozpustná báza, potom môže byť číslo predstavované reťazcom transformácií:
kov → zásaditý oxid → soľ → nerozpustná zásada →
→zásaditý oxid → kov
Napríklad Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
1 ... Genetická séria nekovov, kde rozpustná kyselina pôsobí ako článok v sérii. Transformačný reťazec môže byť znázornený takto:
nekov → kys. kys. → rozpustná kyselina → sol
Napríklad P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
2 ... Genetická séria nekovov, kde nerozpustná kyselina pôsobí ako odkaz v sérii:
nekov → kys.oxid → sol → kys. →
→kys.oxid → nekovový
NapríkladSi→ SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Frontálny rozhovor o otázkach:
Čo je genetický vzťah? Genetické vzťahy sú vzťahy medzi rôznymi triedami založené na ich vzájomnej premene. Čo je genetická séria?
Genetická séria - množstvo látok - zástupcovia rôznych tried, ktoré sú zlúčeninami jedného chemického prvku, vzájomne premieňané a odrážajúce premeny týchto látok. Tieto série sú založené na rovnakom prvku.
Aké typy genetických sérií sa zvyčajne rozlišujú? Medzi kovmi možno rozlíšiť dva typy sérií:
a) Genetická séria, v ktorej alkálie pôsobia ako báza. Túto sériu je možné znázorniť pomocou nasledujúcich transformácií:
kov → zásaditý oxid → zásada → soľ
napríklad genetická línia draslíka K → K 2 O → KOH → KCl
b) počet genetických, kde báza slúži ako nerozpustná báza, potom môže byť počet predstavovaný reťazcom transformácií:
kov → zásaditý oxid → soľ → nerozpustná zásada → zásaditý oxid → kov
napríklad: Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
Z nekovov možno rozlišovať aj dva typy sérií:
a) Genetická séria nekovov, kde rozpustná kyselina pôsobí ako článok v sérii. Reťazec transformácií je možné znázorniť nasledovne: nekovový → oxid kyseliny → rozpustná kyselina → soľ.
Napríklad: P → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
b) Genetická séria nekovov, kde nerozpustná kyselina pôsobí ako odkaz v rade: nekov → kys. kys. → soľ → kys. → kys. kys. → nekov
Napríklad: Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si
Dokončenie zadania podľa možností:
1. Vyberte vo svojom variante vzorce oxidov, vysvetlite svoj výber na základe znalostí charakteristík zloženia tejto triedy zlúčenín. Pomenujte ich.
2. V stĺpci vzorca vášho variantu nájdite kyslé vzorce a vysvetlite svoj výber na základe analýzy zloženia týchto zlúčenín.
3. Určite valencie zvyškov kyselín v zložení kyselín.
4. Vyberte vzorce soli a pomenujte ich.
5. Vytvorte vzorce solí, ktoré môžu byť tvorené horčíkom a kyselinami vášho variantu. Napíšte si ich, pomenujte.
6. V stĺpci vzorca vášho variantu nájdite základné vzorce a vysvetlite svoj výber na základe analýzy zloženia týchto zlúčenín.
7. Podľa vlastného výberu vyberte vzorce látok, s ktorými môže reagovať roztok kyseliny fosforečnej (chlorovodíková, sírová). Napíšte príslušné reakčné rovnice.
9. Medzi vzorcami vašej verzie vyberte vzorce látok, ktoré môžu vzájomne pôsobiť. Napíšte príslušné reakčné rovnice.
10. Vytvorte reťaz genetických väzieb z anorganických zlúčenín, ktorá bude obsahovať látku, ktorej vzorec je uvedený vo vašej verzii ako číslo jeden.
možnosť 1
Možnosť 2
CaO
HNO 3
Fe (OH) 3
N 2 O
Zn (NO 3 ) 2
Cr (OH) 3
H 2 TAK 3
H 2 S
PbO
LiOH
Ag 3 PO 4
P 2 O 5
NaOH
ZnO
CO 2
BaCl 2
HCl
H 2 CO 3
H 2 TAK 4
CuSO 4
Z týchto látok zostavte genetickú sériu pomocou všetkých vzorcov. Napíšte reakčné rovnice, pomocou ktorých môžete uskutočniť tento reťazec transformácií:
Možnosť I: ZnSO 4, Zn, ZnO, Zn, Zn (OH) 2 : II možnosť:Na 2 TAK 4, NaOH, Na, Na 2 O 2 , Na 2 O
4) Kotvenie 1.Al→ Al 2 O 3 → AlCl 3 → Al( OH) 3 → Al 2 O 3
2. P→ P 2 O 5 → H 3 PO 4 → Na 3 PO 4 → Ca 3 ( PO 4 ) 2
3. Zn → ZnCl 2 → Zn (OH) 2 → ZnO → Zn (Č 3 ) 2
4. Cu → CuO → CuCl 2 → Cu (OH) 2 → CuO → Cu
5.N 2 O 5 → HNO 3 → Fe (NO 3 ) 2 → Fe (OH) 2 → FeS → FeSO 4
5)Domáca úloha: zmapujte postupný prechod z vápniku na uhličitan vápenatý a pripravte správu o medicínskom použití akejkoľvek soli (s použitím ďalšej literatúry).

Medzi kovmi možno rozlíšiť dva typy sérií: 1. Genetické série, v ktorých alkalické látky pôsobia ako báza. Túto sériu je možné znázorniť pomocou nasledujúcich transformácií: kov - zásaditý oxid - zásada - soľ, napríklad genetická séria draslíka K - K20 - KOH - KCl.

2. Genetická séria, kde nerozpustná báza funguje ako báza, potom možno sériu predstaviť ako reťazec transformácií: kov - zásaditý oxid - soľ - nerozpustná zásada - zásaditý oxid - kov. Cu - CuO - CuCl 2 - Cu (OH) 2 - CuO -\u003e Cu meď genetická línia "\u003e Cu genetická séria medi"\u003e "title \u003d" (! LANG: 2. Genetická séria, kde nerozpustná báza funguje ako báza, môže byť táto séria reprezentovaná ako reťazec transformácií: kov - zásaditý oxid - soľ - nerozpustná báza - zásaditý oxid - kov.Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> title="2. Genetická séria, kde nerozpustná báza funguje ako báza, potom možno sériu predstaviť ako reťazec transformácií: kov - zásaditý oxid - soľ - nerozpustná zásada - zásaditý oxid - kov. Cu - CuO - CuCl2 - Cu (OH) 2 - CuO -\u003e"> !}
Z nekovov možno rozlišovať aj dva typy sérií: 1. Genetická séria nekovov, kde rozpustná kyselina pôsobí ako spojnica v sérii. Reťazec transformácií je možné znázorniť nasledovne: nekov - oxid kyseliny - rozpustná kyselina - soľ. P-- P 2 O 5 - H 3 PO 4 - Na 3 PO 4. genetická séria fosforu

