Fizička i hemijska svojstva sumpora. Sumpor je
Postavljanje elektrona u orbitale vanjskog sloja
Na atomu sumpora postoji 6 valentnih elektrona, pa sumpor može stvoriti do 6 valentnih veza. Atom sumpora ima veći radijus i stoga pokazuje manje elektronegativnosti od kiseonika. Oksidacija navodi da se može pokazati u redoks reakcijama: S 0, S -2, S +4, S +6.
■ 68. Napišite jednadžbe za reakcije sumpora s jednostavnim supstancama, o kojima se govori u pasusu, jesu li ove reakcije redoks? Dajte obrazloženi odgovor.
69. Kakvo je oksidaciono stanje sumpora u jedinjenjima sa vodonikom i metalima?
70. Koja vrsta sumpornih jedinjenja sa metalima?
71. Zašto se cink i aluminijum ne mogu dobiti reakcijama razmene u rastvorima?
72. Koliko će se dobiti željezo (II) sulfida ako se uzme 30 g željeza i 16 g sumpora, a ako se koristi samo 90%?
Moguće su i druge reakcije, uslijed čega sumpor dobiva pozitivna oksidacijska stanja. To se obično događa tokom direktne interakcije sumpora sa kiseonikom - tokom sagorevanja sumpora:
S + O2 \u003d SO2
Budući da kisik ima veću vrijednost elektronegativnosti od sumpora, sumpor u spoju SO2 pokazuje oksidacijsko stanje od +4 i ponaša se kao redukciono sredstvo u ovoj reakciji. Dublja oksidacija vode do oksidacionog stanja +6 moguća je stvaranjem sumpornog anhidrida. U prisustvu katalizatora na temperaturi od 400-500 °, sumpor-dioksid se oksidira kiseonikom, formirajući sumporni anhidrid:
2SO2 + O2 \u003d 2SO3
Uprkos visokoj hemijskoj aktivnosti, sumpor je široko dostupan u obliku minerala koji se naziva prirodni sumpor. Gotovo je isključivo rombični sumpor. Ostale alotropne modifikacije sumpora se u prirodi ne javljaju.
Sumpor je obično prošaran u razne stijene, od kojih se prilično lako može topiti. najčešće vulkanskog porijekla. Izvorni sivi Kavkaz, pustinja Kara-Kum, poluostrvo Kerč, Uzbekistan su bogati.
Sumpor se takođe nalazi u obliku sumpornih metala, r-sulfida (FeS2, spoj cinka ZnS, olovni sjaj PbS), u obliku sulfata (Glauberova sol Na2SO4 · 10H2O, CaSO4 · 2H2O). Sumpor se nalazi u nekim proteinima. Da bi se iz stijene izdvojio sumpor, on se topi u autoklavima djelovanjem pregrijane pare na 150-160 °. Rezultirajući rastopljeni sumpor se rafinira (pročišćava) sublimacijom. Ako se rastopi i izlije u drvene kalupe, tada se stvrdne u obliku štapića. Ovaj sumpor naziva se reznicama.
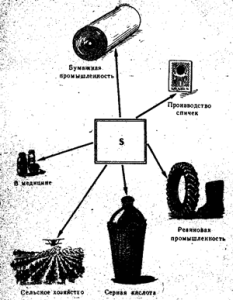
Slika: 52. Upotreba sumpora
Ponekad se sumpor ulije u veliki kalup, a nakon stvrdnjavanja podijeli na male bezoblične komade. Ovaj sumpor naziva se grudvast. Napokon, sumpor se može dobiti u obliku fino raspršenog praha - takozvane sumporne boje.
Slobodni sumpor koristi se uglavnom u proizvodnji sumporne kiseline, kao i u industriji papira, za vulkanizaciju gume, u proizvodnji boja, u poljoprivredi za oprašivanje i fumigaciju grožđa i pamuka, u proizvodnji šibica (slika 52). U medicini se sumpor koristi u obliku masti zajedno s drugim supstancama protiv šuga i drugih kožnih bolesti. Čisti sumpor nije otrovan.
■ 73. Lista hemijska svojstva sumpor, naznačujem u čemu je sličnost, a koja razlika između sumpora i kiseonika.
57. Jedinjenja dvovalentnog sumpora
Dvovalentni sumpor formira spojeve sa vodonikom (H2S) i metalima (Na2S, FeS). Sulfidi se mogu smatrati derivatima vodonik-sulfida, tj. Soli sumporovodične kiseline.
Hidrogen sulfid... Molekula sumporovodika izgrađena je prema polarnom tipu veze:
Uobičajeni elektronski parovi snažno su pristrani prema atomu, sumpor je više elektronegativan.
Vodikov sulfid plin je teži od zraka, oštrog neprijatnog mirisa pokvarenih jaja. Ovaj plin je vrlo toksičan. Naši organi mirisa vrlo su osjetljivi na sumporovodik. U prisustvu 1/2000 dela vodonik-sulfida u vazduhu može doći do gubitka mirisa. Kronično trovanje sumporovodikom u malim dozama uzrokuje mršavost, glavobolju, bol. U slučaju težeg trovanja, nesvjestica se može pojaviti nakon nekog vremena, a vrlo jake koncentracije uzrokuju smrt od paralize disanja. U slučaju trovanja vodonik-sulfidom, rolnu je potrebno odneti na svež vazduh i pustiti da udiše male količine klora, kao i čistu. Maksimalno dozvoljena koncentracija vodonik-sulfida u radnoj sobi je 0,01 mg / l.
Vodikov sulfid postaje tečan na temperaturi od -60 °. Dobro se rastvara u vodi, pri čemu tvori vodonik-sulfidnu vodu H2Saq, ili, kako je još nazivaju, sumporovodičnu kiselinu.
Vodikov sulfid je jedno od najboljih redukcionih sredstava. Lako redukuje bromnu i klornu vodu u bromovodičnu ili hlorovodoničnu kiselinu:
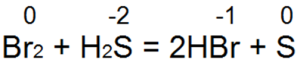
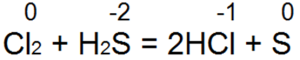
U ovoj reakciji S (-2) se oksidira u neutralni sumpor S (0).
Vodikov sulfid gori. Uz dovoljan pristup vazduhu (slika 53, a), dolazi do potpunog sagorijevanja prema jednačini:
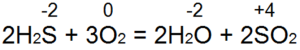
U ovom slučaju, S (-2) se oksidira u S (+4), donira se 6 elektrona i reducira sa O (0) na O (-2). Ako a
nedovoljan pristup vazduhu ili ako se hladni predmet uvede u plamen vodonik-sulfida (slika 53.6), tada dolazi do nepotpunog sagorijevanja prema jednačini:
2H2S + O2 \u003d 2S + 2H2O
■ 74. Koje su mjere prve pomoći kod trovanja vodonik-sulfidom?
75. Zašto se često naziva hidrosumporna kiselina
sumporovodična voda?
76. Kada se jodna voda pomiješa sa sumporovodičnom vodom, dolazi do promjene boje i zamućenja rastvora. Kako se ovo može objasniti?
77. Da li je moguće da S (-2) pokazuje oksidaciona svojstva?
U laboratoriju se sumporovodik u Kippovom aparatu dobija interakcijom željeznog sulfida (ili natrijum sulfida) s razrijeđenom sumpornom kiselinom:
FeS + H2SO4 \u003d FeSO4 + H2S

Slika: 53. Sagorevanje vodonik-sulfida sa potpunim pristupom vazduhu (a) i nepotpunim pristupom vazduhu (b).
Vodikov sulfid, rastvarajući se u vodi, stvara slabu sumporovodičnu kiselinu koja se razdvaja u dvije faze:
H2S ⇄ N + + HS - ⇄ 2N + + S 2-
Druga faza je beznačajna.
Vodikov sulfidna kiselina se zbog svoje nestabilnosti ne može dugo skladištiti u laboratoriju. Postepeno postaje mutno kao rezultat oslobađanja slobodnog sumpora:
H2S \u003d H2 + S
U redoks reakcijama, sumporovodična kiselina ponaša se poput tipičnog redukcijskog sredstva, na primjer:
H2S + K2Cr2O7 + H2SO4 → (S 0; Cr +3)
Dovršite sami jednadžbu za ovu redoks reakciju.
Vodikov sulfid koristi se u analitičkoj hemiji.
Vodikov sulfidna kiselina pokazuje opšta svojstva kiselina. Istina, na njemu se ne mogu uočiti sva svojstva kiselina. Na primjer, kao što je, ne reagirajte s njom i, ulazeći u sumporovodičnu kiselinu, ne reagirajte s njom, već s vodom koja je tamo prisutna, tvoreći lužinu, koja tada može reagirati sa sumporovodičnom kiselinom. Budući da je dvobazna kiselina, može formirati dvije serije soli - sulfide i hidrosulfide ili bisulfide.
Srednje soli sumporovodične kiseline - sulfidi - nisu rastvorljive u vodi, osim natrijumove i kalijumove soli, i imaju različite boje: olovni i željezni sulfid - crni, cink - bijeli, kadmijum - žuti. Hidrosulfidi su lako rastvorljivi u vodi.
Reagens za dvovalentni sumporni ion S 2- je kadmijum-jon Cd 2+, koji u kombinaciji s jonom daje žuti talog, nerastvoren u vodi, na primjer:
Cd (NO3) 2 + H2S \u003d CdS ↓ + 2HNO3
Cd 2+ + S 2- \u003d CdS
Sulfidi se prilično lako hidroliziraju kao soli slabih kiselina, pa se obično dobijaju direktnom interakcijom sumpora i metala.
■ 78. Napišite jednadžbu reakcije sumporovodične kiseline sa natrijum hidroksidom i objasnite rezultat reakcije, uzimajući u obzir hidrolizu soli u otopini.
79. U sanitarnim i higijenskim istraživanjima koristi se vrlo osjetljiva reakcija s topljivim olovnim solima za otkrivanje sumporovodika u zraku. Šta se može uočiti kod ove reakcije u punom jonskom i redukovanom jonskom obliku?
§ 58. Jedinjenja četverovalentnog sumpora
Spoj četverovalentnog sumpora - sumpor-dioksid (sumpor-dioksid) SO2. Sumpor-dioksid je teži od zraka i ima jak, neugodan miris. Molekula sumpor-dioksida je takođe izgrađena prema kovalentnoj vrsti veze, a njen polaritet je slabo izražen. Na -10 ° i atmosferskom pritisku sumpor-dioksid se pretvara u tečnost i stvrdnjava na -73 °. Lako je rastvorljiv u vodi (za 1 zapreminu vode 40 zapremina sumpor-dioksida), dok uz otapanje stupa u interakciju s vodom prema jednačini:
SO2 + N2O H2SO3
Rezultirajuća sumporna kiselina je vrlo krhka, pa je reakcija reverzibilna.
Sumpor-dioksid je od velike industrijske važnosti. Dobija se pečenjem pirita FeS2 ili sumpora:
4FeS2 + 11O2 \u003d 2Fe2O3 + 8SO2 S + O2 \u003d SO2
U laboratoriju se dobija djelovanjem jakih kiselina na soli sumporne kiseline, na primjer djelovanjem sumporne kiseline na:
Na2SO3 + H2SO4 \u003d Na2SO4 + H2O + SO2
Sumpor-dioksid se može dobiti razgradnjom soli sumporne kiseline, kao što je kalcijum-sulfit CaSO3, zagrevanjem;
CaSO3 \u003d CaO + SO2
Sumpor-dioksid je otrovan. U slučaju trovanja njime, javlja se promuklost, otežano disanje, a ponekad i gubitak svijesti. Dozvoljena koncentracija SO2 u zraku je 0,02 mg / l.
Pri interakciji s organskim bojama sumpor-dioksid može prouzročiti njihovu promjenu boje, međutim, razlog tome je drugačiji nego kod izbjeljivanja klorom: ne dolazi do oksidacije, već se pojavljuje bezbojni spoj SO2 s bojom, koji se vremenom uništava i boja boje se obnavlja.
■ 80. Predložite crteže uređaja pomoću kojih sumpor-dioksid možete dobiti: a) iz natrijum-sulfita dejstvom kiseline: b) kalcinišući kalcijum-sulfit.
81. Sumpor-dioksid dobijen razgradnjom 40 g kalcijum-sulfita propušten je kroz 500 g rastvora baritne vode Ba (OH) 2, uslijed čega se istaloži sve što je u otopini. Koliki je procenat vode barita ako se izgubi 20% sumpornog dioksida proizvedenog pečenjem?
82. Kojoj grupi oksida pripada sumpor-dioksid? Navedite njegova svojstva tipična za ovu skupinu oksida. Podržite svoj odgovor jednadžbama reakcija.
83. Zašto se zamućenost javlja prilikom prolaska SO2 kroz krečnu vodu, kao i pri propuštanju CO2?
84. Zrak sadrži sumpor-dioksid. Kako ga osloboditi ove nečistoće?
85. Koliko se sumpor-dioksida može dobiti iz 20 mola FeS2 pri prinosu od 80%?
86. Sumpor dioksid je propušten kroz 200 ml 20% rastvora natrijum hidroksida do potpune konverzije natrijum hidroksida u sulfit (hidroliza se ne uzima u obzir). Kolika je koncentracija dobijene otopine natrijum sulfita?
S obzirom na činjenicu da je oksidaciono stanje sumpora u sumpor-dioksidu + 4, tj. Konvencionalno su 4 elektrona donirana iz vanjskog nivoa atoma sumpora, postoje dvije mogućnosti za to: ili može dodatno donirati 2 elektrona preostala na vanjskom sloju i tada će pokazati
svojstva redukcijskog sredstva ili S (+4) može prihvatiti određeni broj elektrona i tada će pokazivati \u200b\u200boksidaciona svojstva.
Na primjer, u prisustvu jakog oksidirajućeg agensa, S (+4) se ponaša kao redukcijsko sredstvo.
Br2 + H2O + SO2 → H2SO4 + HBr
KMnO4 + N2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2 (SO4) 3 + H2O
Koeficijente ovih reakcija pronađite sami.
Od posebne važnosti je oksidacija sumpor-dioksida kisikom u prisustvu katalizatora V2O5 ili Pt na temperaturi od 400-500 °, uslijed čega nastaje sumporni anhidrid:
2SO2 + O2 \u003d 2SO3
Ovaj postupak se široko koristi u proizvodnji sumporne kiseline kontaktnom metodom.
U prisustvu jakih redukcionih sredstava, kao što je sumporovodik, S (+4) se ponaša poput oksidacionog sredstva: H2SO3 + H2S → H2O + S
Pronađite, sastavljanjem elektroničke vage, koeficijente za ovu jednadžbu.
■ 87. Zapišite u bilježnicu fizička i hemijska svojstva sumpor-dioksida, bilježeći kako reakcije koje se odvijaju bez promjene oksidacijskih stanja, tako i one redoks.
88. Koji je fiziološki efekat sumpor-dioksida?
Kao što je već spomenuto, kada se sumpor-dioksid otopi u vodi, stvara se sumporna kiselina.
Sumporna kiselina je kiselina srednje jačine. Dijeli se u dvije faze:
H2SO3 ⇄ 2 H + + HSO 3 - ⇄ 2H + + SO 2 3 -
Sumporna kiselina je nestabilna, brzo se raspada u sumpor-dioksid i vodu:
H2SO3 ⇄ H2O + SO2
Zbog toga je nemoguće provesti, na primjer, reakciju s aktivnijim metalima nego sa sumpornom kiselinom.
Kao dvobazna, sumporna kiselina može formirati dvije serije soli: srednju - sulfite i kiselu - hidrosulfite. Svi sulfiti su netopive soli, osim alkalnih metala i amonijum sulfita. Hidrosulfiti su nešto viši. Ove soli mogu se razgraditi jačim kiselinama:
Na2SOs + H2S04 \u003d Na2SO4 + H2O + SO2
2NaHSO3 + H2SO \u003d Na2SO4 + 2H2O + 2SO2
Djelovanjem kiselina na sulfite nastaje sumpor-dioksid koji ima neugodan miris. Ova se reakcija koristi za razlikovanje soli sumporne kiseline od karbonata, koji se ponašaju na sličan način, ali ugljični dioksid nema miris.
Sulfiti se prilično lako hidroliziraju.
§ 59. Jedinjenja šestovalentnog sumpora
Kao što je već spomenuto, oksidacijom sumpor-dioksida nastaje sumporni anhidrid SO3, heksavalentni sumporni spoj. Kada se formira molekula sumpornog anhidrida, svi valentni elektroni sumpora učestvuju u stvaranju valentnih veza, kao s- i r-orbitale. Stanje oksidacije +6 za sumpor je maksimalno pozitivno. Stoga se S +6 nikada ne može ponašati kao restaurator.
Sumporni anhidrid je bijela kristalna supstanca. Tačka topljenja mu je 17 °, a temperatura ključanja 45 °. Sumporni anhidrid je toliko higroskopan da se ne može čuvati u običnom posuđu. Čuva se u zatvorenim staklenim ampulama.
Sumporni anhidrid je kiseli oksid koji ima sva tipična svojstva ove grupe supstanci. Konkretno, može reagirati s vodom da bi stvorio sumpornu kiselinu:
SO3 + H2O \u003d H2SO4
■ 89. Napišite vlastite jednadžbe za reakcije sumpornog anhidrida sa bazama i osnovnim oksidima.
Sumporni anhidrid je jako oksidirajuće sredstvo. Najvažniji heksavalentni spoj sumpora je H2SO4. Jedna je od jakih kiselina. dvobazičan i disocira u dvije faze:
H2SO4 ⇄ N + + HSO 4 - ⇄ 2N + + SO 2 4 -

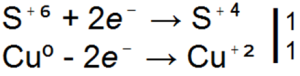
Koncentrovana sumporna kiselina reaguje sa metalima reaktivnijim od vodonika na drugačiji način od razblaženog sumpora. na primjer, ne istiskuje vodik iz koncentrirane sumporne kiseline, već reducira sumpornu kiselinu u sumporni dioksid, slobodni sumpor ili sumporovodik:
H2SO4 + Zn → ZnSO4 + SO2
H2SO4 + Zn → ZnSO4 + S
H2SO4 + Zn → ZnSO4 + H2S
■ 91. Sve tri gornje jednadžbe za reakcije sumporne kiseline sa cinkom su redoks. Postavite koeficijente u njih na osnovu elektroničke vage.
Bezvodna sumporna kiselina naziva se monohidrat. Monohidrat ne sadrži jone i stoga ne provodi električnu struju. Monohidrat dobro upija vlagu. Budući da su mnoge reakcije sumporne kiseline s metalima jonske, monohidrat ne reagira s nekim metalima koji su reaktivniji od vodonika, poput željeza, pa se može transportirati u spremnicima za željezo. , otporan na sumpornu kiselinu u bilo kojoj koncentraciji. Koncentrovana sumporna kiselina takođe oksidira neke nemetale, na primer.
■ 93. Koje su sličnosti i razlike između sumporne kiseline i drugih kiselina?
94. Mogu li se provesti reakcije u kojima bi sumporna kiselina pokazala reducirajuća svojstva?
95. Kako izvršiti sljedeće transformacije:

Zapiši jednačine odgovarajućih reakcija. Za redoks sastavite elektronsku vagu, napišite jednadžbe jonskih reakcija u jonskom obliku.
96. U jednoj boci nalazi se rastvor sumporne kiseline, u drugoj - azotna, u trećoj - klorovodična. Kako ih možete razlikovati? 21
Sumpor
SUMPOR -y; g.
1. Hemijski element (S); zapaljiva žuta supstanca (koristi se u industriji, vojnim poslovima, poljoprivredi, medicini).
2. Žuta uljna supstanca koja nastaje na zidovima slušnog kanala. Očistite uši od voska.
◁ Serny (vidi).
sumpor(lat. Sumpor), hemijski element VI grupe periodičnog sistema. Žuti kristali. Stabilan u dvije modifikacije - rombični (gustina 2,07 g / cm 3, t pl 112,8 ° C) i monoklinika (gustina 1,96 g / cm 3, t tt 119 ° C). Netopljiv je u vodi. Otporan na zrak; kada sagorijevanjem dobije SO 2, tvori sulfide s metalima. U prirodi - prirodni sumpor, sulfidi, sulfati. Sumpor se topi iz izvornih ruda; Dobijaju se i oksidacijom sumporovodika sadržanog u prirodnim, uljnim, koksovim gasovima atmosferskim kiseonikom i drugim metodama. Oko 50% sumpora koristi se za dobivanje sumporne kiseline, 25% koristi se za dobivanje sulfita (koristi se u industriji papira), ostatak se koristi za borbu protiv biljnih bolesti, vulkanizaciju, sintezu boja, proizvodnju šibica itd.
SUMPORCEPA (latinski sumpor), S, hemijski element sa atomskim brojem 16, atomska masa 32,066. Hemijski simbol S za sumpor izgovara se "es". Prirodni sumpor sastoji se od četiri stabilna nuklida (cm. NUCLID): 32 S (maseni sadržaj 95,084%), 33 S (0,74%), 34 S (4,16%) i 36 S (0,016%). Radijus atoma sumpora je 0,104 nm. Radijusi jona: jon S 2 - 0,170 nm (koordinacijski broj 6), jon S 4+ 0,051 nm (koordinacijski broj 6) i jon S 6+ 0,026 nm (koordinacijski broj 4). Sekvencijalne energije jonizacije neutralnog atoma sumpora od S 0 do S 6+ iznose 10,36, 23,35, 34,8, 47,3, 72,5 i 88,0 eV. Sumpor se nalazi u VIA grupi periodičnog sistema D. I. Mendelejeva, u 3. periodu, i pripada halkogenima. Konfiguracija vanjskog sloja elektrona 3 s 2
3str 4
... Najtipičnija stanja oksidacije u spojevima su –2, +4, +6 (valencije, II, IV i VI). Paulingova vrijednost elektronegativnosti je 2,6. Sumpor je nemetal.
Sumpor u slobodnom obliku su žuti krhki kristali ili žuti prah.
Povijesna referenca
Sumpor se u prirodi nalazi u slobodnom (izvornom) stanju, pa je čovjeku bio poznat već u davnim vremenima. Sumpor je privukao pažnju karakterističnom bojom, plavim plamenom i specifičnim mirisom koji nastaje izgaranjem (miris sumpor-dioksida). Smatralo se da sagorijevanje sumpora tjera zle duhove. Biblija govori o upotrebi sumpora za čišćenje grešnika. Čovjek srednjeg vijeka miris "sumpora" povezao je sa podzemljem. Homer je spomenuo upotrebu sumpora koji gori za dezinfekciju. U starom Rimu tkanine su bijeljene sumpor-dioksidom.
Sumpor se već dugo koristi u medicini - pacijenti su zapaljeni njegovim plamenom, on je bio uključen u razne masti za liječenje kožnih bolesti. U 11. stoljeću. Avicenna (Ibn Sina (cm. IBN SINA)), a zatim su evropski alhemičari vjerovali da se metali, uključujući zlato i srebro, sastoje od sumpora i žive u različitim omjerima. Stoga je sumpor igrao važnu ulogu u pokušajima alhemičara da pronađu "filozofski kamen" i pretvore neplemenite metale u dragocjene. U 16. vijeku. Paracelsus (cm. PARACELI) sumpor, uz živu i „sol“, smatrao je jednim od osnovnih „principa“ prirode, „dušom“ svih tijela.
Praktična važnost sumpora dramatično se povećala nakon izuma crnog praha (koji nužno uključuje sumpor). 673. godine, Bizantinci, braneći Carigrad, spalili su neprijateljsku flotu uz pomoć takozvane grčke vatre - mješavine salitre, sumpora, smole i drugih supstanci - čiji plamen vodom nije ugasio. U srednjem vijeku, crni prah se koristio u Evropi, u sastavu blizu mješavine grčke vatre. Od tada se sumpor počeo široko koristiti u vojne svrhe.
Najvažniji sumporni spoj, sumporna kiselina, odavno je poznat. Jedan od osnivača jatrohemije (cm. IATROKEMIJA), monah Vasilij Valentin, u 15. veku. detaljno opisao proizvodnju sumporne kiseline kalciniranjem željeznog sulfata (stari naziv sumporne kiseline je vitriol ulje).
Elementarnu prirodu sumpora utvrdio je 1789. A. Lavoisier (cm. LAVOISIER Antoine Laurent)... Imena hemijskih jedinjenja koja sadrže sumpor često sadrže prefiks "tio" (na primjer, reagens Na2 S 2 O 3 koji se koristi u fotografiji naziva se natrijum tiosulfat). Porijeklo ovog prefiksa povezano je s grčkim nazivom sumpora - theion.
Biti u prirodi
Sumpor je prilično raširen u prirodi. Sadržaj zemljine kore procjenjuje se na 0,05 težinskih%. Značajne naslage prirodnog sumpora često se nalaze u prirodi (obično u blizini vulkana); u Evropi se nalaze na jugu Italije, na Siciliji. Velike naslage prirodnog sumpora nalaze se u Sjedinjenim Državama (u državama Louisiana i Texas), kao i u centralnoj Aziji, Japanu i Meksiku. U prirodi se sumpor nalazi i u placerima i u obliku kristalnih slojeva, koji ponekad čine zapanjujuće lijepe skupine prozirnih žutih kristala (tzv. Druzi).
U vulkanskim područjima često se opaža ispuštanje vodonik-sulfidnog gasa H 2 S iz zemlje; u istim regijama, sumporovodik se nalazi u otopljenom obliku u sumpornim vodama. Vulkanski plinovi često sadrže i sumpor-dioksid SO 2.
Ležišta različitih sulfidnih jedinjenja raširena su na površini naše planete. Među njima su najčešći: gvozdeni pirit (pirit (cm. PYRITE)) FeS 2, bakarni pirit (halkopirit) CuFeS 2, olovni sjaj (cm. GALENA) PbS, cinobar (cm. CINNABAR) HgS, sfalerit (cm. SPHALERITE) ZnS i njegova kristalna modifikacija wurtzite (cm. WURTZIT), antimonit (cm. ANTIMONIT) Sb 2 S 3 i drugi. Postoje i brojne naslage različitih sulfata, na primjer, kalcijum sulfata (gips CaSO 4 2H 2 O i anhidrit CaSO 4), magnezijum sulfata MgSO 4 (gorka sol), barijevog sulfata BaSO 4 (barit), stroncijum sulfata SrSO 4 (celestina), natrijum sulfat Na 2 SO 4 · 10H 2 O (mirabilit) itd.
Bitumenski ugljen sadrži u prosjeku 1,0-1,5% sumpora. Sumpor takođe može biti dio nafte. Brojne naslage prirodnog zapaljivog plina (na primjer, Astrakhanskoye) sadrže sumporovodik kao nečistoću.
Sumpor pripada elementima neophodnim za žive organizme, jer je bitna komponenta proteina. Proteini sadrže 0,8-2,4% (težinski) hemijski vezanog sumpora. Biljke dobivaju sumpor iz sulfata u tlu. Neugodni mirisi koji proizlaze iz truljenja životinjskih leševa uglavnom se objašnjavaju oslobađanjem sumpornih jedinjenja (sumporovodika i merkaptana (cm. TIJOLOVI)) nastali tokom razgradnje proteina. U morskoj vodi ima oko 8,7 · 10 -2% sumpora.
Prijem
Sumpor se uglavnom dobija topljenjem iz kamenja koje sadrže prirodni (elementarni) sumpor. Takozvana geotehnološka metoda omogućava vam dobivanje sumpora bez podizanja rude na površinu. Ova metoda predložena je krajem 19. vijeka. američkog kemičara G. Frasha, koji je bio suočen sa zadatkom vađenja sumpora iz naslaga juga Sjedinjenih Država na površinu zemlje, gdje je pjeskovito tlo naglo zakompliciralo njegovo vađenje tradicionalnom rudničkom metodom.
Frasch je predložio upotrebu pregrejane vodene pare za podizanje sumpora na površinu. Pregrijana para dovodi se kroz cijev u podzemni sloj koji sadrži sumpor. Sumpor se topi (njegova temperatura topljenja je nešto ispod 120 ° C) i podiže se prema gore kroz cijev koja se nalazi unutar one kroz koju se vodena para pumpa pod zemljom. Kako bi se osigurao porast tečnog sumpora, komprimirani zrak se ubrizgava kroz najtanju unutrašnju cijev.
Prema drugoj (termičkoj) metodi, koja je postala posebno raširena početkom 20. vijeka. na Siciliji se sumpor topi ili sublimira iz drobljenog kamena u posebnim glinenim pećima.
Postoje i druge metode ekstrakcije prirodnog sumpora iz stijene, na primjer, metode ekstrakcije ugljičnog disulfida ili flotacije.
Zbog činjenice da je industrijska potražnja za sumporom vrlo velika, razvijene su metode za njegovu proizvodnju od sumporovodika H 2 S i sulfata.
Metoda oksidacije vodonik-sulfida u elementarni sumpor prvi je put razvijena u Velikoj Britaniji, gdje su naučili dobijati značajne količine sumpora iz Na 2 CO 3 preostale nakon dobivanja sode metodom francuskog kemičara N. Leblanca (cm. LEBLANN Nicola) kalcijum sulfid CaS. Leblancova metoda zasniva se na redukciji natrijum sulfata ugljem u prisustvu krečnjaka CaCO 3.
Na 2 SO 4 + 2C \u003d Na 2 S + 2CO 2;
Na 2 S + CaCO 3 \u003d Na 2 CO 3 + CaS.
Soda se zatim ispere vodom, a vodena suspenzija slabo rastvorljivog kalcijum sulfida tretira se ugljen dioksidom:
CaS + CO 2 + H 2 O \u003d CaCO 3 + H 2 S
Rezultirajući sumporovodik H2S u smjesi sa zrakom prelazi u peć preko sloja katalizatora. U ovom slučaju, zbog nepotpune oksidacije vodonik-sulfida nastaje sumpor:
2H 2 S + O 2 \u003d 2H 2 O + 2S
Slična metoda se koristi za dobivanje elementarnog sumpora i sumporovodika koji prate prirodne gasove.
Budući da moderna tehnologija zahtijeva sumpor visoke čistoće, razvijen je efikasne metode rafiniranje sumpora. U ovom slučaju se posebno koriste razlike u hemijskom ponašanju sumpora i nečistoća. Dakle, arsen i selen se uklanjaju tretiranjem sumpora smešom azotne i sumporne kiseline.
Primjenom metoda koje se temelje na destilaciji i rektifikaciji moguće je dobiti sumpor visoke čistoće sa sadržajem nečistoća od 10 –5 –10 –6 težinskih%.
Fizička i hemijska svojstva
Atomi sumpora imaju jedinstvenu sposobnost stvaranja stabilnih homo lanaca, to jest lanaca koji se sastoje samo od S atoma (energija veze S - S je oko 260 kJ / mol). Sumporni homolanci imaju cik-cak oblik, jer elektroni smješteni u susjednim atomima na međusobno okomitim p-orbitalama sudjeluju u njihovoj tvorbi. Ovi lanci mogu doseći veliku dužinu ili, obratno, oblikovati zatvorene prstenove S 20, S 8, S 6, S 4.
Stoga sumpor formira nekoliko desetina kristalnih i amorfnih modifikacija, razlikujući se i po sastavu molekula i polimernih lanaca i po načinu pakovanja u čvrstom stanju.
Pri normalnom pritisku i temperaturama do 98,38 ° C, a-modifikacija sumpora je stabilna (inače se ta modifikacija naziva rombična), koja stvara limunožute kristale. Njegova kristalna rešetka je ortorombična, parametri jediničnih ćelija su a \u003d 1,04646, b \u003d 1,2660, c \u003d 2,4486 nm. Gustoća 2,07 kg / dm 3. Iznad 95,39 ° C, b-modifikacija sumpora (takozvani monoklinični sumpor) je stabilna. Na sobnoj temperaturi, parametri jedinične ćelije monoklinike b-S su a \u003d 1,090, b \u003d 1,096, c \u003d 1,102 nm, t \u003d 83,27 ° C. Gustoća b-S 1,96 kg / dm 3.
Strukture a- i b-modifikacija sumpora sadrže neravne osmočlane cikličke molekule S8. Takvi molekuli su pomalo poput krunica.
Ove dvije modifikacije sumpora razlikuju se u međusobnoj orijentaciji molekula S8 u kristalnoj rešetki.
Druga modifikacija sumpora - takozvani romboedrični sumpor - može se dobiti prelivanjem rastvora natrijum-tiosulfata Na 2 S 2 O 3 u koncentrovanu hlorovodoničnu kiselinu na 0 ° C, nakon čega sledi ekstrakcija sumpora toluenom (cm. TOLUENE)... Nakon isparavanja otapala nastaju romboedrični kristali koji sadrže molekule S6 u obliku stolice.
Amorfni sumpor (gustina 1,92 g / cm 3) i plastični sumpor nalik gumi dobijaju se oštrim hlađenjem rastopljenog sumpora (izlivanjem rastopine u hladnu vodu). Ove modifikacije sastoje se od nepravilnih cik-cak lanaca S n. S produženim izlaganjem na temperaturama od 20-95 ° C, sve modifikacije sumpora pretvaraju se u a-sumpor.
Tačka topljenja rombičnog a-sumpora je 112,8 ° C, a monoklinskog b-sumpora 119,3 ° C. U oba slučaja nastaje lako pokretna žuta tečnost koja potamni na temperaturi od oko 160 ° C; njegova viskoznost raste, a na temperaturama iznad 200 ° C, rastopljeni sumpor postaje tamno smeđi i viskozan, poput smole. To se objašnjava činjenicom da se prvo molekuli prstena S8 uništavaju u talini. Rezultirajući fragmenti međusobno se kombiniraju i tvore duge Sµ lance od nekoliko stotina hiljada atoma. Dalje zagrevanje rastopljenog sumpora (iznad 250 ° C) dovodi do delimičnog pucanja lanaca i tečnost ponovo postaje pokretnija. Na sl. prikazana je temperaturna zavisnost viskoznosti tečnog sumpora. Oko 190 ° C, njegova viskoznost je oko 9000 puta veća od visine od 160 ° C.
Rastopljeni sumpor vrije na 444,6 ° C. Ovisno o temperaturi, u njegovim parama mogu se naći molekuli S 8, S 6, S 4 i S 2. Promjena u sastavu molekula uzrokuje promjenu boje sumporne pare iz narandžasto-žute u slamnato-žutu. Na temperaturama iznad 1500 ° C, molekuli S2 se disociraju na atome.
Molekuli S2 su paramagnetski (cm. PARAMAGNETSKI) i građeni su slično molekulu O2. U svim ostalim državama sumpor je dijamagnetski (cm. DIJAMAGNETSKI).
Sumpor je praktično nerastvorljiv u vodi. Neke od njegovih modifikacija rastvaraju se u organskim tečnostima (toluen, benzen), a posebno dobro u disulfidu ugljenika CS 2 i tečnom amonijaku NH 3.
Sumpor je prilično aktivan nemetal. Čak i uz umjereno zagrijavanje oksidira mnoge jednostavne tvari, ali i sam se prilično lako oksidira kisikom i halogenima.
S + O 2 \u003d SO 2, S + 3F 2 \u003d SF 6,
2S + Cl 2 \u003d S 2 Cl 2 (dopirano sa SCl 2)
Sa vodonikom, kada se zagrije, sumpor stvara sumporovodik H 2 S, a u maloj količini sulfani (spojevi sastava H 2 S n):
H 2 + S H 2 S.
Primjeri reakcija sumpora s metalima:
2Na + S \u003d Na2S, Ca + S \u003d CaS, Fe + S \u003d FeS
Sulfidi nastali u tim reakcijama nisu karakterizirani konstantom, već, po pravilu, promjenjivim sastavom. Dakle, sastav kalcijevog sulfida može se kontinuirano mijenjati u rasponu od CaS do CaS 5. Polisulfidi tipa CaS n ili Na 2 S n nakon interakcije, na primjer sa klorovodičnom kiselinom, formiraju sulfane H 2 S n , a vrijednost n može se kretati od 1 do oko 10.
Kada se zagrije, koncentrovana sumporna kiselina oksidira sumpor u SO 2:
S + 2H 2 SO 4 \u003d 2H 2 O + 3SO 2.
Vodka Tsarskaya (mješavina azotne i solne kiseline) oksidira sumpor u sumpornu kiselinu.
Razblažena azotna kiselina, hlorovodonična kiselina bez oksidirajućih sredstava i sumporna kiselina ne stupaju u interakciju sa sumporom na hladnoći. Pri zagrijavanju u kipućoj vodi ili lužnatim rastvorima sumpor disproporcionalno:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Sumpor može dodati sulfidima
Na 2 S + (n - 1) S \u003d Na 2 S n
i na sulfite:
Na 2 SO 3 + S \u003d Na 2 S 2 O 3
Kao rezultat ove reakcije, natrijum tiosulfat Na2S2O3 nastaje od natrijum sulfita Na2S03.
Pri zagrijavanju sumpor reagira sa gotovo svim elementima, osim s inertnim plinovima, jodom, azotom, platinom i zlatom.
Poznato je nekoliko sumpornih oksida. Pored postojanog sumpor-dioksida SO 2 [drugi nazivi: sumpor-dioksid, sumporni anhidrid, dobijeni su sumporni oksid (IV)] i sumporni trioksid SO 3 [drugi nazivi: sumporni gas, sumporni anhidrid, sumporni (VI) oksid], nestabilni oksidi S 2 O (propuštanjem struje SO 2 kroz užareni prazan) i S 8 O ( u interakciji H2S sa SOCl2). Peroksidi SO4 i S2O7 nastaju propuštanjem SO2 u smjesi s kisikom kroz užareni pražnjenje ili oksidacijom SO2 s ozonom.
Kiseli sumpor-dioksid SO 2 odgovara nestabilnoj kiselini srednje jačine H 2 SO 3 (sumporna kiselina):
H 2 O + SO 2 H 2 SO 3,
i kiseli sumporni trioksid SO 3 - jaka dvobazna sumporna kiselina (cm. SUMPORNA KISELINA) H 2 SO 4:
SO 3 + H 2 O \u003d H 2 SO 4
Sumporna kiselina H 2 SO 3 i sumporna H 2 SO 4 odgovaraju dva reda soli: kisele [hidrosulfiti NaHSO 3, Ca (HSO 3) 2, itd., I hidrosulfati KHSO 4, NaHSO 4 i druge, respektivno] i srednje [sulfiti Na 2 SO 3, K 2 SO 3 i sulfati CaSO 4, Fe 2 (SO 4) 3].
Sumpor je dio mnogih organskih spojeva (vidi članke Thiophene (cm. THIOPHENE), Thiola (cm. TIJOLOVI) ostalo).
Primjena
Otprilike polovina proizvedenog sumpora koristi se za proizvodnju sumporne kiseline, oko 25% se troši za proizvodnju sulfita, 10-15% za suzbijanje štetočina poljoprivrednih kultura (uglavnom grožđa i pamuka) (ovdje je najvažniji rastvor bakar sulfata CuSO 4 5H 2 O ), oko 10% industrija gume koristi za vulkanizaciju gume. Sumpor se koristi u proizvodnji boja i pigmenata, eksploziva (još uvijek je dio baruta), umjetnih vlakana, luminofora (cm. LUMINOFORI)... Sumpor se koristi u proizvodnji šibica, jer je dio sastava od kojeg se izrađuju glavice šibica. Neke masti za liječenje kožnih bolesti još uvijek sadrže sumpor. Da bi se čelikima dodala posebna svojstva, u njih se unose mali dodaci sumpora (iako je, po pravilu, nečistoća sumpora u čeliku nepoželjna).
Biološka uloga
Sumpor je stalno prisutan u svim živim organizmima, kao važan biogeni element (cm. BIOGENI ELEMENTI)... Sadržaj biljaka je 0,3-1,2%, životinja 0,5-2% ( morski organizmi sadrže više sumporanego zemaljski). Biološki značaj sumpora određuje se prvenstveno činjenicom da je on dio aminokiselina metionin (cm. METIONIN) i cistein (cm. CISTEIN) i, prema tome, u sastavu peptida (cm. PEPTIDI) i proteini. Disulfidne veze –S - S– u polipeptidnim lancima sudjeluju u stvaranju prostorne strukture proteina, a sulfhidrilne skupine (–SH) igraju važnu ulogu u aktivnim centrima enzima. Pored toga, sumpor je uključen u molekule hormona, važne supstance... Mnogo sumpora nalazi se u keratinu kose, kostiju i nervnog tkiva. Anorganski spojevi sumpora su neophodni za mineralnu ishranu biljaka. Oni služe kao supstrat za oksidativne reakcije koje provode prirodne sumporne bakterije (cm. SEROBACTERIA).
Telo prosječne osobe (tjelesna težina 70 kg) sadrži oko 1402 g sumpora. Dnevna potreba odrasle osobe za sumporom je oko 4.
Međutim, u smislu njegovog negativnog uticaja na okoliš a ljudski sumpor (tačnije, njegovi spojevi) je na jednom od prvih mjesta. Glavni izvor zagađenja sumporom je sagorijevanje uglja i drugih goriva koja sadrže sumpor. Istovremeno, oko 96% sumpora koji se nalazi u gorivu ulazi u atmosferu u obliku sumpor-dioksida SO 2.
U atmosferi sumpor-dioksid postepeno oksidira u sumpor-oksid (VI). Oba oksida - sumporni (IV) oksid i sumporni (VI) oksid - u interakciji sa vodenom parom formirajući kiseli rastvor. Tada ove otopine ispadaju u obliku kiselih kiša. Jednom u tlu, kisele vode inhibiraju razvoj faune tla i biljaka. Kao rezultat, stvaraju se nepovoljni uslovi za razvoj vegetacije, posebno u sjevernim regionima, gdje se hemijsko zagađenje dodaje oštroj klimi. Kao rezultat, šume umiru, travnati pokrivač je poremećen, a stanje vodnih tijela pogoršava se. Kisele kiše uništavaju spomenike od mramora i drugih materijala, štoviše, čak uzrokuju uništavanje kamenih zgrada i metalnih proizvoda. Zbog toga je potrebno preduzeti razne mjere kako bi se spriječio ulazak sumpornih jedinjenja iz goriva u atmosferu. Da bi se to postiglo, ulje i naftni proizvodi se pročišćavaju od sumpornih spojeva, a plinovi nastali tijekom sagorijevanja goriva.
Sam po sebi sumpor u obliku prašine iritira sluznicu, respiratorne organe i može izazvati ozbiljna bolest... Maksimalna granična koncentracija sumpora u zraku je 0,07 mg / m 3.
Žensko jedna od jednostavnih (nekompliciranih, nerazgradivih) tvari, topljivi i lako zapaljivi fosil vulkanskog porijekla; kao roba, njeno ime je: zapaljivi sumpor. Barut se pravi od šalitre i sumpora, sa ugljem. Rezanje sumpora izliveno štapićima. |. | Sumpor, sivi ... Rječnik Dahl
SUMPOR - SUMPOR, Sumpor, hem. element VІ gr. Mendeljejev sistem, simbol S, serijski broj 16, na. u. 32.07. Poznat je od davnina. U prirodi se javlja u obliku naslaga vode (neptunske) i vulkanske. porijeklo. Takođe se nalazi u ... Velika medicinska enciklopedija
SUMPOR - hem. element, simbol S (latinski sumpor), at. n. 16, at m. 32.06. Postoji nekoliko alotropskih modifikacija; Među njima su sumpor monokliničke modifikacije (gustina 1960 kg / m3, tm \u003d 119 ° C) i rombični sumpor (gustina 2070 kg / m3, ίπι \u003d 112,8 ... ... Velika politehnička enciklopedija
- (označeno sa S), hemijski element VI grupe PERIODIČNE TABLICE, nemetal, poznat još od antike. Javlja se u prirodi kao u obliku pojedinačni elementi u obliku sulfidnih minerala kao što su GALENIT i PIRIT, te sulfatnih minerala, ... ... Naučno-tehnički enciklopedijski rječnik
U mitologiji irskih Kelta, Sera je otac Partalona (vidi poglavlje 6). Prema nekim izvorima, Dilgnaidov suprug bio je Sera, a ne Partalon. (
