Suva solna kiselina. Soli solne kiseline
Vodik. Tehnička kiselina ima žućkasto-zelenu boju zbog klora i soli gvožđa. Maksimalna koncentracija Hlorovodonična kiselina oko 36%; takvo rješenje ima gustinu od 1,18 g / cm 3, "puši" se u zraku, jer evoluirani H stvara vodene pare sićušne kapljice.
Hlorovodonična kiselina bio poznat alhemičarima krajem 16. vijeka, koji su ga dobivali zagrijavanjem kuhinjske soli glinom ili željeznim vitriolom. Pod imenom "klorovodični alkohol" sredinom 17. vijeka. opisao je I.R. Glauber ko se pripremao Hlorovodonična kiselina interakcija s H 2 4. Glauberova metoda se koristi i danas.
Hlorovodonična kiselina je jedna od najjačih kiselina. Rastvara se (oslobađanjem H2 i stvaranjem soli - hloridi ) svi metali u stresu se kreću do vodonika. Kloridi se takođe stvaraju interakcijom Hlorovodonična kiselina sa oksidima i hidroksidima metala. Sa jakim oksidansima Hlorovodonična kiselina ponaša se kao redukcijsko sredstvo, na primjer: O 2 + 4H = Mn 2 + 2 + 2H 2 O.
Proizvodnja Hlorovodonična kiselina u industriji uključuje dvije faze: dobivanje H i njegova apsorpcija vodom. Glavna metoda za proizvodnju H je sinteza iz 2 i H 2. Velike količine H nastaju kao nusprodukt hlorisanja organskih spojeva: RH + 2 = RCI + H, gdje je R organski radikal.
Proizvedeno tehničko Hlorovodonična kiselina ima čvrstoću od najmanje 31% H (sintetičko) i 27,5% H (od Na). Trgovačka kiselina naziva se razrijeđena ako sadrži, na primjer, 12,2% H; pri udjelu od 24% ili više H naziva se koncentriranim. U laboratorijskoj praksi 2n. H (7%, gustina 1,035) obično se naziva razrijeđenim Hlorovodonična kiselina
Hlorovodonična kiselina - najvažniji proizvod hemijske industrije. Koristi se za dobijanje hlorida različitih metala i za sintezu organskih proizvoda koji sadrže hlor. Hlorovodonična kiselina Koriste se za nagrizanje metala, za čišćenje različitih posuda, kućišta bušotina od bušotina od karbonata, oksida i drugih sedimenata i zagađivača. U metalurgiji se njime prerađuju rude, u kožarskoj industriji - koža prije štavljenja. Hlorovodonična kiselina - važan reagens u laboratorijskoj praksi. Transport Hlorovodonična kiselina u staklenim bocama ili gumiranim (prekrivenim slojem gume) metalnim posudama.
H plin je toksičan. Dugotrajno izlaganje H izaziva katar respiratornog trakta, propadanje zuba, ulceraciju nosne sluznice i gastrointestinalne tegobe. Dozvoljeni sadržaj H u zraku radnih prostorija ne veći od 0,005 mg / l.Zaštita: gas maska, naočale, gumene rukavice, cipele, pregača.
I.K.Malina.
Hlorovodonična kiselina sadržan u želučanom soku (oko 0,3%); pospješuje probavu i ubija bakterije koje uzrokuju bolesti.
AT medicinska praksa razvedena Hlorovodonična kiselina koristi se u kapima i smjesama u kombinaciji sa pepsin kod bolesti praćenih nedovoljnom kiselošću želučanog soka (na primjer, gastritis) i hipohromna anemija (zajedno sa preparatima gvožđa za poboljšanje apsorpcije).
Članak o riječi " Hlorovodonična kiselina"u Velikoj sovjetskoj enciklopediji je pročitano 12940 puta
Lekcija br.
Tema: Hlorovodonična kiselina
Ciljevi:
Edukativni - u procesu istraživanja, za proučavanje hemijskih svojstava klorovodične kiseline i upoznavanje s kvalitativnom reakcijom na hloridni jon.
Razvijanje - razvijanje daljnjih vještina za sastavljanje jednadžbi hemijskih reakcija; naučiti upoređivati, generalizirati, analizirati i donositi zaključke.
Obrazovni - razvijati kognitivne aktivnosti kroz eksperiment.
Oprema: Prezentacija
Tokom nastave
Organizaciona faza
Dobar dan, dragi momci!
21. vijek se s pravom naziva „dobom hemije“, „vijekom novih tehnologija“. A jedna od karakteristika koja razlikuje modernu obrazovanu osobu je njen kemijski kompetentan odnos prema sebi, svom zdravlju i okolini. Kemijski se možete opismeniti samo proučavanjem, poznavanjem svijeta oko sebe i većinom efikasan način spoznaja je istraživanje. I danas ćete na lekciji ponovo postati naučnici - istraživači, zaposlenici naučnog laboratorija i svako od vas će otvoriti malo, ali neovisno otkriće koje će vam omogućiti da dublje prodrete u tajne velike hemijske nauke.
2. Motivacija znanja
U današnjoj ćemo lekciji govoriti o supstanci koja je nezamjenjiva ne samo u mnogim industrijama, već ima i veliku ulogu u ljudskom tijelu. Nažalost, gotovo niko ne zna koliko je presudan normalan sadržaj ove supstance u želucu. Kada tijelo ne može proizvesti potrebnu količinu želučanog soka, javlja se stanje niske kiselosti, koje se naziva hipokiselina. Niska kiselost neizbježno štetno djeluje na probavu i ometa apsorpciju hranjivih sastojaka potrebnih za zdravlje.
Ova supstanca je jedina kiselina koju proizvodi naše tijelo. Sve ostale kiseline su nusprodukti metabolizma i moraju se što prije eliminirati iz tijela. O kojoj kiselini govorimo? Dječji odgovori. (Nastavnik zajedno sa učenicima čini temu lekcije)
3 ciljanje
Pogledajte temu lekcije, razmislite i zajedno formulirajmo ciljeve naše lekcije koja pitanja trebamo proučiti danas. Dakle,
Istražiti istorija, metode proizvodnje i fizička svojstva solne kiseline
Istražiti hemijska svojstva hlorovodonične kiseline
Vježbati vještine sastavljanja jednadžbi hemijskih reakcija
4. Ažuriranje znanja
Šta mislite da hlorovodonik i hlorovodonična kiselina je li ovo jedna supstanca? Ako da, zašto? (Odgovori učenika). Zašto onda postoje dva imena? Iz kog razloga. Tačan odgovor dobit ćemo gledajući iskustvo „Rastvaranje hlorovodonik"(Video)
Nakon uvida u iskustva Pitanja: Koji ste odgovor dobili? Tačna solna kiselina - rastvor hlorovodonik.
Reci mi šta su kiseline.
Koja su opšta hemijska svojstva kiselina (odgovori učenika)
5 .Učenje novog materijala
1. Povijest otkrića solne kiseline
T teško je reći ko je i kada prvi put primio solnu kiselinu. U svakom slučaju, to znamo već krajem 15. vijeka. alhemičar Vasilij Valentin i u XVI vijeku. Andreas Libavius, u marljivoj potrazi za čudesnim životnim eliksirom, kalcinirao je kuhinjsku sol sa stipsom i vitriolom u njihovim neobičnim za nas alhemijskim uređajima i dobio proizvod koji je opisan kao "kiseli alkohol". To je bila sada poznata solna kiselina, naravno, vrlo nečista.
Za prve istraživače bila je to potpuno nova supstanca sa svojstvima koja su jako zadivila njihovu maštu. Njuškajući, dahtali su i kašljali, "kiseli alkohol" pušio se u zraku. Kad se okusio, sagorijevao je jezik i nepce, nagrizao metale, uništavao tkiva.
1658. godine njemački kemičar J.R. Glauber (1604.-1670.) Pronašao je novu metodu za proizvodnju solne kiseline, koju je nazvao "klorovodični alkohol". Ova metoda se i dalje široko koristi u laboratorijama. Zagrijavao je kuhinjsku sol koncentriranom sumpornom kiselinom i apsorbirao ispušteni "dim" vodom.
Godine 1772. engleski kemičar J. Priestley (1733. - 1804.) ustanovio je da kada sumporna kiselina djeluje na kuhinjsku sol, oslobađa se bezbojni plin koji se može sakupljati preko žive i da taj plin ima izuzetno visoku sposobnost otapanja u vodi. Vodena otopina ovog plina nazvana je "solna kiselina" (acidum muriaticum), a Priestley je taj plin nazvao "čistom plinovitom solnom kiselinom".
2.Proizvodnja solne kiseline
Video: dobijanje hlorovodonične kiseline.
Ovaj način dobivanja predložio je u 17. stoljeću njemački kemičar Johann Glauber, a u Rusiji se koristio gotovo do sredine 20. vijeka. Sada se ova metoda koristi za laboratorijsku proizvodnju hlorovodonika.
Jedan od učenika odlazi do ploče i zapisuje jednadžbu reakcije.
NaCl (čvrsta supstanca) + H2SO4 (konc.) \u003d HCl + NaHSO4
3. Fizička svojstva klorovodične kiseline
Hlorovodonična kiselina je bezbojna otopina, koja se jako dimi u zraku, oštrog mirisa zbog oslobađanja hlorovodonika. Maksimalna koncentracija HCl - 37%, takva otopina ima gustinu od 1, 18 g / cm3, kiselina se naziva razrijeđena ako sadrži 12% ili manje HCl. U laboratoriju se obično koristi 7% HCl, njena gustoća je 1,035 g / cm3. Jaka je kiselina, zato se pri radu s kiselinama mora poštovati TB Visoko koncentrirana solna kiselina -kaustična supstanca , u dodiru s kožom izaziva jake kemikalije ... Kontakt sa očima je posebno opasan. Obično se za neutraliziranje opeklina koristi otopina slabe lužine .
Pri otvaranju posuda s koncentriranom solnom kiselinom, ispariti privlačeći vlagu u zraku, stvaraju maglu koja iritira oči i airways osoba. Hlorovodonična kiselina je bezbojna, nagrizajuća tečnost koja "puši" u zraku. Snažan je elektrolit i u vodenoj otopini potpuno disocira na jone klora i vodonika:
HCl⇄ H (+) + Cl (-).
Definirajmo tip veze.
Zapamtite vrste veza.
Hemijska veza između atoma klora i vodonika u molekuli HCl je kovalentna polarna veza.
4.Kemijska svojstva kiseline
Prije nego što započnemo s proučavanjem hemijskih svojstava klorovodične kiseline, ponovimo pravila T.B.
Ponavljanje sa treningom, TB pri radu sa kiselinama.
Kiseline mogu izazvati opekotine ako dođu u kontakt s kožom. Ozbiljnost hemijsko opekotine ovisi o snazi \u200b\u200bi koncentraciji kiseline. Kada koristite bočicu kiseline, pripazite da svaka bočica ima jasan naziv za kiselinu. Kiselinu je potrebno sipati tako da pri naginjanju boca naljepnica bude na vrhu, kako bi se izbjegla oštećenja. Kiselina se mora pažljivo sipati, ne dopustiti da kiselina dođe na kožu, stvari, pod.
Prva pomoć . Zahvaćeno područje kože pere se jako kliznim mlazom hladne vode 10-15 minuta. nakon ispiranja na opečeno mjesto nanosi se zavoj od gaze ili pamučni tampon natopljen vodenom 2% otopinom sode bikarbone. Za 10 minuta. ukloni se oblog, opere koža, pažljivo ukloni vlaga filter-papirom ili mekom krpom i premazan glicerinom kako bi se smanjio bol.
Sjetimo se opštih svojstava kiselina (odgovori trenera)
Studenti u grupama proučavaju hemijske osobine klorovodične kiseline. Svaka grupa dobija karticu s uputama.
Na svojim stolovima imate kartice s uputama, opremu i reagense. Pažljivo čitajući upute, izvodite eksperimente, poštujući sigurnosna pravila.
Hemijska svojstva kiseline
Koja hemijska svojstva bi po vašem mišljenju trebala imati solna kiselina? Studenti formulišu hipoteza.
Primjeri odgovora:
Ako NS l je kiselina, tada mora imati svojstva svih kiselina.
Svojstva HCl slična su svojstvima kiselina. Šta je zajedničko sa klorovodičnom kiselinom i ostalim kiselinama? (Prisustvo jona H + koji određuje svojstva kiseline)
Iskustvo 1. Promjena boje indikatora.
U 3 epruvete ulijte 2-3 kapi rastvora solne kiseline.
Dodajte 1 kap metil narandže, fenolftaleina i lakmusa u rastvor solne kiseline.
Koje se promjene dešavaju?
Zaključci:
Iskustvo 2. Interakcija klorovodične kiseline sa metalima.
Koje se promjene dešavaju?
Napišite jednadžbu reakcije.
Izlaz: HCl komunicira s metalima u opsegu aktivnosti do (istiskuju vodonik iz kiselina)
Mg + 2HCl \u003d MgCl2 + H2,
Iskustvo br. 3 Interakcija s oksidima.
Stavite malu količinu kalcijum-oksida u epruvetu.
Dobivenoj otopini kap po kap dodajte otopinu klorovodične kiseline i sastavite jednadžbu reakcije.
Izlaz:
Iskustvo 3. Interakcija klorovodične kiseline sa bazama.
4.1. Interakcija solne kiseline s topljivim bazama.
Koje se promjene dešavaju?
Dobivenu otopinu kap po kap dodajte otopinu solne kiseline dok boja ne nestane. Kako se naziva reakcija kiseline i lužine
Napišite jednadžbu reakcije.
Izlaz:Kiseline s bazama ulaze u reakciju neutralizacije
HCl + NaOH \u003d NaCl + H2O
Napišite jednadžbu reakcije
Šta je zajedničko sa klorovodičnom kiselinom i ostalim kiselinama? (Prisustvo jona H + koji određuje svojstva kiseline)
Ima li HCl svojstva koja su karakteristična samo za njega i njegove soli?
Da, postoji takva imovina. Ovo je kvalitativna reakcija na kloridni jon.
Interakcija sa solima
Iskustvo 5. Kvalitativna reakcija na kloridni jon.
Stavite 2-3 kapi otopine hlorovodonične kiseline i otopine kalijum hlorida u dva jažice ploče za analizu kapi.
U svaku ćeliju dodajte 2-3 kapi rastvora srebrovog nitrata.
Koje se promjene dešavaju?
Napišite molekulske i jezgrovite jednadžbe jonske reakcije.
Izlaz: Interakcija sa srebrnim nitratom specifično je svojstvo klorovodične kiseline i njenih soli.
Kvalitativne reakcije omogućavaju otkrivanje jednog ili drugog jona, hemikalije ili funkcionalne grupe
5. Sistematizacija znanja
A - 2,44 i 1,258, hlor
B - 3,44 i 2,258, hlor
G - 4 i 2, hlorovodonik
6.Reflection
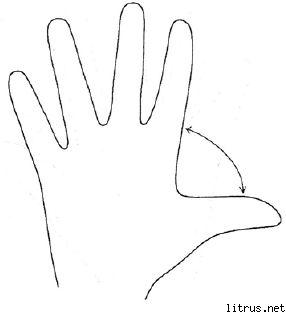
Metoda s pet prstiju.
M
B
OD (srednje) - stanje duha.
Imati
B
7.D / Z
Ime i prezime i _________________________________________________________________________
Hlorovodonična kiselina____________________________________________________________________________________________________________________________________________________________________
Istorija otkrića
Vasilij Valentin i Andreas Libavij ________________________________________________________________________________________________________________________________________________________________
Johann Rudolf Glauber __________________________________________________________________________________________________________________________________________________________________________________
J. Priestley ______________________________________________________________________________________________________________________________________________________________Dobivanje solne kiseline
__________________________________________________________________________________________________________________________________
Fizička svojstva kiseline
_____________________________________________________________________________________________________________________________________________
Hemijska svojstva kiseline
Akcija na indikatore
1. U 3 epruvete ulijte 2-3 kapi rastvora klorovodične kiseline.
U prvu epruvetu dodajte 1 kap metil narandže, u drugu epruvetu 1 kap fenolftaleina i u treću epruvetu 1 kap lakmusa. Koje se promjene dešavaju?
Pokazatelj
Boja u otopini kiseline
Metil narandža
Fenolftalein
Lakmus
Zaključci:
2. Interakcija solne kiseline sa metalima.
Stavite granulu cinka u epruvetu # 1, a bakrene strugotine u epruvetu # 2.
U svaku epruvetu ulijte 1-2 ml otopine solne kiseline.
Koje se promjene događaju? ___________________________________________
Napišite jednadžbu reakcije
______________________________________________________________________________________________________________________________________________________________________________________________________
Zaključci:
Interakcija s oksidima
U epruvetu ulijte kašiku kalcijum-oksida.
Dodajte 1 ml otopine klorovodične kiseline u epruvetu
Primijetite rastvaranje taloga.
Napišite jednadžbe reakcija
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Zaključci:
4. Interakcija klorovodične kiseline s bazama.
Interakcija solne kiseline s topljivim bazama.
Stavite 2-3 kapi rastvora natrijum hidroksida u epruvetu.
U ovu otopinu dodajte 1 kap fenolftaleina
Koje se promjene događaju? __________________________________________
Dobivenu otopinu kap po kap dodajte otopinu solne kiseline dok boja ne nestane. Kako se zove reakcija kiseline i lužine __________________________
Napišite jednadžbu reakcije.
____________________________________________________________________________________________________________________________________________________________________
Izlaz:
Interakcija klorovodične kiseline s nerastvorljivim bazama
Interakcija solne kiseline sa solima.
1. Ulijte kašiku natrijum karbonata u epruvetu.
2. Dodajte 1 ml otopine klorovodične kiseline u epruvetu
3. Koje se promjene dešavaju? __________________________________________
4. Napišite jednadžbe reakcija
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Zaključci:
Kvalitativna reakcija na kloridni jon.
Uzmite dvije epruvete. U jedan ulijte 1 ml otopine hlorovodonične kiseline. U drugu dodajte 1 ml otopine barijevog klorida.
U svaku epruvetu dodajte 2-3 kapi rastvora srebrovog nitrata.
Koje se promjene dešavaju?
Napišite jednadžbe reakcija.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Izlaz:
Kvalitativna reakcija ____________________________________________________________________________________________________________________________________________________________________________________
Tačne izjave su
Hlorovodonična kiselina:
Mijenja boju indikatora
Interakcija sa
Rastvorljive baze
Netopive baze
Kiseli oksidi
Osnovni oksidi
Soli slabijih kiselina
Soli jačih kiselina
Metali koji stoje do H
Metali nakon H
Izračunajte relativnu gustinu klora i hlorovodonika u vazduhu. Koji je plin teži?
A - 2,44 i 1,258, hlor
B - 3,44 i 2,258, hlor
B - 1,258 i 2,44, hlorovodonik
G - 4 i 2, hlorovodonik
Reflection
Metoda s pet prstiju.
M (mali prst) - proces razmišljanja. Koje znanje i iskustvo sam danas stekao?
B (neimenovano) - ciljna blizina. Šta sam danas uradio i šta sam postigao?
OD (srednje) - stanje duha. Kakvo je danas bilo moje raspoloženje?
Imati (indeks) - usluga, pomoć. Kako sam danas pomogao, kako sam ugodio ili šta sam doprinio?
B (velika) - vedrina, fizička spremnost. Kakvo je moje fizičko stanje bilo danas? Šta sam učinio za svoje zdravlje?
Soli ili hloridi hlorovodonične kiseline- spojevi hlora sa svim elementima koji imaju nižu vrijednost elektronegativnosti.
Metalni kloridi- čvrste materije. Uglavnom se dobro topi u vodi, ali AgCl, CuCl, HgCl2, TlCl i PbCl2- slabo rastvorljiv. Kloridi alkalijskih i zemnoalkalnih metala su neutralni. Povećanje broja atoma hlora u molekulima hlorida dovodi do smanjenja polariteta hemijske veze i termičke stabilnosti klorida, povećanja njihove hlapljivosti i tendencije ka hidrolizi. Otopine hlorida drugih metala imaju kiselu reakciju uslijed hidrolize:
Kloridi nemetala su supstance koje mogu biti u bilo kom agregacijskom stanju: plinovite (HCl), tečne (PCl3) i čvrste (PCl5). Također ući u reakciju hidrolize:
Neki hloridi nemetala su složena jedinjenja, na primjer, PC15 se sastoji od [PCl4] + i [PCl6] - jona. Kloridi broma i joda nazivaju se interhalogenim spojevima. Određeni broj hlorida karakterizira povezivanje i polimerizacija u tečnoj i plinskoj fazi sa stvaranjem kloridnih mostova između atoma.
Prijem.Dobija se reakcijom metala sa hlorom ili interakcijom hlorovodonične kiseline sa metalima, njihovim oksidima i hidroksidima, takođe razmenom sa nekim solima:
Kvalitetno i kvantitativno odredite jon hlora pomoću srebrovog nitrata. To rezultira talogom nalik bijeloj pahuljici.
Kloridikoristi se u proizvodnji i u organskoj sintezi. Stvaranje isparljivih hlorida temelji se na obogaćivanju i razdvajanju mnogih obojenih i rijetkih metala. Natrijum hlorida- da se dobije natrijum hidroksid, hlorovodonična kiselina, natrijum karbonat, hlor. Takođe se koristi u prehrambenoj industriji i proizvodnji sapuna. Kalijum hlorid- kao kalijevo gnojivo. Barijev hlorid- sredstva za suzbijanje štetočina od insekata. Cink hlorid- za impregnaciju drveta, kao konzervans protiv propadanja, kod lemljenja metala. Kalcijum hloridbezvodni se u medicinskoj praksi koristi za sušenje supstanci (gasova), a njegov kristalni hidrat koristi se kao sredstvo za hlađenje. Srebrni hloridkoristi se za izradu fotografija. Živin hlorid- otrovna smjesa, koristi se kao sredstvo za čišćenje sjemena, štavljenje kože, bojenje tkanina. Djeluje kao katalizator u organskoj sintezi. Kao dezinficijens. Amonijum hloridkoristi se u industriji bojenja, galvanizacije, lemljenja i kalajisanja.
Kraj rada -
Ova tema pripada odjeljku:
Neorganski varalica
Cheat sheet o anorganskoj kemiji ... Olga Vladimirovna Makarova ...
Ako vam je potreban dodatni materijal o ovoj temi ili niste pronašli ono što tražite, preporučujemo upotrebu pretraživanja u našoj radnoj bazi:
Šta ćemo s primljenim materijalom:
Ako se ovaj materijal pokazao korisnim za vas, možete ga spremiti na svoju stranicu na društvenim mrežama:
| Tweet |
Sve teme u ovom odjeljku:
Materija i njeno kretanje
Materija je objektivna stvarnost sa svojstvom kretanja. Sve što postoji su različite vrste pokretnih materija. Materija postoji nezavisno od svjesnosti
Tvari i njihova promjena. Predmet anorganske hemije
Supstance - vrste materije, čije diskretne čestice imaju konačnu masu mirovanja (sumpor, kiseonik, kreč itd.). Fizička tijela sastoje se od supstanci. Svaki
Periodni sustav elemenata D.I. Mendeleev
Periodični zakon otkrio je 1869. D.I. Mendeleev. Takođe je stvorio klasifikaciju hemijskih elemenata, izraženu u obliku periodičnog sistema. Učini me
Vrijednost periodnog sistema Mendelejeva.
Periodni sustav elemenata bio je prva prirodna klasifikacija hemijskih elemenata, koja je pokazala da su međusobno povezani, a također je poslužila kao daljnje istraživanje.
Teorija hemijske strukture
Teoriju hemijske strukture razvio je A.M. Butlerov, ima sljedeće položaje: 1) atomi u molekulima povezani su jedni s drugima
Opšte karakteristike P-, S-, D-elemenata
Elementi u periodičnom sistemu Mendelejeva podijeljeni su na s-, p-, d-elemente. Ova se podjela vrši na osnovu toga koliko nivoa ima elektronska ljuska atoma elementa
Kovalentna veza. Metoda valentne veze
Hemijska veza koju izvode zajednički elektronski parovi koji nastaju u ljuskama vezanih atoma koji imaju antiparalelne spinove naziva se atomska ili kovalentna
Nepolarne i polarne kovalentne veze
Uz pomoć hemijske veze, atomi elemenata u sastavu supstanci drže se blizu jedan drugog. Vrsta hemijske veze ovisi o raspodjeli gustine elektrona u molekuli.
Multicentrične komunikacije
U procesu razvoja metode valentnih veza, ispostavilo se da su stvarna svojstva molekule posredna između onih opisanih odgovarajućom formulom. Takvi molekuli
Jonska veza
Veza koja je nastala između atoma sa oštro izraženim suprotnim svojstvima (tipični metal i tipični nemetal), između kojih nastaju elektrostatičke sile privlačenja
Vodikova veza
80-ih godina XIX veka. M.A. Ilyinsky N.N. Beketov je otkrio da je atom vodonika u kombinaciji sa atomom fluora, kiseonika ili azota sposoban za stvaranje
Pretvorba energije u hemijskim reakcijama
Hemijska reakcija - transformacija jednog ili nekoliko polaznih materijala u druge hemijski sastav ili strukturu supstance. U poređenju sa nuklearnim reaktorima
Lančane reakcije
Postoje kemijske reakcije u kojima je interakcija između komponenata prilično jednostavna. Postoji vrlo široka grupa složenih reakcija. U tim reakcijama
Opšta svojstva nemetala
Na osnovu položaja nemetala u periodičnom sistemu Mendelejeva moguće je identificirati njihova karakteristična svojstva. Možete odrediti broj elektrona u vanjskom en
Vodik
Vodik (H) - 1. element Mendelejeva periodičnog sistema - I i VII grupe, glavna podskupina, 1 period. Vanjski s1 podnivo ima 1 valentni elektron i 1 s2
Vodikov peroksid
Peroksid ili vodonik-peroksid je vodikov spoj (peroksid). Formula: N2O2 Fizička svojstva: vodonik-peroksid - bezbojni sirup
Opće karakteristike halogene podskupine
Halogeni - elementi VII grupe - fluor, hlor, brom, jod, astatin (astatin je slabo proučen zbog svoje radioaktivnosti). Halogeni su visoko izraženi nemetali. Samo jod u zaostatku
Hlor. Hlorovodonik i hlorovodonična kiselina
Hlor (Cl) - nalazi se u 3. periodu, u VII grupi glavne podgrupe periodičnog sistema, serijski broj 17, atomska masa 35,453; odnosi se na halogene.
Kratke informacije o fluoru, bromu i jodu
Fluor (F); brom (Br); jod (I) spada u skupinu halogena. Oni stoje u 7. grupi glavne podskupine periodičnog sistema. Opšta elektronska formula: ns2np6.
Opće karakteristike podskupine kisika
Podgrupa kisika ili halkogeni - šesta grupa D.I. Mendeleva, koja uključuje sljedeće elemente: 1) kiseonik - O; 2) sumpor
Kiseonik i njegova svojstva
Kiseonik (O) je u glavnoj podskupini u periodu 1, grupa VI. p-element. Elektronska konfiguracija 1s22s22p4. Broj elektrona na vanjskoj ur
Ozon i njegova svojstva
U čvrstom stanju, kiseonik ima tri modifikacije:? -,? - i? - modifikacije. Ozon (O3) je jedna od alotropskih modifikacija kisika
Sumpor i njegova svojstva
Sumpor (S) se prirodno javlja u spojevima i slobodnom obliku. Spojevi sumpora su takođe česti, poput olovnog sjaja PbS, mješavine cinka ZnS, bakrenog sjaja Cu
Vodikov sulfid i sulfidi
Vodikov sulfid (H2S) je bezbojni plin s oštrim mirisom raspadajućih proteina. U prirodi postoje ulazi mineralnih izvora, vulkanski plinovi, truli otpad, kao i
Svojstva sumporne kiseline i njen praktični značaj
Struktura formule sumporne kiseline: Proizvodnja: glavna metoda za proizvodnju sumporne kiseline iz SO3 je kontaktna metoda.
Hemijska svojstva.
1. Koncentrovana sumporna kiselina je jako oksidirajuće sredstvo. Redoks reakcije zahtijevaju zagrijavanje, a produkt reakcije je uglavnom SO2.
Prijem.
1. U industriji se azot dobija ukapčavanjem vazduha uz naknadno isparavanje i odvajanje dušika od ostalih gasnih frakcija vazduha. Rezultirajući azot sadrži primjese plemenitih plinova (argon).
Opšte karakteristike azotne podskupine
Podgrupa azota je peta grupa, glavna podskupina D.I. Mendeleev. Sadrži elemente: azot (N); fosfor (P); arsen (
Amonijum (azotni hlorid).
Proizvodnja: u industriji do kraja 19. vijeka amonijak se dobivao kao nusproizvod tijekom koksiranja uglja koji sadrži do 1-2% azota. Na početku
Amonijeve soli
Amonijeve soli su složene tvari, uključujući amonijeve katione NH4 + i kisele ostatke. Fizička svojstva: amonijeve soli - t
Azotni oksidi
S kisikom, N stvara okside: N2O, NO, N2O3 NO2, N2O5 i NO3. Dušikov oksid I - N2O - dušikov oksid, "gas koji se smije". Fizička svojstva:
Azotna kiselina
Azotna kiselina je bezbojna tečnost koja "puši" u zraku oštrog mirisa. Hemijska formula HNO3. Fizička svojstva na temperaturi
Alotropne modifikacije fosfora
Fosfor formira nekoliko alotropskih modifikacija - modifikacija. Fenomen alotropnih modifikacija u fosforu uzrokovan je stvaranjem različitih kristalnih oblika. Bijeli fosfo
Fosforni oksidi i fosforne kiseline
Element fosfor formira brojne okside, od kojih su najvažniji fosfor (III) oksid P2O3 i fosfor (V) oksid P2O5. Fos oksid
Fosforne kiseline.
Nekoliko kiselina odgovara fosfornom anhidridu. Glavna je ortofosforna kiselina H3PO4. Dehidrirana fosforna kiselina predstavljena je u obliku bezbojnih prozirnih kristala
Mineralna gnojiva
Mineralna gnojiva - anorganske supstance, uglavnom soli, koje sadrže hranjive sastojke potrebne biljkama i koriste se za povećanje plodnosti
Ugljenik i njegova svojstva
Ugljenik (C) je tipični nemetal; u periodičnom sistemu je u 2. periodu IV grupe, glavne podskupine. Atomski broj 6, Ar \u003d 12,011 amu, naboj jezgre +6.
Alotropne modifikacije ugljenika
Ugljenik tvori 5 alotropskih modifikacija: kubični dijamant, heksagonalni dijamant, grafit i dva oblika karabina. Heksagonalni dijamant pronađen u meteoritima (mineral
Ugljenikovi oksidi. ugljena kiselina
Ugljenik sa kiseonikom stvara okside: SO, SO2, S3O2, S5O2, S6O9, itd. Ugljen monoksid (II) - SO. Fizička svojstva: ugljen monoksid, b
Silicijum i njegova svojstva
Silicijum (Si) je u 3. periodu, IV grupa glavne podskupine periodičnog sistema. Fizička svojstva: silicijum postoji u dvije modifikacije: amo
Postoje tri vrste unutarnje strukture primarnih čestica.
1. Suspenzoidi (ili nepovratni koloidi) su heterogeni sistemi čija se svojstva mogu utvrditi razvijenim sučeljem. U poređenju sa suspenzijama, ona je visoko raspršena
Soli silicijeve kiseline
Općenita formula silicijevih kiselina je n SiO2 m m H2O. U prirodi se nalaze uglavnom u obliku soli, malo je izoliranih u slobodnom obliku, na primjer HSiO (orto
Primanje cementa i keramike
Cement je najvažniji materijal u građevinarstvu. Cement se dobiva pečenjem mješavine gline i krečnjaka. Pri pečenju smjese CaCO3 (soda pepeo)
Fizička svojstva metala
Svi metali imaju niz zajedničkih, karakterističnih svojstava. Opšta svojstva smatraju se: visoka električna i toplotna vodljivost, plastičnost. Širenje parametara za met
Hemijska svojstva metala
Metali imaju nizak potencijal jonizacije i afinitet prema elektronima, pa u hemijskim reakcijama djeluju kao reduktori, u otopinama koje formiraju
Metali i legure u tehnologiji
U periodnom sustavu od 110 poznatih elemenata, 88 su metali. U XX. Stoljeću uz pomoć nuklearnih reakcija dobiveni su radioaktivni metali, koji to nisu
Glavne metode dobivanja metala
Veliki broj metala nalazi se u prirodi u obliku spojeva. Nativni metali su oni koji se nalaze u slobodnom stanju (zlato, platina, str
Korozija metala
Korozija metala (corrosio - korozija) je fizička i hemijska reakcija metala i legura sa okoliš, uslijed čega gube svoja svojstva. U srcu
Zaštita metala od korozije
Zaštita metala i legura od korozije u agresivnom okruženju zasniva se na: 1) povećanju otpornosti samog materijala na koroziju; 2) smanjenje agresivnosti
Opće karakteristike litijumske podskupine
Podgrupa litijuma - 1 grupa, glavna podgrupa - uključuje alkalne metale: Li - litijum, Na - natrijum, K - kalijum, Cs - cezijum, Rb - rubidijum, Fr - francijum. Ukupan elektron
Natrijum i kalijum
Natrijum i kalijum - alkalni metali su u grupi 1 glavne podskupine. Fizička svojstva: slično u fizička svojstva: svijetlo srebrna
Kaustične lužine
Alkalije formiraju hidrokside alkalnih metala 1. grupe glavne podskupine kada se rastvore u vodi. Fizička svojstva: rastvori lužina u vodi su sapunasti
Natrijumove i kalijumove soli
Natrijum i kalijum formiraju soli sa svim kiselinama. Natrijumove i kalijumove soli su vrlo slične hemijska svojstva... Karakteristična karakteristika ovih soli je, prema tome, dobra topljivost u vodi
Opće karakteristike podskupine berilija
Podgrupa berilij uključuje: berilij i zemnoalkalijske metale: magnezijum, stroncij, barijum, kalcijum i radijum. Najčešći u prirodi kao spojevi
Kalcijum
Kalcijum (Ca) je hemijski element 2. grupe periodičnog sistema, zemnoalkalijski je element. Prirodni kalcijum sastoji se od šest stabilnih izotopa. Conf
Kalcijum oksid i hidroksid
Kalcijum-oksid (CaO) - živo vapno ili izgarani kreč - bijela je tvar otporna na vatru koju tvore kristali. Kristalizira u kubnom kristalu usmjerenom na lice
Tvrdoća vode i kako je ukloniti
Budući da je kalcij raširen u prirodi, njegove soli se u velikim količinama nalaze u prirodnim vodama. Voda koja sadrži soli magnezijuma i kalcijuma naziva se f
Opšte karakteristike borne podskupine
Vanjska elektronička konfiguracija za sve elemente podskupine je s2p1. Karakteristično svojstvo podskupine IIIA je potpuno odsustvo metalnih svojstava u boru i tipu
Aluminijum. Primena aluminijuma i njegovih legura
Aluminijum se nalazi u 3. grupi glavne podskupine, u 3. periodu. Serijski broj 13. Atomska masa ~ 27. P-element. Elektronska konfiguracija: 1s22s22p63s23p1.Vani
Aluminijum oksid i hidroksid
Aluminijev oksid - Al2O3. Fizička svojstva: aluminijev oksid je bijeli amorfni prah ili vrlo tvrdi bijeli kristali. Molekulska težina \u003d 101,96, gustina - 3,97
Opšte karakteristike hromske podskupine
Elementi hromske podskupine zauzimaju srednji položaj u nizu prelaznih metala. Imati visoke temperature topljenje i ključanje, prazni prostori na elektroniku
Kromovi oksidi i hidroksidi
Krom tvori tri oksida: CrO, Cr2O3 i CrO3. Krom II oksid (CrO) - osnovni oksid - crni prah. Snažno redukcijsko sredstvo. CrO se rastvara u razblaženoj solnoj kiselini
Kromati i dihromati
Kromati su soli hromske kiseline H2Cr04, koja postoji samo vodene otopine s koncentracijom ne većom od 75%. Valencija hroma u hromatima je 6. Kromati su
Opšte karakteristike porodice gvožđa
Porodica željeza dio je bočne podskupine osme skupine i prva je trijada u njoj, koja uključuje željezo, kobalt nikal
Spojevi gvožđa
Gvozdeni oksid (II) FeO je crna kristalna supstanca, nerastvorljiva u vodi i lužinama. FeO odgovara osnovi Fe (OH) 2.
Proces domene
Postupak visoke peći - topljenje sirovog gvožđa u visokoj peći. Visoka peć je postavljena vatrostalnom opekom visine 30 m i unutarnjeg promjera 12 m. Gornja polovina je w
Lijevano željezo i čelik
Legure gvožđa - metalni sistemi, čija je glavna komponenta željezo. Klasifikacija legura gvožđa: 1) legure gvožđa sa ugljenikom (br
Teška voda
Teška voda - deuterijum oksid D2O sa kisikom prirodnog izotopskog sastava, bezbojna tečnost, bez mirisa i okusa. Teška voda bila je otvorena
Hemijska i fizička svojstva.
Teška voda ima tačku ključanja 101,44 ° C i tačku topljenja 3,823 ° C. D2O kristali imaju istu strukturu kao i obični kristali leda, razlika u veličini
